Method Article
微分動的顕微鏡を用いた細胞骨格ダイナミクスの定量化
要約
差動動的顕微鏡(DDM)は、動的光散乱と顕微鏡の機能を兼ね備えています。ここでは、DDMを使用して、ビメンチンネットワーク内の粒子の亜拡散およびケージドダイナミクスおよび活性ミオシン駆動アクチン - 微小管複合体の弾道運動を定量化することによって、再構成された細胞骨格ネットワークを特徴付けるプロセスを提示する。
要約
細胞は、その非常にダイナミックな細胞骨格のために、這い回り、自己修復し、そしてその硬さを調整することができる。そのようなものとして、細胞骨格バイオポリマーの再構成ネットワークは、活性で適応可能な材料のホストをもたらし得る。しかし、正確に調整された特性を持つそのような材料を設計するには、ダイナミクスがネットワーク組成および合成方法にどのように依存するかを測定する必要があります。このようなダイナミクスを定量化することは、複合ネットワークの時間、空間、および定式化空間にわたる変動によって挑戦される。ここでのプロトコルは、フーリエ解析技術である微分動的顕微鏡(DDM)が生体高分子ネットワークのダイナミクスを定量化する方法を説明し、特に細胞骨格ネットワークの研究に適しています。DDMは、レーザースキャンコンフォカル、広視野蛍光、明視野イメージングなど、さまざまな顕微鏡モダリティを使用して取得した画像の時系列を処理します。このような画像シーケンスから、波動ベクトルのスパンにわたる密度変動の特徴的な非相関時間を抽出することができます。DDM分析を実行するためのユーザーフレンドリーなオープンソースのPythonパッケージも開発されています。このパッケージを使用すると、中間フィラメント(ビメンチン)ネットワークおよび活性アクチン-微小管ネットワークのデータでここで実証されているように、標識された細胞骨格成分または埋め込みトレーサー粒子のダイナミクスを測定することができます。プログラミングや画像処理の経験がないユーザーは、このソフトウェアパッケージと関連ドキュメントを使用してDDMを実行できます。
概要
細胞骨格は、真核細胞の細胞質を横切って広がるタンパク質フィラメントのネットワークであり、細胞表面を核に結びつける。これは、独自の材料特性を有し、大きくて繰り返される機械的負荷に対する機械的保護を提供するだけでなく、動的セル形状変化を駆動する1。再構成された細胞骨格ネットワークは、埋め込み粒子のケージから分子モーターによって駆動される弾道運動まで、さまざまな興味深い動的挙動を生じさせることができる2,3,4,5,6,7,8,9,10,11 .このようなネットワークのダイナミクスを分析する方法は、埋め込みトレーサー微小球の動きを追跡する6、7、12、13、14、経時的なタンパク質密集クラスターのサイズを追跡する画像解析8、動的光散乱15、粒子画像速度測定4、16、17、18、19を含む、経時的な画像のパワースペクトル密度を計算する19、およびカイモグラフ解析20。再構成された細胞骨格ネットワークに関する研究が進むにつれて、細胞力学を理解するにせよ活性物質を理解するにせよ、ダイナミクスを特徴付けるための堅牢で偏りのない、再現可能な方法がますます必要になっています。示差動的顕微鏡(DDM)21,22は、細胞骨格ダイナミクスの研究に使用されている比較的新しい技術であり、少数のユーザー定義パラメータでダイナミクスを効率的に定量化するそのような技術の1つです。ここで説明するソフトウェアパッケージを使用すると、プログラミングや画像解析の経験がほとんどない研究者は、DDMを自分の仕事に活用することができます。
DDMは、サンプルのダイナミクスを抽出するための画像解析技術です。粒子追跡や粒子画像速度測定と同様に、DDMは、典型的には顕微鏡で記録された時系列画像(しばしば数千枚の画像)を必要とする。粒子追跡とは異なり、個々のフィーチャやトレーサービーズは、画像内で局在化(または局在化可能)である必要はありません。粒子追跡と粒子画像速度測定の両方とは異なり、DDMでは、ユーザー指定のパラメータが比較的少ない状態でアンサンブルダイナミクスを回復します。DDMでは、画像はフーリエ空間で解析され、q(q = 2πu、uは空間周波数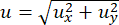 の大きさ)の範囲にわたる密度変動の減衰時間を決定します。人は散乱のような情報を得るが、顕微鏡21,22,23で取得した実空間画像を用いる。したがって、広視野蛍光22、24、共焦点蛍光25、偏光26、暗視野27、または明葉状蛍光28顕微鏡などの顕微鏡の様々なコントラスト発生方法を利用することができる。さらに、DDM分析に使用される画像は、相補的な情報を提供するために、粒子追跡または粒子画像速度測定に使用され得る。
の大きさ)の範囲にわたる密度変動の減衰時間を決定します。人は散乱のような情報を得るが、顕微鏡21,22,23で取得した実空間画像を用いる。したがって、広視野蛍光22、24、共焦点蛍光25、偏光26、暗視野27、または明葉状蛍光28顕微鏡などの顕微鏡の様々なコントラスト発生方法を利用することができる。さらに、DDM分析に使用される画像は、相補的な情報を提供するために、粒子追跡または粒子画像速度測定に使用され得る。
動的光散乱と光学顕微鏡の機能のこの組み合わせにより、DDMは強力で汎用性の高い技術となっています。2008年のセルビーノとトラップによる最初の記述以来、DDMが73nmコロイド粒子の拡散を測定することが実証された21、DDMは、流動コロイド29、コロイド凝集30、31、ネマチック液晶26の粘弾性、コロイドゲル32のダイナミクス、粗大化フォーム33、閉じ込められた環境におけるナノ粒子34、 35、36、37、細菌運動性38、39、40、41、弱散乱タンパク質クラスター42、流体界面43での毛細血管波、および他の系の拡散。DDMを採用した出版物のより完全なリストを探している人は、主題22,23,44,45に関する徹底的なレビュー論文を参照することができます。
DDMは、生物学的ネットワークのダイナミクスを調査するためにも使用されています。DrechslerらはDDMを用いて、生きたショウジョウバエ卵母細胞におけるアクチンの動態を測定した46。Burlaらは、ヒアルロン酸およびヒアルロン酸-コラーゲン複合体のネットワークにおけるトレーサー粒子の動態を定量化した47。再構成された細胞骨格ネットワーク9,10におけるトレーサー粒子のダイナミクスを研究するためのDDMのいくつかの使用、そのようなネットワークにおけるDNA分子の輸送48,49、および活性再構成されたネットワークのダイナミクスも文書化されている11、50、51。このような系のダイナミクスを測定する際のDDMの利点は、個々の粒子または分子を局在化および追跡する必要がないことです。したがって、例えば、混雑した環境におけるDNA分子のダイナミクスは、そのような小さくて非球状の分子を追跡するのが難しいにもかかわらず、DDMで測定することができる。さらに、蛍光顕微鏡では、多色標識を使用して、複雑な複合材料中の個々の成分のダイナミクスを選択的に測定することができます。
DDM を実行するには、一連のイメージ I(x,y,t) が時間の経過と共に取得されます。所与のラグタイムΔtについて、そのラグタイムによって区切られた画像のすべての(またはサブセットの)ペアが見出される。前記各ペアの差の二乗フーリエ変換と、
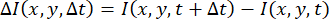
は一緒に計算および平均化されます。この量は、 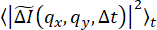 ダイナミクスが等方性であることを条件に、放射状に平均化されます。これにより、DDM 行列 (イメージ構造関数とも呼ばれます)
ダイナミクスが等方性であることを条件に、放射状に平均化されます。これにより、DDM 行列 (イメージ構造関数とも呼ばれます) 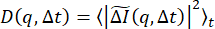 が生成されます。このプロセスを 図 1 にグラフィカルに示します。この DDM 行列からサンプルのダイナミクスを決定するために、DDM 行列は次の形式をとると仮定します。
が生成されます。このプロセスを 図 1 にグラフィカルに示します。この DDM 行列からサンプルのダイナミクスを決定するために、DDM 行列は次の形式をとると仮定します。
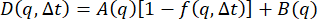
ここで、Aは顕微鏡の詳細とサンプルの構造に依存する振幅、Bは画像内のノイズに依存する背景、f(q、Δt)はダイナミクス21,22に関する情報を含む中間散乱関数(ISF)です。単純なケースでは、
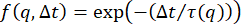
ここで、τ は特性減衰時間または非相関時間です。このようなISFは、希薄コロイド懸濁液21、24、27、37、40、52のようなエルゴード系にDDMを採用するいくつかの研究において使用されている。ただし、他の形式の ISF を使用して、さまざまな種類のダイナミクスをモデル化できます。たとえば、キュムラント展開を使用して、多分散サンプルのISFを次のようにモデル化することができます。
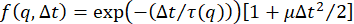
ここで、μは多分散度の尺度である42,53;密度の変動が2つの別々のモードで減衰する場合、次のようなISFを使用できます
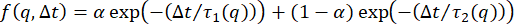 26, 54, 55, 56 , 57;
26, 54, 55, 56 , 57;
他のISFは、遊泳微生物または他の活性粒子38、39、40、41、58、59に使用することができる。

図 1: DDM 分析の概要 画像の時系列から、画像差のフーリエ変換が計算され、DDM行列が計算されます。DDM 行列をモデルに当てはめて、 q 値の範囲にわたる密度変動の時間スケールを決定することができます。 この図の拡大版を表示するには、ここをクリックしてください。
ここでは、Python で開発された DDM 解析ソフトウェアパッケージ PyDDM の使用について説明します。このソフトウェアパッケージは、過去数年間に私たちの研究所やその他の出版された研究によって行われた作業に基づいています。このソフトウェアパッケージを作成する主な動機には、(1)分析で使用されるメタデータとパラメータを追跡して保存する必要性が含まれます。(2)最初から最後までの詳細な分析例を含む徹底的な文書化。(3)データをフィッティングするために異なる数学モデルを採用する(または新しい)数学モデルを使用する簡単な方法(例えば、アクティブフィラメント60用に最近開発されたようなISFモデルを追加するのは簡単です)。DDM分析用の他のソフトウェアパッケージも存在しますが、すべてが十分に文書化され、オープンソースのプログラミング言語で書かれているわけではありません。たとえば、GPU (https://github.com/peterlu/ConDDM)25 で計算する C++ コード、フーリエ変換を時間内に使用して計算を高速化する C++ コード (https://github.com/giovanni-cerchiari/diffmicro)61、MATLAB および Python バージョン (https://github.com/MathieuLeocmach/DDM)40、MATLAB コード (https://sites.engineering.ucsb.edu/~helgeson/ddm.html)27、不確実性定量化 (https://github.com/UncertaintyQuantification/DDM-UQ)62。このPyDDMパッケージは十分に文書化されており、DDMマトリックスの計算方法と分析方法に多くの柔軟性を提供するため、プログラミングや画像解析のバックグラウンドに関係なくDDMを実装しようとしている研究者にとって役立つことを願っています。
このプロトコルは、このソフトウェアパッケージを使用して 、in vitro再構成 された細胞骨格ネットワークのダイナミクスを定量化する方法を示しています。これは、(1)明視野顕微鏡で撮影したビメンチンネットワークに埋め込まれたサブミクロントレーサー粒子の画像と、(2)レーザー走査共焦点顕微鏡で撮影したミオシン駆動活性と絡み合った複合ネットワーク内の蛍光標識アクチンおよび微小管フィラメントの画像の2つの異なるイメージングデータセットを使用することによって行われます。これら2つのデータセットの分析は、さまざまなイメージングモダリティ(明視野または共焦点蛍光など)で撮影された画像を分析し、埋め込みトレーサーまたは標識フィラメントからダイナミクスを抽出し、さまざまなダイナミクス(例えば、亜拡散性および拘束性または弾道性)を定量化する機能を含む、DDMの注目すべき強みを強調しています。
プロトコル
注: 次のプロトコルの各ステップに付随するコードを含む Jupyter ノートブック ファイルは、次の GitHub リポジトリ https://github.com/rmcgorty/PyDDM/tree/main/Examples にあります。そのファイルのPDFは、補足ファイル1に含まれています。さらに、各関数とクラスのコードとドキュメントのチュートリアルは、https://rmcgorty.github.io/PyDDM/ Web サイトにあります。
1. ソフトウェアのインストール
- サンプルの DDM 分析ファイルに従うには、コードを実行するための Jupyter ノートブックをインストールします。NumPyやMatplotlibなど、他の必要な一般的なPythonパッケージもインストールしてください。これらのパッケージはすべて Anaconda ディストリビューションにバンドルされています (https://www.anaconda.com/products/individual を参照)。
- Python パッケージ xarray63 をインストールします。このパッケージは、メタデータと分析パラメーターを整理および格納するために必要です。Anaconda ディストリビューションを使用している場合は、次のコマンドを使用して xarray を (推奨される依存関係と共に) インストールします。
conda install -c conda-forge xarray dask netCDF4 ボトルネック - 次のコマンドを使用して PyYAML パッケージをインストールします。
conda install -c anaconda yaml
このパッケージは、分析する画像に関するメタデータと、分析とフィッティングのためにユーザーが設定したパラメータを読み取るために必要です。 - GitHubリポジトリからダウンロードするか、gitコマンドを使用して、PyDDMパッケージをインストールします。
gitクローン https://github.com/rmcgorty/PyDDM.git
2. イメージングセッションの計画
- 最適なイメージングモダリティと光学設定を選択します。前述のように、DDMは多くの顕微鏡法で使用することができる。
- 使用する適切な対物レンズと画像サイズの計画を支援するには、ピクセルサイズと合計画像サイズに基づいてプローブされる波数 の範囲qを決定します。これらの計算に基づいて、倍率と視野の選択が実験に最適であることを確認します。ここで分析した画像では、60 x 1.4 NAの対物レンズと256 x 256ピクセル、ピクセルサイズ0.83 μmの画像サイズが、アクティブなアクチン-微小管複合ネットワークに使用されました。ビメンチンネットワークに埋め込まれたビーズの画像には、100x 1.4 NAの対物レンズと、0.13 μmのピクセルサイズで512 x 512ピクセルの画像サイズを使用しました。
メモ: 最小 q は 2π/NΔ x で設定され、画像サイズ (正方形と仮定) は N ピクセル×ピクセル、ピクセルサイズは Δx です。最大qはπ/Δxと2πNA/λの最小値で、NAは撮像対物レンズの開口数、λは光の波長です(明視野イメージングの場合、NAを(NA対物レンズ+NAコンデンサ)/2に置き換えることができます)。 - 次に、調査するタイムスケールの範囲を検討します。通常、DDM 分析は、少なくとも 1000 フレームのシーケンスで行われます。
- 適切なフレーム レートを決定するには、サンプル内のフィーチャが最小解決可能長スケール (最大 q に対応) のオーダーで距離を移動するのにかかる予想時間を考慮します。
- プローブされるタイムスケールの範囲の上限を考慮する際には、典型的には、所与のラグタイムΔt の何百もの画像差のパワースペクトルが、ノイズを低減するのに十分な統計を提供するために一緒に平均化されることを認識してください。したがって、プローブされた最大タイムスケールよりも長い画像シーケンスを取得します。
注:期待される拡散係数 Dまたは速度 vがわかっている場合、τ = 1/Dq2またはτ = 1/vq と、視野とピクセルサイズに基づいて決定された qの範囲を使用して、予想される特性減衰時間を推定できます。アクセス可能な q範囲にわたって期待されるτ値の範囲は、フレームレートの選択と集録するフレーム数を導くのに役立ちます。
3. サンプル調製と画像取得
注:代表的な結果のセクションで提示されたデータに使用されるサンプル調製およびイメージング設定の詳細については、著者11、51、64および補足ファイル2からの以前の出版物を参照してください。
- プローブする時間と長さのスケールを考慮して、理想的には1000フレームを超える画像シーケンスを取得します。
注: このコードでは、正方形の画像または画像内の正方形の関心領域が分析されるため、それに応じてフレーム サイズを調整します。 - 画像シーケンスを3次元グレースケールTIFFスタックとして保存します。または、ニコンインスツルメンツのシステムで使用される形式であるND2形式は、インストールされたパッケージで読み取ることができます。画像が異なる形式で保存されている場合は、ImageJまたは他の画像処理プログラムを使用して画像をTIFFスタックに変換します。
メモ: ND2 ファイルを使用している場合は、https://github.com/Open-Science-Tools/nd2reader のパッケージ nd2reader をインストールする必要があります。
4. パラメータ設定
- PyDDMコードリポジトリのexampleフォルダに用意されているパラメータファイルexample_parameter_file.ymlのコピーを作成します。この YAML ファイルを、NotePad++ などのテキスト エディターまたは JupyterLab のテキスト エディターで開きます。代表的な結果のセクションで提示されたデータの分析に使用されるYAMLパラメータファイルの例については、 補足ファイル2 を参照してください。
- コピーしたYAMLファイルで、解析する画像シーケンスに対応するデータディレクトリとファイル名を指定します。メタデータ セクションで、ピクセル サイズとフレーム レートを指定します。
- 「Analysis_parameters」セクションで、DDM マトリックスの計算方法の詳細を指定します。ここでのパラメーターの一部はオプションです。
- 少なくとも、パラメーター number_lag_timesとlast_lag_timeの値を指定します。これらは、DDM 行列を計算するさまざまなラグ タイムの数と、使用する最長のラグ タイム (フレーム単位) にそれぞれ対応します。ここで用いたビメンチンネットワークにおけるトレーサービーズのデータについて、number_lag_timesパラメータおよびlast_lag_timeは、それぞれ60および1000であった。このコードは、1 フレーム (またはオプションのパラメーター first_lag_time が指定されている場合はその他の最小ラグ タイム) から対数間隔のlast_lag_timeまでのラグ タイムの DDM 行列を計算します。
メモ: M フレームが集録された場合、M-1 ほどの大きさのラグ タイムの DDM 行列を計算できます。ただし、このような大きなラグ タイムで統計が不十分な場合、データはノイズが多い可能性があります。DDM 行列を計算する最長のラグ タイムはデータの詳細によって異なりますが、画像系列の全期間の約 3 分の 1 を試すことをお勧めします。
- 少なくとも、パラメーター number_lag_timesとlast_lag_timeの値を指定します。これらは、DDM 行列を計算するさまざまなラグ タイムの数と、使用する最長のラグ タイム (フレーム単位) にそれぞれ対応します。ここで用いたビメンチンネットワークにおけるトレーサービーズのデータについて、number_lag_timesパラメータおよびlast_lag_timeは、それぞれ60および1000であった。このコードは、1 フレーム (またはオプションのパラメーター first_lag_time が指定されている場合はその他の最小ラグ タイム) から対数間隔のlast_lag_timeまでのラグ タイムの DDM 行列を計算します。
- DDM マトリックスまたは中間散乱関数 (ISF) をFitting_parametersセクションに収める方法の詳細を指定します。model パラメーターの下にモデルの名前を指定します。選択したモデルの各適合パラメータの初期推定値、下限値、および上限を指定します。
注記: 使用可能な継ぎ手モデルのリストを表示するには、関数print_fitting_modelsを実行します。これらのモデルは、PyDDM ウェブサイトのオンラインドキュメントにも記載されています。
5. DDM 行列の計算
- DDM_Analysisクラスのインスタンスを初期化します。これを行うには、YAMLファイルのファイル名を、完全なファイルパスを含むDDM_Analysisに渡して、上で説明したメタデータと分析パラメータを指定します。または、メタデータとパラメーターを Python ディクショナリ データ構造として渡します。
- 関数 calculate_DDM_matrix を実行して、DDM マトリックスを計算します。この計算には、フレームサイズとラグ回数に応じて数分以上かかる場合があります。一般的な実行時間については、 図 2 を参照してください。
- データセットと呼ばれる xarray パッケージのデータ構造に含まれる、返されたデータを検査します。このデータ構造は、ddm_dataset 属性の下に格納されます。
メモ: DDM 行列だけでなく、関連する変数やメタデータもこのデータ構造に格納されます。また、ネットワーク共通データ形式 (netCDF) 形式でディスクに保存されます。 - プロットと図を調べて、生成して表示します。これらの数値は、データディレクトリにもPDFファイルとして保存されます。
- 生成されたプロットの1つが、
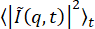 フーリエ変換された画像のアンサンブル平均二乗係数をqの関数として示していることがわかります。既定では、コードはこれを使用してバックグラウンド パラメーター B を推定します。大きなqの限界では、Bが背景
フーリエ変換された画像のアンサンブル平均二乗係数をqの関数として示していることがわかります。既定では、コードはこれを使用してバックグラウンド パラメーター B を推定します。大きなqの限界では、Bが背景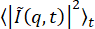 であるB / 2に近づくと仮定して、背景を推定します。
であるB / 2に近づくと仮定して、背景を推定します。 - がqのプラトーに達していない場合は
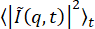 、Bを推定するために別の方法を使用します。これを実現するには、YAML ファイルまたはオプションのキーワード引数としてパラメーター background_method を関数calculate_DDM_matrixに設定します。Bを推定する方法の詳細については、代表的な結果のセクションを参照してください。
、Bを推定するために別の方法を使用します。これを実現するには、YAML ファイルまたはオプションのキーワード引数としてパラメーター background_method を関数calculate_DDM_matrixに設定します。Bを推定する方法の詳細については、代表的な結果のセクションを参照してください。
- 生成されたプロットの1つが、
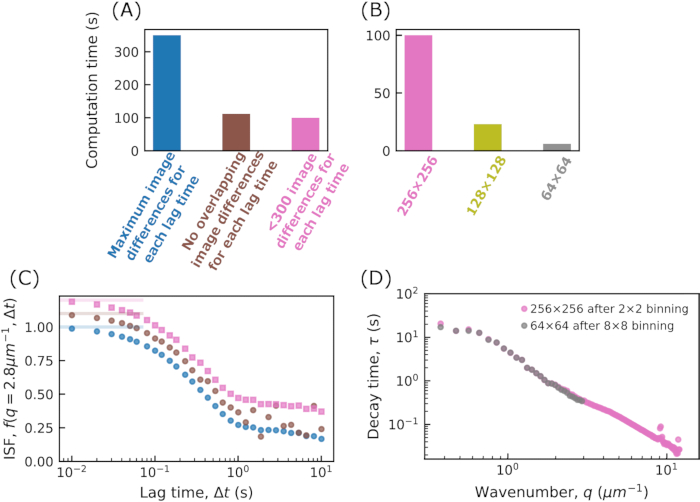
図 2: DDM 行列を計算するための計算時間。(A)および(B)にDDM行列を計算するための時間が、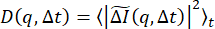 示されている。すべての場合に使用されるデータは、512 x 512 ピクセルの画像サイズを持つ 5000 フレームのムービーです。DDM 行列は 30 のラグ タイムで計算され、対数的には 1 フレーム (0.01 秒) から 1000 フレーム (10 秒) の間で間隔が空けられました。このコードは、32 GB RAMを搭載したIntel i7-10700 2.90 GHzデスクトップコンピュータで実行されました。(A)では、ラグタイムごとにDDM行列を計算する際に使用される画像差異の数を変化させる効果が示されている。このために、イメージはビン分割され、イメージ サイズは 256 x 256 になります。ラグタイムΔtごとに、そのΔtで区切られた画像が減算され、得られた行列がフーリエ変換される。所与のΔtに対して、そのΔtによって分離された画像のすべての対を使用することができる(青色で示す)、重複しない画像対のみを使用することができる(例えば、フレーム1および10、10および19など;茶色で示す)、または各Δtに対して300以下の画像対を使用することができる。(B)では、画像サイズを変化させることが計算時間に与える影響が示されている。画像は、2 x 2、4 x 4、または 8 x 8 ピクセルをグループ化してビン分割され、画像サイズはそれぞれ 256 x 256、128 x 128、または 64 x 64 になりました。それぞれについて、各ΔtのDDM行列を計算する際に約300個の画像ペアが使用される。(C)DDMマトリックスから、中間散乱関数(ISF)を抽出することができる。これは、(A)の3つのケースについて示されている。青色のデータポイント(オフセットなし)は、各Δtに最大数の画像ペアが使用される場合のISFに対応します。茶色のデータ点(オフセット0.1)は、重なり合っていない画像ペアが各Δtに使用される場合、ISFに対応します。ピンク色のデータポイント(オフセット0.2)は、各Δtに最大300個の画像ペアが使用されている場合、ISFに対応します。重なり合わない画像ペアを用いて見出されたISFは、長いΔtでノイズを示す。その場合、長いΔtで使用される画像ペアは少ない(例えば、1000フレームのΔtの場合、4つの画像ペアのみが使用される)。(d)ISFを指数関数に当てはめることにより、各波数qについて特性減衰時間τが決定される。ピンクでは、元の画像を 2 x 2 だけビニングした後の結果が表示され、画像サイズは 256 x 256 になります。グレーでは、8 x 8 でビニングした後の結果が表示され、画像サイズは 64 x 64 になります。データをビン分割することで、より高い波数でのダイナミクスに関する情報は失われますが、64 x 64 の画像の DDM 行列の計算は、256 x 256 の画像よりも約 16 倍高速です。この図の拡大版を表示するには、ここをクリックしてください。
示されている。すべての場合に使用されるデータは、512 x 512 ピクセルの画像サイズを持つ 5000 フレームのムービーです。DDM 行列は 30 のラグ タイムで計算され、対数的には 1 フレーム (0.01 秒) から 1000 フレーム (10 秒) の間で間隔が空けられました。このコードは、32 GB RAMを搭載したIntel i7-10700 2.90 GHzデスクトップコンピュータで実行されました。(A)では、ラグタイムごとにDDM行列を計算する際に使用される画像差異の数を変化させる効果が示されている。このために、イメージはビン分割され、イメージ サイズは 256 x 256 になります。ラグタイムΔtごとに、そのΔtで区切られた画像が減算され、得られた行列がフーリエ変換される。所与のΔtに対して、そのΔtによって分離された画像のすべての対を使用することができる(青色で示す)、重複しない画像対のみを使用することができる(例えば、フレーム1および10、10および19など;茶色で示す)、または各Δtに対して300以下の画像対を使用することができる。(B)では、画像サイズを変化させることが計算時間に与える影響が示されている。画像は、2 x 2、4 x 4、または 8 x 8 ピクセルをグループ化してビン分割され、画像サイズはそれぞれ 256 x 256、128 x 128、または 64 x 64 になりました。それぞれについて、各ΔtのDDM行列を計算する際に約300個の画像ペアが使用される。(C)DDMマトリックスから、中間散乱関数(ISF)を抽出することができる。これは、(A)の3つのケースについて示されている。青色のデータポイント(オフセットなし)は、各Δtに最大数の画像ペアが使用される場合のISFに対応します。茶色のデータ点(オフセット0.1)は、重なり合っていない画像ペアが各Δtに使用される場合、ISFに対応します。ピンク色のデータポイント(オフセット0.2)は、各Δtに最大300個の画像ペアが使用されている場合、ISFに対応します。重なり合わない画像ペアを用いて見出されたISFは、長いΔtでノイズを示す。その場合、長いΔtで使用される画像ペアは少ない(例えば、1000フレームのΔtの場合、4つの画像ペアのみが使用される)。(d)ISFを指数関数に当てはめることにより、各波数qについて特性減衰時間τが決定される。ピンクでは、元の画像を 2 x 2 だけビニングした後の結果が表示され、画像サイズは 256 x 256 になります。グレーでは、8 x 8 でビニングした後の結果が表示され、画像サイズは 64 x 64 になります。データをビン分割することで、より高い波数でのダイナミクスに関する情報は失われますが、64 x 64 の画像の DDM 行列の計算は、256 x 256 の画像よりも約 16 倍高速です。この図の拡大版を表示するには、ここをクリックしてください。
6. DDM マトリックスまたは ISF のフィッティング
- DDM_Fitクラスのインスタンスを初期化します。これを行うには、画像メタデータとフィッティング用のパラメータを含むYAMLファイルのファイル名をDDM_Fitに渡します。
- データのフィッティングに使用する DDM マトリックスまたは ISF のモデルを決定します。使用可能なモデルを一覧表示するには、関数 print_fitting_models を実行します。使用するモデルを YAML パラメーター・ファイルで指定するか、関数 reload_fit_model_by_name を使用します。
- 指定されたYAMLパラメータファイルで、選択したモデル内の各パラメータの初期推測と境界を設定します。パラメーターの初期推測を変更するには、関数 set_parameter_initial_guess を使用します。関数 set_parameter_bounds でパラメーターの境界を設定します。例えば、 補足ファイル2に見られるように、ビメンチンネットワーク内のトレーサービーズのデータの場合、崩壊時間の最初の推測は1秒であり、そのパラメータの境界は0.01秒および2000秒であった。
- 関数 fit で fit を実行します。この関数の出力に変数を代入すると、結果に簡単にアクセスできます。
メモ: この関数は、多くのオプションの引数を取ることができます。このような引数のリストと、それらを既定値以外の値に設定することを検討するタイミングについては、コード ドキュメントと提供されている例を参照してください。
7. 適合結果の解釈
- 関数fit_reportで適合値パラメータの適合値と q依存性を検査するためのプロットを生成します。
注:この関数は一連のプロットを生成し、これもPDFとして保存されます。この関数のオプションの引数を使用して、生成されるプロットを変更できます。 - 生成されたプロットの中には、4つの q値(fit_reportのオプションの引数として指定)のDDM行列またはISF(選択した適合モデルに応じて)を示す2 x 2サブプロットと、モデルと最適パラメータを使用した計算されたDDM行列またはISFを示す図があります。DDM マトリックスまたは ISF を対話式の方法で最適なものと共にプロットするには、Jupyter ノートブック環境を使用する場合に提供されている例に示すように、クラスBrowse_DDM_Fitsを使用します。
- 特性減衰時間τ対波数 qのプロットから、ダイナミクスが拡散性、部分拡散性、弾道的、または他のタイプの運動に従うかどうかを決定する。これは、τ と q の間のべき乗則関係を探すことによって行うことができます。
注: 関数 fit_report によって生成された τ 対 q の対数対数プロットでは、指定された範囲の q 値に対するべき乗則適合に対応する 3 本の線が表示されます。黒の実線は、τ 対 q をべき乗則 τ = 1 / Kq β に当てはめることに対応し、K と β は自由パラメータです。オレンジ色の破線は、単純な拡散へのフィッティング、τ = 1/Dq2 (Dは拡散係数) に対応します。青色の点線は、τ = 1 / vqへのフィッティングに対応し、vは速度です。
8. 結果の保存
- 適合の結果はxarrayデータセットに保存されます。xarray 関数 to_netcdf または Python の組み込みの pickle モジュールを使用して、このデータ構造をディスクに保存します。xarray 関数open_datasetを使用して、これらの netCDF ファイルをロードします。
- 関数 save_fit_results_to_excel を使用して、適合結果をデータと共にワークシート ファイルに保存します。
結果
ここでは、2つの異なる実験セットからPyDDMで行われた分析の例を示します。1組の実験では、サブミクロントレーサービーズを中間フィラメントタンパク質ビメンチンからなるネットワークに埋め込み、明視野モードで100倍対物レンズを使用して100フレーム/秒でイメージングしました(図3A)。ビメンチンは間葉系細胞で発現され、細胞質65の機械的特性および閉じ込められた遊走を行う細胞における核の機械的安定性の重要な決定因子である66、67。これまでのところ、再構成されたビメンチンネットワークは、主に巨視的レオロジー64、68、69によって研究されてきたが、一方、ダイナミクスは比較的ほとんど注目されていない13、70、71。これらの実験の詳細については、補足ファイル2を参照してください。他の一連の実験では、活性細胞骨格ネットワークをアクチン、微小管、およびミオシンで調製した。スペクトル的に異なる蛍光標識により、アクチンフィラメントと微小管フィラメントを、2.78フレーム/秒の60倍対物レンズを使用して2色レーザー走査共焦点顕微鏡でイメージングすることができました(図3B,C)。アクチンフィラメントと微小管フィラメントは、いずれも動的細胞形状変化の重要な駆動因子であり、それらの作用は機械的および生化学的相互作用によって調整される72。これらの実験のさらなる詳細は、11に記載される。これらの実験で撮影した画像シーケンスからの個々のフレームを図3に示す。

図3:解析した時系列からの画像(A)ビメンチンネットワークにおける0.6μmビーズの明視野画像。(B,C)レーザー走査型共焦点顕微鏡で60倍対物レンズで撮影した活性アクチン-微小管複合体中の(B)微小管および(C)アクチンの画像は、微小管イメージングに561nm励起光を使用し、アクチンイメージングに488nm励起光を使用した。この図の拡大版を表示するには、ここをクリックしてください。
ビメンチンネットワーク内のトレーサービーズの画像については、100フレーム/秒で512 x 512ピクセルのサイズの5000フレームのムービーが記録されました。これらから、DDM行列は、1〜1000フレーム、または0.01秒〜10秒の間の60対数間隔のラグタイムで計算されました。背景を推定するために、B、フーリエ変換された画像の二乗の平均を計算し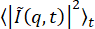 、55、73に
、55、73に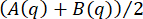 等しいように設定した。q値の最大10%以上で、この量はB / 2に等しく、Bはqから独立しているという仮定がなされました。これは B を推定するためのパッケージのデフォルトの方法ですが、background_method パラメーターを別の値に設定することで、他の方法も可能です。
等しいように設定した。q値の最大10%以上で、この量はB / 2に等しく、Bはqから独立しているという仮定がなされました。これは B を推定するためのパッケージのデフォルトの方法ですが、background_method パラメーターを別の値に設定することで、他の方法も可能です。
パラメータA(q)とBを から決定すると、DDM行列から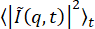 中間散乱関数(ISF)を抽出できます。ISF の例を図 4 に示します。図4Aでは、19 μMのビメンチン濃度を有するネットワークに埋め込まれた直径0.6 μmビーズの画像からのISFが示されている。図4Bでは、34μMのビメンチン濃度を有するネットワーク内の同種のビーズについてのISFが示されている。興味深いことに、どちらの場合もISFはゼロに減衰しませんでした。大きなラグタイムでは、ISFはエルゴード系ではゼロに近づくはずです。つまり、このようなシステムでは、密度変動は大きなラグタイムにわたって完全に相関関係を解消する必要があります。ここでのISFがゼロに減衰しなかったという事実は、計算されたDDM行列からISFを見つけるために使用されたA(q)とBの不正確な推定値に起因する可能性があります。注目すべきことに、ここで用いられる方法は、特定のシナリオ62においてBを過大評価し得る。しかし、トレーサービーズのダイナミクスは、ビーズがネットワークメッシュサイズに匹敵するサイズを有し、したがってケージ状になる可能性があるため、真に非エルゴードである可能性が高い。他のデータは、非人間性の発見を裏付けた。すなわち、ビーズサイズ0.6μmは、19μM濃度で0.4μm、34μM濃度で0.3μmのメッシュサイズで計算された平均値よりも大きかった。さらに、後に示すこれらのトレーサービーズの単一粒子追跡の結果も、限られた動きを示しました。
中間散乱関数(ISF)を抽出できます。ISF の例を図 4 に示します。図4Aでは、19 μMのビメンチン濃度を有するネットワークに埋め込まれた直径0.6 μmビーズの画像からのISFが示されている。図4Bでは、34μMのビメンチン濃度を有するネットワーク内の同種のビーズについてのISFが示されている。興味深いことに、どちらの場合もISFはゼロに減衰しませんでした。大きなラグタイムでは、ISFはエルゴード系ではゼロに近づくはずです。つまり、このようなシステムでは、密度変動は大きなラグタイムにわたって完全に相関関係を解消する必要があります。ここでのISFがゼロに減衰しなかったという事実は、計算されたDDM行列からISFを見つけるために使用されたA(q)とBの不正確な推定値に起因する可能性があります。注目すべきことに、ここで用いられる方法は、特定のシナリオ62においてBを過大評価し得る。しかし、トレーサービーズのダイナミクスは、ビーズがネットワークメッシュサイズに匹敵するサイズを有し、したがってケージ状になる可能性があるため、真に非エルゴードである可能性が高い。他のデータは、非人間性の発見を裏付けた。すなわち、ビーズサイズ0.6μmは、19μM濃度で0.4μm、34μM濃度で0.3μmのメッシュサイズで計算された平均値よりも大きかった。さらに、後に示すこれらのトレーサービーズの単一粒子追跡の結果も、限られた動きを示しました。
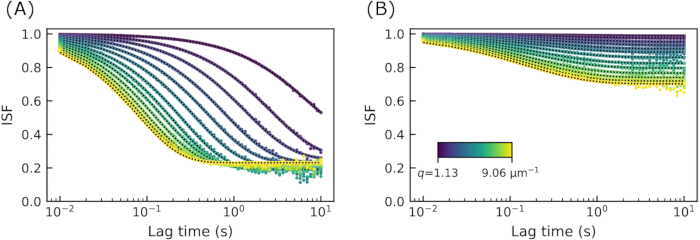
図4:ビメンチンネットワークのいくつかの波数における中間散乱関数。ISFは、約1〜9μm−1のq値のラグタイムの関数としてプロットされる。(A)ビメンチン濃度19 μMのビメンチンネットワークにおける0.6 μmビーズの画像からのISF。(B)ビメンチン濃度34 μMのビメンチンネットワークにおける0.6 μmビーズの画像からのISF。ゼロをはるかに上回る値でのISFの長いラグタイムプラトーは、非人間性を示します。この図の拡大版を表示するには、ここをクリックしてください。
ダイナミクスが非人間性である可能性が高いことを考えると、ISFは の形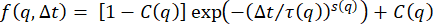 に適合します 、ここでCは非人間性因子32です。ISFのこの形態は、アクチン微小管ネットワーク10におけるコロイドゲル32、74またはトレーサー粒子のそれのような非エルゴードダイナミクスの以前の研究において使用されてきた。図4の黒い点線は、適合度とデータを示しています。これらの適合から、崩壊時間τと非人間性パラメータCのq依存性を見ることができます。
に適合します 、ここでCは非人間性因子32です。ISFのこの形態は、アクチン微小管ネットワーク10におけるコロイドゲル32、74またはトレーサー粒子のそれのような非エルゴードダイナミクスの以前の研究において使用されてきた。図4の黒い点線は、適合度とデータを示しています。これらの適合から、崩壊時間τと非人間性パラメータCのq依存性を見ることができます。
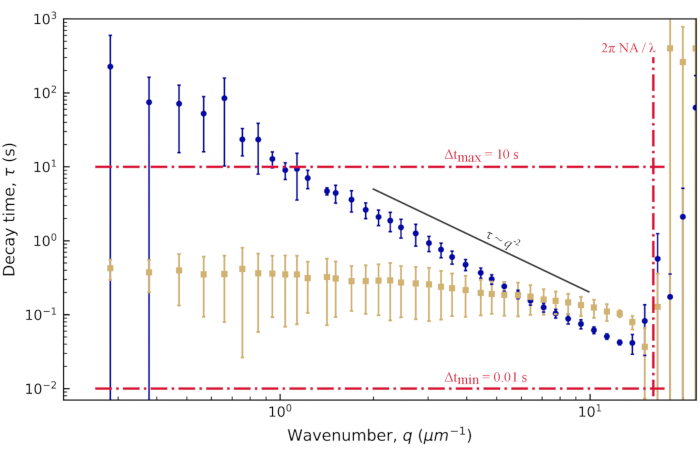
図5:ビメンチンネットワークの減衰時間と波数適合からISFまで、減衰時間τはq値の範囲について決定されます。わかりやすくするために、すべてのqのτの値を示すのではなく、対数的に間隔を空けた集合のみを示しています。青色(黄褐色)は、ビメンチン濃度が19 μM(34 μM)のビメンチンネットワーク内の0.6 μmビーズの画像からのデータです。エラーバーは、複数のムービー(19 μMネットワーク[青]のデータの場合は4つのムービー、34 μMネットワーク[tan]のデータの場合は5つのムービー)にわたるτの標準偏差を表します。赤い破線は、結果に記載されているように、時間的および空間的分解能の推定境界を示します。黒い実線は拡大縮小を示し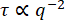 、拡散運動を示します。どちらのデータ・セットもこのスケーリングに従っていません。むしろ、19 μMネットワーク内のビーズは拡散下運動(
、拡散運動を示します。どちらのデータ・セットもこのスケーリングに従っていません。むしろ、19 μMネットワーク内のビーズは拡散下運動(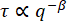 β> 2)を示し、34 μMネットワーク内のビーズは閉じ込められた動きまたはケージの動きを示します。この図の拡大版を表示するには、ここをクリックしてください。
β> 2)を示し、34 μMネットワーク内のビーズは閉じ込められた動きまたはケージの動きを示します。この図の拡大版を表示するには、ここをクリックしてください。
図5に示すように、減衰時間は、低いqと高いqの両極端の両方で、大量の不確実性を示しました。このプロットのエラーバーは、ビメンチン濃度が低いケースで分析された4つのビデオ、または高濃度で分析された5つのビデオの標準偏差を示しています。これらの極端における大きな不確実性の原因を理解するには、時間分解能と空間分解能の両方を考慮してください。解像度のおおよその限界は、3本の赤い破線で示されています。2 本の水平線は、プローブされた最小ラグ タイムと最大ラグ タイムに対応します。100 frames/s のフレームレートと 1000 フレームに対応する最大ラグタイム(ビデオ全体の 20%)を考えると、0.01 秒より速く発生するダイナミクスまたは 10 秒より遅く発生するダイナミクスを測定すると、精度が失われました。低いq値では、τの適合値は10秒より大きかった。したがって、最大ラグタイムよりも大きい減衰時間には大きな不確実性が予想されます。qレンジの上限では、減衰時間は最小ラグタイムの0.01秒に近づいたが、それを超えるままであった。時間分解能によって制限されるのではなく、これらのより高いq値では、空間分解能が制限要因となり得る。0.13 μmのピクセルサイズを考えると、qの最大値は約24 μm-1でした。しかし、回折制限分解能は、必ずしもこれらの高い空間周波数におけるダイナミクスの正確な測定を可能にするものではない。光学分解能を次のように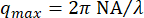 近似すると、対物レンズの開口数NAが1.4、光
近似すると、対物レンズの開口数NAが1.4、光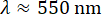 の波長が与えられると、波数の上限は約16μm-1になります。これは、図 5 の縦の赤い破線で示されています。実際、データはqの大きな値でノイズが多かった。qのこのおおよその上限の前でさえ、τの不確実性の増加が見られ、これはqmaxを過大評価することによるものであった可能性がある。予想よりも光学解像度が低いのは、油浸レンズを使用してカバースリップを越えて水性サンプルに画像化した場合や、集光レンズの位置が不完全だったことが原因である可能性があります。
の波長が与えられると、波数の上限は約16μm-1になります。これは、図 5 の縦の赤い破線で示されています。実際、データはqの大きな値でノイズが多かった。qのこのおおよその上限の前でさえ、τの不確実性の増加が見られ、これはqmaxを過大評価することによるものであった可能性がある。予想よりも光学解像度が低いのは、油浸レンズを使用してカバースリップを越えて水性サンプルに画像化した場合や、集光レンズの位置が不完全だったことが原因である可能性があります。
低濃度ネットワーク(19 μM vimentin)に埋め込まれた0.6 μmビーズについては、減衰時間対波数の対数プロットから、減衰時間がべき乗則と一致する方法で波数とともに減少したことが観察できます(図5)。しかし、通常の拡散運動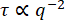 に期待されるものに従っていないようです。むしろ、τはqの増加とともにより急激に減少した。これは、このような混雑した環境でビーズに対してしばしば発生する亜拡散運動を示すものである。1.4 μm-1 ~ 12.3 μm-1 の範囲にわたって τ(q) を τ = 1/Kq の形式のべき乗則に当てはめると、 輸送パラメータ K = 0.0953 μm β/ s および β = 2.2 βが得られます。トレーサー粒子の平均二乗変位(MSD)をラグタイムの関数(すなわち、MSD = K'Δt α)の観点から通常の拡散対部分拡散について考えることに慣れている人にとっては、MSD方程式における部分拡散スケーリング指数αは、α = 2 / βと等価であることを認識することは有用である。つまり、β = 2.2 の値は、α = 0.9 の MSD 方程式のサブディフューズ スケーリング指数と一致します。この範囲の q 値に τ(q) を収めるように PyDDM を設定するには、YAML ファイルでGood_q_rangeパラメータを持つか、オプションの引数 forced_qs を関数 generate_fit_report に渡すことによって、q の配列のインデックスを指定します。1.4 μm-1 から 12.3 μm-1 までの q の範囲は、ここでのデータでは、15 から 130 までの q の配列のインデックスに対応します。
に期待されるものに従っていないようです。むしろ、τはqの増加とともにより急激に減少した。これは、このような混雑した環境でビーズに対してしばしば発生する亜拡散運動を示すものである。1.4 μm-1 ~ 12.3 μm-1 の範囲にわたって τ(q) を τ = 1/Kq の形式のべき乗則に当てはめると、 輸送パラメータ K = 0.0953 μm β/ s および β = 2.2 βが得られます。トレーサー粒子の平均二乗変位(MSD)をラグタイムの関数(すなわち、MSD = K'Δt α)の観点から通常の拡散対部分拡散について考えることに慣れている人にとっては、MSD方程式における部分拡散スケーリング指数αは、α = 2 / βと等価であることを認識することは有用である。つまり、β = 2.2 の値は、α = 0.9 の MSD 方程式のサブディフューズ スケーリング指数と一致します。この範囲の q 値に τ(q) を収めるように PyDDM を設定するには、YAML ファイルでGood_q_rangeパラメータを持つか、オプションの引数 forced_qs を関数 generate_fit_report に渡すことによって、q の配列のインデックスを指定します。1.4 μm-1 から 12.3 μm-1 までの q の範囲は、ここでのデータでは、15 から 130 までの q の配列のインデックスに対応します。
より濃縮されたネットワーク(34 μM)の0.6 μmビーズの場合、減衰時間はqにほとんど依存しませんでした。これは、メッシュサイズが小さいネットワーク内のビーズの非人間性に起因する可能性があります。このシステムで非エルゴディシティを調べるには、図6に示すように、非エルゴディシティパラメータCをqの関数としてプロットする必要があります。19 μM ビメンチンネットワーク内の 0.6 μm ビーズの場合、C ≈ 0.2 で、q (図示せず) にほとんど依存しません。しかし、34 μM ビメンチンを含むネットワーク、およびさらに高濃度の 49 μM ビメンチンを含むネットワークでは、図 6 に示すように、C の対数は q2 に比例しました。Cとqの間のこの関係は、限られた動きのために期待される。ネットワークのポケット内に閉じ込められたビーズの場合、MSDは十分なラグタイムでプラトーすると予想されます(すなわち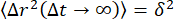 、MSDはMSD
、MSDはMSD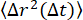 であり、δ2は最大MSDです)。ISFはMSD
であり、δ2は最大MSDです)。ISFはMSD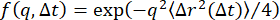 の観点から、 として表すことができ、非エルゴードISFは長いラグタイム(すなわち
の観点から、 として表すことができ、非エルゴードISFは長いラグタイム(すなわち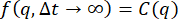 、)でCに行くので、関係
、)でCに行くので、関係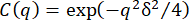 は32,75が得られる。したがって、C(q)を使用してδ2を見つけることができ、これにより、それぞれ34および49μMのビメンチンネットワークに対してδ 2 = 0.017 μm2および0.0032μm2が得られました(δ = 0.13 μmおよび0.057 μmに相当)。
は32,75が得られる。したがって、C(q)を使用してδ2を見つけることができ、これにより、それぞれ34および49μMのビメンチンネットワークに対してδ 2 = 0.017 μm2および0.0032μm2が得られました(δ = 0.13 μmおよび0.057 μmに相当)。
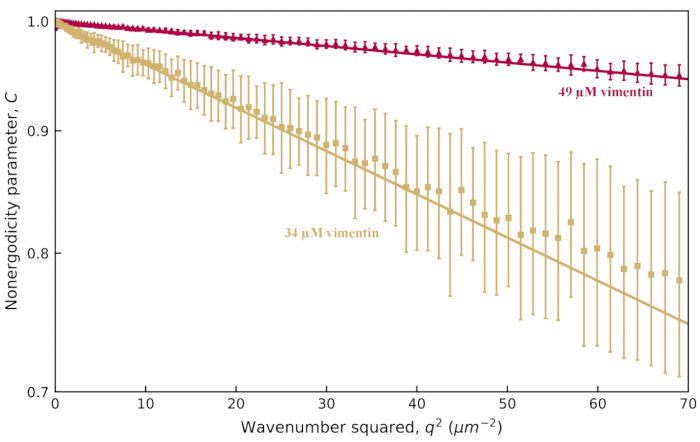
図6:非人間性パラメータ対ビメンチンネットワークの波数。適合からISFまで、非人間性パラメータCはq値の範囲について決定されます。黄褐色(赤)は、ビメンチン濃度が34 μM(49 μM)のビメンチンネットワーク内の0.6 μmビーズの画像からのデータです。エラーバーは、複数のムービー(34 μM ネットワーク[tan]のデータでは 5 つのムービー、49 μM ネットワークのデータでは 4 つのムービー [赤])にわたる標準偏差を τ で表しています。Y 軸には対数スケーリングがあります。1つは、 に続く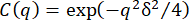 Cのq依存性を観察し、最大平均二乗変位を抽出するこδが可能になり、2である。適合先
Cのq依存性を観察し、最大平均二乗変位を抽出するこδが可能になり、2である。適合先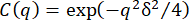 は実線で示されます。この図の拡大版を表示するには、ここをクリックしてください。
は実線で示されます。この図の拡大版を表示するには、ここをクリックしてください。
他の方法を使用して、データからδ閉じ込めサイズと、19μMビメンチンネットワーク内のビーズのτ(q)を調べることから得られた亜拡散指数を抽出することができます。第一に、Bayles et al.76およびEdera et al.77によって記述された方法を使用して、DDMマトリックスからMSDを抽出することができる。特に、この方法では DDM 行列のフィッティングは必要ありません。DDM行列D(q、Δt)、および(A(q)と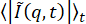 Bを決定することができる)を計算するだけで済みます。次に、MSD を見つけるには、 関係
Bを決定することができる)を計算するだけで済みます。次に、MSD を見つけるには、 関係 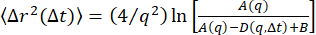 を使用します。MSD を求めるこの方法は、粒子変位の分布がガウス分布であることを前提としていますが、以前の研究では、変位が非ガウス73 の場合でも、DDM から派生した MSD が粒子追跡の MSD と一致する場合があることが示されています。このシステムの場合、予想78のように、図S1に見られるように、大きな変位の分布には非ガウス性があります。PyDDM パッケージでは、関数extract_MSD を実行する必要があり、 が返
を使用します。MSD を求めるこの方法は、粒子変位の分布がガウス分布であることを前提としていますが、以前の研究では、変位が非ガウス73 の場合でも、DDM から派生した MSD が粒子追跡の MSD と一致する場合があることが示されています。このシステムの場合、予想78のように、図S1に見られるように、大きな変位の分布には非ガウス性があります。PyDDM パッケージでは、関数extract_MSD を実行する必要があり、 が返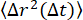 されます。第二に、単一粒子追跡を使用してMSDを見つけることができます。DDMは、粒子の高密度化や限られた光学分解能が正確な粒子局在化を阻害する画像の解析にも使用できますが、ビメンチンネットワーク内の0.6μmビーズの画像では、trackpyソフトウェア(https://github.com/soft-matter/trackpy)79を使用してビーズの局在化と追跡を行うことができました。この粒子追跡ソフトウェアパッケージは、CrockerとGrier80によって記述されたアルゴリズムを使用します。
されます。第二に、単一粒子追跡を使用してMSDを見つけることができます。DDMは、粒子の高密度化や限られた光学分解能が正確な粒子局在化を阻害する画像の解析にも使用できますが、ビメンチンネットワーク内の0.6μmビーズの画像では、trackpyソフトウェア(https://github.com/soft-matter/trackpy)79を使用してビーズの局在化と追跡を行うことができました。この粒子追跡ソフトウェアパッケージは、CrockerとGrier80によって記述されたアルゴリズムを使用します。
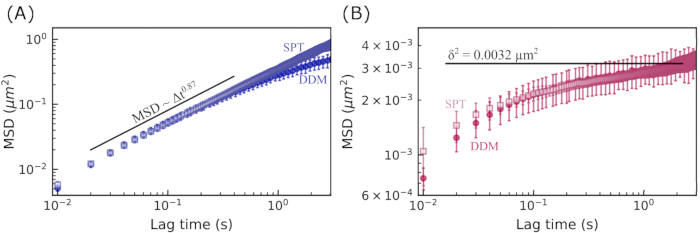
図7:ビメンチンネットワークの平均二乗変位対ラグタイム。 MSDを2つの方法を用いて測定した。まず、MSDはDDMマトリックス(実線の記号で示されている)から計算されました。次に、単一粒子追跡(SPT)を使用して粒子軌道(オープンシンボル)を見つけることによってMSDを決定した。エラー バーは、前の 2 つの図の凡例で説明したのと同じ方法で決定されます。(A) 19 μM ビメンチンネットワーク内の 0.6 μm ビーズの MSD は、拡散下運動を示し、MSD を見つける 2 つの方法の間でよく一致しています。(B) 49 μM ビメンチンネットワーク内の 0.6 μm ビーズの MSD はケージの動きを示し、MSD を見つける 2 つの方法と非人間性パラメータから見つかった最大 MSD との間でよく一致します。 この図の拡大版を表示するには、ここをクリックしてください。
19 μM ビメンチン ネットワークおよび 49 μM ビメンチン ネットワークにおける 0.6 μm ビーズの MSD 対ラグ タイムを図 7 に示します。どちらの場合も、DDMから決定されたMSDは、単一粒子追跡(SPT)によって見出されたMSDとよく一致した。さらに、集中度の低いネットワークの場合、亜拡散スケーリング指数(α in 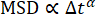 )は約0.9であった。これは、τ(q) を決定するために ISF を当ては
)は約0.9であった。これは、τ(q) を決定するために ISF を当ては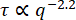 めることによって見出された τ(q) スケーリングと一致します (つまり、2/2.2 = 0.9)。より集中したネットワークの場合、MSDはより長いラグタイムでプラトーする。非人間性パラメータのq依存性(図7Bにδ 2 = 0.0032 μm2の水平線で示されている)を分析することによって得られた最大MSDは、SPTとDDMの両方のMSDが頭打ちになっているように見える値とほぼ同じ値でした。図 7A の DDM と SPT から決定された最長ラグ タイム MSD の間には矛盾があります。これは、長いラグタイム軌道の数が限られているためかもしれませんが、DDM行列が各ラグタイムの推定
めることによって見出された τ(q) スケーリングと一致します (つまり、2/2.2 = 0.9)。より集中したネットワークの場合、MSDはより長いラグタイムでプラトーする。非人間性パラメータのq依存性(図7Bにδ 2 = 0.0032 μm2の水平線で示されている)を分析することによって得られた最大MSDは、SPTとDDMの両方のMSDが頭打ちになっているように見える値とほぼ同じ値でした。図 7A の DDM と SPT から決定された最長ラグ タイム MSD の間には矛盾があります。これは、長いラグタイム軌道の数が限られているためかもしれませんが、DDM行列が各ラグタイムの推定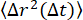 に使用されるq値の範囲をさらに最適化することで(Bayles et al.76およびEdera et al.77によって行われたように)、結果が改善される場合もあります。 そして、そのような最適化は将来の仕事の焦点になるでしょう。
に使用されるq値の範囲をさらに最適化することで(Bayles et al.76およびEdera et al.77によって行われたように)、結果が改善される場合もあります。 そして、そのような最適化は将来の仕事の焦点になるでしょう。
ビメンチン中間フィラメントのネットワークに埋め込まれたトレーサービーズの画像配列を記録したこれらの実験では、DDM(ここに記載されているパッケージを使用)とSPT(trackpyを使用)の独立した分析が可能になりました。どちらの解析でも、亜拡散と閉じ込めの長さの程度を明らかにすることができ、2つの独立した画像解析技術を使用して補完的なメトリックを提供することができます。SPT と DDM から比較できる追加の数量があります。例えば、サンプルのダイナミクスにおける不均一性は、SPTから決定される粒子変位の分布(すなわち、van Hove分布)における非ガウス性、ならびに伸張指数34,35に適合するDDMから決定されたISFにおいて、それ自体を明らかにすることができる。図S1は、ビメンチンネットワークにおける0.6μm粒子のvan Hove分布を示し、ISFのフィッティングから見出された伸張指数(バイオミメティックシステム9、10、47または他の混雑した環境内の粒子の不均一なダイナミクスを実証するために以前の研究で並行して使用されたメトリック)について論じる34.別の例として、ISFは、SPTで測定された粒子軌道から計算され、DDMで取得されたISFと比較することができる。平均二乗変位と変位分布は、SPT 解析から最も頻繁に取得されるメトリックですが、(図 S2 を参照) を使用して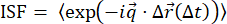 、粒子の軌跡
、粒子の軌跡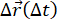 から ISF を計算することもできます。この ISF は、DDM によって生成された ISF と比較することができ、MSD59 では明らかではないダイナミクスを明らかにするために使用されます。
から ISF を計算することもできます。この ISF は、DDM によって生成された ISF と比較することができ、MSD59 では明らかではないダイナミクスを明らかにするために使用されます。
ネットワーク内のトレーサー粒子の画像を取得することで、SPTとDDMの相補的な分析方法を使用できるようになりますが、SPTに対するDDMの利点は、簡単に局在化および追跡できるビーズ(または他の特徴)の画像を必要としないことに注意することが重要です。この点を実証するために、アクチンと微小管フィラメントの活性ネットワークの分析に焦点を当て、アクチンとチューブリンの蛍光標識により、多色レーザー走査共焦点顕微鏡を使用して、異なる蛍光色素を介して互いに区別される両方のフィラメントタイプのイメージングが可能になります。
画像は、ミオシンによって駆動される活性を有するアクチン - 微小管ネットワークのレーザー走査型共焦点顕微鏡を用いて取得された(ウサギ骨格筋ミオシンII;細胞骨格#MY02)。実験の詳細及び結果は、既に図11で説明したが、ここに示した代表的な結果は、11の補足資料に用意された2つの動画(動画S1及びS4)の分析によるものである。両方の画像シーケンスは、1000フレームに対して2.78フレーム/秒で記録された。
これらの画像を解析するために、DDM行列を0.4秒から252秒(1フレームから700フレーム)の範囲の50ラグタイムで計算しました。次に、DDM 行列をモデル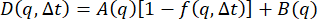 に適合させ、中間散乱関数を
に適合させ、中間散乱関数を 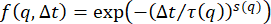 .したがって、適合パラメータには、A、τ、s、B の 4 つがあります。これらの適合の結果を図8に示します。特定のq値のDDMマトリックスは、低いラグタイムでプラトーを有し、ラグタイムとともに増加し、その後、大きなラグタイムでプラトー化した(またはプラトーに始まる兆候を示した)ことが観察された。q の下位値に対する DDM 行列は、長いラグタイムでプラトーに達しませんでした。したがって、これらの低いq(大きな長さスケール)ダイナミクスの減衰時間の測定における精度が低いことが予想されます。
.したがって、適合パラメータには、A、τ、s、B の 4 つがあります。これらの適合の結果を図8に示します。特定のq値のDDMマトリックスは、低いラグタイムでプラトーを有し、ラグタイムとともに増加し、その後、大きなラグタイムでプラトー化した(またはプラトーに始まる兆候を示した)ことが観察された。q の下位値に対する DDM 行列は、長いラグタイムでプラトーに達しませんでした。したがって、これらの低いq(大きな長さスケール)ダイナミクスの減衰時間の測定における精度が低いことが予想されます。
DDM行列への適合値からの特性減衰時間τを図9に示します。結果は、活性アクチン-微小管複合ネットワーク(映画S1 11に類似)および活性アクチンネットワーク(映画S411に類似)について提示される。両方のネットワークは、同じ濃度のアクチンおよびミオシンで調製したが、11に記載されるように、アクチンのみのネットワークがチューブリンなしで作成された。これら 2 種類のアクティブ ネットワークについて、観測されたべき乗則関係は でした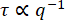 。このスケーリングは、弾道運動を示し、ミオシン駆動の収縮と流れがフィラメントの熱運動を支配することを示しています。τ = (vq)-1 から、能動アクチン-微小管ネットワークでは約 10 nm/s、能動アクチンネットワークでは 75 nm/s の特徴的な速度 v が見出された。これらの値は、11に示された同じビデオの粒子画像速度測定分析と一致する。スケーリングは
。このスケーリングは、弾道運動を示し、ミオシン駆動の収縮と流れがフィラメントの熱運動を支配することを示しています。τ = (vq)-1 から、能動アクチン-微小管ネットワークでは約 10 nm/s、能動アクチンネットワークでは 75 nm/s の特徴的な速度 v が見出された。これらの値は、11に示された同じビデオの粒子画像速度測定分析と一致する。スケーリングは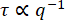 、アクティブなアクチン-微小管複合ネットワークのより低いq値では成り立たなかった。これは、低いq値におけるこのアクチン-微小管複合ネットワークの真の減衰時間が、計算されたDDM行列の最大ラグタイムよりも長いことが原因である可能性があります。最大ラグ タイムは図 9 の水平の赤い線で示されており、減衰時間はこれらの長い時間の近くで予想される
、アクティブなアクチン-微小管複合ネットワークのより低いq値では成り立たなかった。これは、低いq値におけるこのアクチン-微小管複合ネットワークの真の減衰時間が、計算されたDDM行列の最大ラグタイムよりも長いことが原因である可能性があります。最大ラグ タイムは図 9 の水平の赤い線で示されており、減衰時間はこれらの長い時間の近くで予想される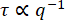 スケーリングから逸脱しています。
スケーリングから逸脱しています。
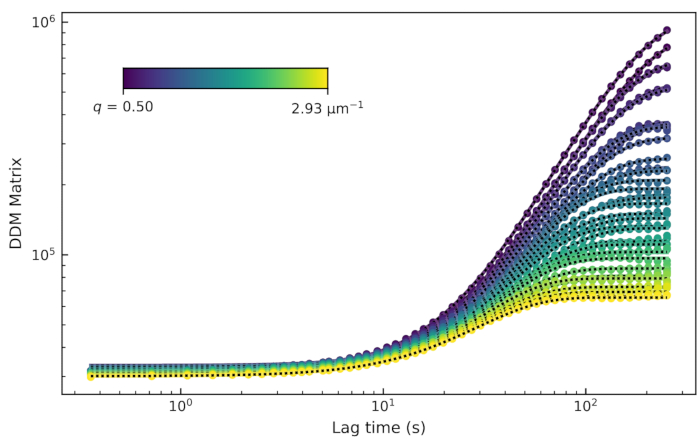
図8:アクティブなアクチン-微小管複合ネットワークのDDMマトリックス対ラグタイム。qのいくつかの値に対するDDMマトリックスは、2.9μMアクチンモノマー、2.9μMチューブリン二量体、および0.24μMミオシンからなる複合ネットワークのムービーからのラグタイムの関数としてプロットされる。これらのデータは、多色時系列画像の微小管チャネルのみの解析を示している。この図の拡大版を表示するには、ここをクリックしてください。
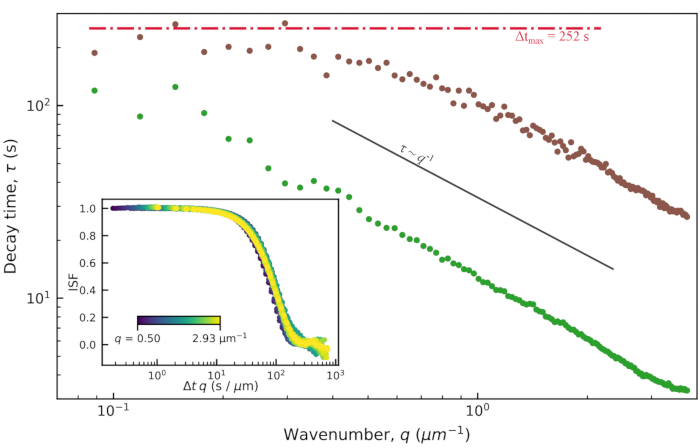
図9:アクティブなアクチン-微小管ネットワークの減衰時間と波数DDM行列を当てはめることから、波数の関数としての減衰時間τqが見出される。 プロットされたτ vs qは、アクティブなアクチン-微小管ネットワークの画像(微小管チャネルのみを解析)の画像を茶色で、アクティブなアクチンネットワークの画像については緑色でプロットされています。両方のネットワークは、アクチンおよびミオシンの同じ濃度(それぞれ2.9μMおよび0.24μM)を有する。アクチン-微小管複合体は、2.9μMのチューブリン二量体を有する。活性アクチンネットワークの減衰時間は、活性アクチン - 微小管ネットワークの減衰時間よりもはるかに小さく、これは活性アクチンネットワークのより速い運動を示す。どちらの場合も、データがトレンドに従うため、ダイナミクスは弾道的です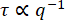 。インセット: ISFのプロットと、波数(Δt × q)でスケーリングされたラグタイムは、q値の範囲にわたるISFの崩壊を示しています。 これは弾道運動も示しています。このインセットに示されている ISF は、アクティブなアクチン ネットワークからのものです。この図の拡大版を表示するには、ここをクリックしてください。
。インセット: ISFのプロットと、波数(Δt × q)でスケーリングされたラグタイムは、q値の範囲にわたるISFの崩壊を示しています。 これは弾道運動も示しています。このインセットに示されている ISF は、アクティブなアクチン ネットワークからのものです。この図の拡大版を表示するには、ここをクリックしてください。
アクティブなネットワークのこのデータに対して、DDM マトリックス 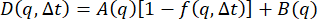 (.これは、ビメンチンネットワーク内のビーズのデータに対して行われたこととは対照的であり、そこでは、ISF、f(q、Δt)を単離するための適合なしにA(q)およびBが推定された。この場合、アクティブなネットワークデータについては、Bの推定に使用された方法では良好な適合が得られなかったため、AとBが適合パラメータとして残されました。B を推定するデフォルトの方法は、計算
(.これは、ビメンチンネットワーク内のビーズのデータに対して行われたこととは対照的であり、そこでは、ISF、f(q、Δt)を単離するための適合なしにA(q)およびBが推定された。この場合、アクティブなネットワークデータについては、Bの推定に使用された方法では良好な適合が得られなかったため、AとBが適合パラメータとして残されました。B を推定するデフォルトの方法は、計算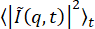 し、qが大きいとB/2になると仮定することです。しかし、この方法は、このデータについてBを過大評価しており、これは、この方法で推定されたBからISFを計算するとき(図示せず)、ISFが早期のラグタイムで1より大きかったという事実に見られる(一方、ラグタイムが増加すると、最大1からゼロまたは非人間性パラメータのいずれかに移動すべきである)。パラメータbackground_methodを使用してBを推定するための他の方法を選択できます。これらの他の方法の1つは、早期ラグタイム(background_method=1で設定)におけるDDM行列の最小値であるとBを推定することです。Bayles et al.76も同様の方法を用いたが、Bがqで一定であるとは想定していなかった。もう 1 つの選択肢は、B を最大 q (background_method=2 で設定) における DDM 行列のすべてのラグ・タイムの平均値と推定することです。背景を推定するためのこれらの異なる方法、およびBを自由フィッティングパラメータにするための結果を図10に示す。これらのプロットから、振幅Aは、大きなqでプラトーではなかったため
し、qが大きいとB/2になると仮定することです。しかし、この方法は、このデータについてBを過大評価しており、これは、この方法で推定されたBからISFを計算するとき(図示せず)、ISFが早期のラグタイムで1より大きかったという事実に見られる(一方、ラグタイムが増加すると、最大1からゼロまたは非人間性パラメータのいずれかに移動すべきである)。パラメータbackground_methodを使用してBを推定するための他の方法を選択できます。これらの他の方法の1つは、早期ラグタイム(background_method=1で設定)におけるDDM行列の最小値であるとBを推定することです。Bayles et al.76も同様の方法を用いたが、Bがqで一定であるとは想定していなかった。もう 1 つの選択肢は、B を最大 q (background_method=2 で設定) における DDM 行列のすべてのラグ・タイムの平均値と推定することです。背景を推定するためのこれらの異なる方法、およびBを自由フィッティングパラメータにするための結果を図10に示す。これらのプロットから、振幅Aは、大きなqでプラトーではなかったため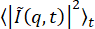 (図10B)、D(qmax、Δt)が低いラグタイムプラトーからいくつかの高いラグタイムプラトー(すなわち、qmaxでは、ゼロ以外のAがあった)に行ったため、プローブされた最大のq値でゼロに達しなかったことがわかります。図10D)。したがって、Bを推定
(図10B)、D(qmax、Δt)が低いラグタイムプラトーからいくつかの高いラグタイムプラトー(すなわち、qmaxでは、ゼロ以外のAがあった)に行ったため、プローブされた最大のq値でゼロに達しなかったことがわかります。図10D)。したがって、Bを推定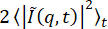 することも、そのように
することも、そのように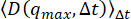 推定することも適切ではありません。Bを推定する方法(または推定する場合)を決定する前に、対qおよびD(qmax、Δt)対Δtを調べる必要があります
推定することも適切ではありません。Bを推定する方法(または推定する場合)を決定する前に、対qおよびD(qmax、Δt)対Δtを調べる必要があります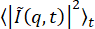 。
。
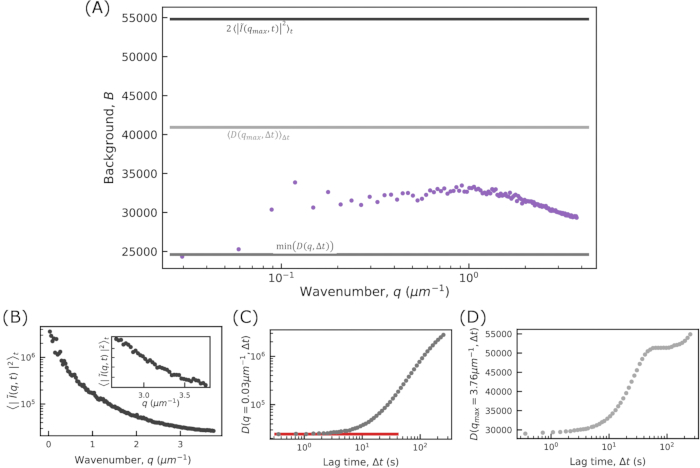
図10:アクティブなアクチン-微小管ネットワークの背景と波数DDM行列を当てはめることから、波数qの関数として背景Bを見つけることができます。これらから決定されたアクティブなアクチン - 微小管ネットワーク(微小管チャネルのみを分析する)の画像が紫色のシンボルと適合する場合のB 対qが示されている 。(A) の 3 本の実線は、フィッティングなしで見つかった背景の推定値を示しています。(A)の一番上の最も濃い線は、を用いて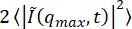 推定された背景を示しており、これは、プラトーが大きなqで一定の値にすれば
推定された背景を示しており、これは、プラトーが大きなqで一定の値にすれば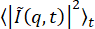 適切であり得る。(B)から、プローブされた最大のqで定数値にまだ達していないことに注意
適切であり得る。(B)から、プローブされた最大のqで定数値にまだ達していないことに注意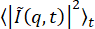 。したがって、この方法を使用すると、背景が過大評価されます。(A)の一番下の行は、を使用して
。したがって、この方法を使用すると、背景が過大評価されます。(A)の一番下の行は、を使用して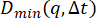 推定された背景を示しています。DDM 行列が (C) のように低ラグ タイム プラトーを赤い線で示す場合、この方法は背景の推定に適している可能性があります。(A)の中央の最も明るい線は、 から
推定された背景を示しています。DDM 行列が (C) のように低ラグ タイム プラトーを赤い線で示す場合、この方法は背景の推定に適している可能性があります。(A)の中央の最も明るい線は、 から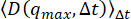 推定された背景を示しています。この方法は、qmaxで振幅Aがゼロに達した場合に適切です。(D)から、振幅がゼロではないため、この方法はバックグラウンドを過大評価していることがわかります。この図の拡大版を表示するには、ここをクリックしてください。
推定された背景を示しています。この方法は、qmaxで振幅Aがゼロに達した場合に適切です。(D)から、振幅がゼロではないため、この方法はバックグラウンドを過大評価していることがわかります。この図の拡大版を表示するには、ここをクリックしてください。
補足図S1:粒子変位の確率分布。粒子変位の確率分布は、34 μMおよび49 μMのビメンチン濃度について非ガウス性を示し、直径0.6 μmのビーズの単一粒子追跡を、異なる濃度のビメンチンネットワークで実施した。異なるラグタイムは、3つの条件の変位分布に示されています。(A)19μMのビメンチンネットワークにおける粒子変位の分布は、ガウス関数と適合する。ガウスの幅は、ラグタイムの増加とともに増加します。(B)34μMのビメンチンネットワークにおける粒子変位の分布は、特に大きな変位において、19μMの場合よりも非ガウス性を示す。(C)49μMのビメンチンネットワークにおける粒子変位の分布も非ガウス性を示す。さらに、分布の幅は、ビメンチン濃度の低いサンプルほどラグタイムとともに有意に増加せず、限られた動きを示しています。非ガウス・ヴァン・ホーブ分布(すべてのビメンチンサンプルに見られるが、高濃度で最も明白)は、混雑した閉じ込められた環境での粒子の輸送によく見られるような不均一なダイナミクスと関連している。DDM 分析から決定される異種輸送のもう 1 つの指標は、中間散乱関数を適合させるために使用されるストレッチ指数です (ここで使用される ISF の式のパラメーター s : 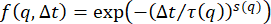 +
+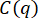 )。0.4 μm-1 ~ 9.4 μm-1 の q 範囲における平均延伸指数は、ビメンチン濃度の高いものから最も低いものまで、0.53 ± 0.07、0.64 ± 0.02、および 0.86 ± 0.04 (標準偏差±平均) です。このファイルをダウンロードするには、ここをクリックしてください。
)。0.4 μm-1 ~ 9.4 μm-1 の q 範囲における平均延伸指数は、ビメンチン濃度の高いものから最も低いものまで、0.53 ± 0.07、0.64 ± 0.02、および 0.86 ± 0.04 (標準偏差±平均) です。このファイルをダウンロードするには、ここをクリックしてください。
補足図 S2: DDM および SPT からの中間散乱機能。5つの異なる波数の中間散乱関数(ISF)を示します。DDM によって検出された ISF 対ラグ タイムは円形マーカーでプロットされ、ISF は開いた正方形の単一粒子軌道から計算されます。黒い点線は、DDM で獲得した ISF への適合を示します。ISF は、 を使用して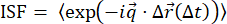 、
、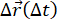 単一粒子の軌道から計算されます。(A)では、19 μM ビメンチンネットワーク内の 0.6 μm 粒子について ISF が示されています。(B)では、34 μM ビメンチンネットワーク内の 0.6 μm 粒子についてISF を示します。DDM と SPT から見つかった ISF の不一致は、ラグ タイムの長い軌道の数が限られていることが原因である可能性があります。このファイルをダウンロードするには、ここをクリックしてください。
単一粒子の軌道から計算されます。(A)では、19 μM ビメンチンネットワーク内の 0.6 μm 粒子について ISF が示されています。(B)では、34 μM ビメンチンネットワーク内の 0.6 μm 粒子についてISF を示します。DDM と SPT から見つかった ISF の不一致は、ラグ タイムの長い軌道の数が限られていることが原因である可能性があります。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル 1: DDM を使用するためのプロトコル。 プロトコルに示されているステップの入力と出力が表示されます。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:ビメンチンネットワーク用のサンプル調製およびサンプルパラメータファイルの詳細。 ビメンチンネットワーク上でのサンプル調製と画像取得のための詳細な手順が提供されます。さらに、ビメンチンネットワーク上の代表的な結果セクションに提示されるデータの分析のためのサンプルパラメータファイルも提供される。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで説明するソフトウェアパッケージでは、DDMを用いて、光学顕微鏡で取得した画像から観察される濃度変動を解析します。ビメンチンネットワークに埋め込まれたトレーサー粒子のデータからの代表的な結果が最初に示された。このようなデータの分析は、細胞骨格ネットワークの多くの過去の研究で単一粒子追跡がどのように使用されてきたかと同様に、ネットワークのメッシュサイズおよび剛性を特徴付けるために使用することができる6,12,13。単一粒子トラッキングよりも DDM を使用する利点は、DDM でパーティクルを局在化する必要がないことです。したがって、粒子密度が高すぎたり、粒子が小さすぎて局在化および追跡できない画像であっても、DDMは依然としてダイナミクスを決定することができます。単一粒子追跡が有利になるのは、粒子間の変動性を検査する場合です。DDMでは、アンサンブル平均ダイナミクスを見つけることができますが、単一粒子追跡では、単一粒子のMSDとアンサンブル平均MSDの両方を計算できます。ただし、DDM を使用して、広い視野内の複数の関心領域を分析することによって、異種ダイナミクスを調査できます。
次に、2つの異なる標識細胞骨格フィラメントタイプからなる活性ネットワークにおける蛍光標識フィラメントのデータからの代表的な結果が11に示された。このデータにより、弾道運動は、画像内に局在化可能な特徴を必要とせずに特徴付けられた。DDMは少数のユーザー入力でアンサンブル平均ダイナミクスを抽出するので、異なる条件で取得した画像系列の比較を容易にします(例えば、50で行われたように、微小管に対するアクチンの比率が異なるサンプルまたはミオシンの濃度が異なるサンプルの比較)。さらに、蛍光イメージングを使用して、多色標識を使用してネットワークのさまざまなコンポーネントのダイナミクスを調べることができます。これは11,50で行われ、アクチンと微小管のダイナミクスが、多色イメージングを使用してアクティブなアクチン-微小管複合ネットワークで別々に分析されました。ここでの代表的な結果欄では、微小管チャネルからの結果のみを示したが、前回の研究では、微小管フィラメントとアクチンフィラメント11の動態を比較した。
我々は、これらの代表的な結果が、受動的亜拡散または能動的弾道運動のいずれかを示していることに留意する。重要なことに、DDMは、中間の時間スケールまたは長さスケールでダイナミクスのタイプにクロスオーバーがあるシステムを分析するために使用できます。例として、KurzthalerらはDDMを活性ヤヌスコロイドの系とともに使用して、短い時間スケールでのアクティブな指向運動およびより長い時間スケールでの配向のランダム化を探求した59;Giavazziらは、DDMを粗大化した泡で使用し、気泡33の長さスケールに対応するダイナミクスのクロスオーバーを発見した。ChoらはDDMをコロイドゲルと共に使用し、フラクタルクラスターからネットワーク全体にまたがる異なる長さスケールの3つの区別可能なレジームを発見した32。
代表的な結果セクションに含まれるデータは、明視野顕微鏡およびレーザー走査共焦点顕微鏡で取得されました。ただし、前述のように、DDM は多くのイメージング モダリティで使用できます。どのようなイメージングモダリティでも、ユーザーは光学的断面の程度や被写界深度などの光学設定を考慮する必要があります。高度な光学的セクショニングは、焦点の合っていない物体からの信号を減らすかもしれないが、物体が被写界深度25,28から移動するためのタイムスケールよりも大きい時間スケールにわたってダイナミクスを正確に測定することはできない。q依存の被写界深度がDDM分析にどのように影響するかについてのより詳細な議論は、22で見つけることができます。明視野イメージングの場合、ユーザーはサンプルの厚さも考慮する必要があります。弱く散乱するサンプルの場合、より厚いサンプルはより多くのシグナル42を提供し得るが、濁ったサンプルは、複数の散乱81を考慮するように分析を修正することを必要とし得る。最後に、線形空間不変ではないイメージング方法(つまり、オブジェクトのカメラによって記録される強度が、そのオブジェクトがx-yサンプル平面内のどこにあるかに依存する)の場合、暗視野DDM27で実証されるように、線形空間分散を考慮する必要があるかもしれません。
DDMを使い始める人のために、私たちは空間的および時間的分解能を考慮することの重要性を強調したいと思います。決定された減衰時間を波数の関数として検査する場合、分解能の限界( すなわち、図5に示すように、最大および最小のラグタイムと最大波数)をマークすることが重要です。最適な対物レンズ、画像サイズ、フレームレート、およびムービーの長さを選択できるように、データを収集する前に、これらの制限について慎重に検討する必要があります。もう 1 つの重要な考慮事項は、バックグラウンド パラメーター B を推定する方法 です。バックグラウンドを推定するための複数の方法が文献で使用されており、 B を過大評価または過小評価することの効果は、先行出版物62、77に記載されている。 図 10 に示すように、PyDDM を使用すると、 B を推定するためのさまざまな方法を実装できるため、新しいユーザーはこれらの方法を試して、どれを使用するのが適切かを評価することをお勧めします。
このパッケージの強みは、サンプルデータ、解析の実行方法を追跡するためのメタデータの保存と編成、DDMマトリックスの解析方法の柔軟性(さまざまなフィッティングモデル、バックグラウンドパラメータBを推定するための複数の方法、MSDを見つける機能)を特徴とする徹底的なドキュメントとチュートリアルです。ただし、このコードには改善可能な複数の側面があります。現在、コードは高速な計算速度のために最適化されていません。計算を高速化するメソッドは61,62 件報告されており、これらは将来のリリースで実装される予定です。さらに、不確実性をより適切に推定し、ユーザーを適切なISFモデル62に導くためのシミュレーションを採用するために、最近報告された方法を実装する予定です。その他の改善点については、ユーザーがご提案をご連絡いただければ幸いです。
開示事項
著者らには開示するものは何もありません。
謝辞
この研究の一部は、国立衛生研究所R15賞(国立一般医科学研究所賞No.R15GM123420、R.M.R.-A.に授与R.J.M.)、科学振興研究公社からのコットレル奨学生賞(賞番号27459、R.J.M.に授与)、ウィリアムM.ケック財団研究助成金(R.M.R-A.に授与)。GHKは、オランダ研究評議会(NWO、NWOタレントプログラムのプロジェクト番号VI.C.182.004)からの財政的支援に感謝の意を表します。
資料
| Name | Company | Catalog Number | Comments |
| CMOS camera, Orca-Flash 4.0 | Hamatsu | ||
| F-127 Pluronic | Sigma Aldrich | ||
| Jupyter Notebook | |||
| Nanodrop | Thermo Fisher | ||
| Nikon Ti-Eclipse microscope | Nikon | ||
| PLL-PEG-bio | SuSos AG, Dübendorf, Switzerland | ||
| Polystyrene beads | Sigma Aldrich | ||
| Protein dialysis mini-cassette | Thermo Fisher | ||
| PyDDM | University of San Diego | N/A | Open source software available from https://github.com/rmcgorty/PyDDM |
参考文献
- Burla, F., Mulla, Y., Vos, B. E., Aufderhorst-Roberts, A., Koenderink, G. H. From mechanical resilience to active material properties in biopolymer networks. Nature Reviews Physics. 1 (4), 249-263 (2019).
- Amblard, F., Maggs, A. C., Yurke, B., Pargellis, A. N., Leibler, S. Subdiffusion and anomalous local viscoelasticity in actin networks. Physical Review Letters. 77 (21), 4470-4473 (1996).
- Mizuno, D., Tardin, C., Schmidt, C. F., MacKintosh, F. C. Nonequilibrium mechanics of active cytoskeletal networks. Science. 315 (5810), 370-373 (2007).
- Bendix, P. M. et al. A quantitative analysis of contractility in active cytoskeletal protein networks. Biophysical Journal. 94 (8), 3126-3136 (2008).
- Pelletier, V., Gal, N., Fournier, P., Kilfoil, M. L. Microrheology of microtubule solutions and actin-microtubule composite networks. Physical Review Letters. 102 (18), 188303 (2009).
- Stuhrmann, B., Soares e Silva, M., Depken, M., MacKintosh, F. C., Koenderink, G. H. Nonequilibrium fluctuations of a remodeling in vitro cytoskeleton. Physical Review E. 86 (2), 020901 (2012).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (9), 591-597 (2013).
- Anderson, S. J. et al. Filament rigidity vies with mesh size in determining anomalous diffusion in cytoskeleton. Biomacromolecules. 20 (12),4380-4388 (2019).
- Anderson, S. J., Garamella, J., Adalbert, S., McGorty, R. J., Robertson-Anderson, R. M. Subtle changes in crosslinking drive diverse anomalous transport characteristics in actin-microtubule networks. Soft Matter. 17 (16), 4375-4385 (2021).
- Lee, G. et al. Myosin-driven actin-microtubule networks exhibit self-organized contractile dynamics. Science Advances. 7 (6), eabe4334 (2021).
- Wong, I. Y. et al. Anomalous diffusion probes microstructure dynamics of entangled F-actin networks. Physical Review Letters. 92 (17), 178101 (2004).
- Köster, S., Lin, Y.-C., Herrmann, H., Weitz, D. A. Nanomechanics of vimentin intermediate filament networks. Soft Matter. 6 (9), 1910-1914 (2010).
- Chandrakar, P. et al. Engineering stability, longevity, and miscibility of microtubule-based active fluids. Soft Matter. 18 (9), 1852-1835 (2022).
- Alvarado, J., Cipelletti, L., H. Koenderink, G. Uncovering the dynamic precursors to motor-driven contraction of active gels. Soft Matter. 15 (42), 8552-8565 (2019).
- Linsmeier, I. et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7 (1), 12615 (2016).
- Stam, S. et al. Filament rigidity and connectivity tune the deformation modes of active biopolymer networks. Proceedings of the National Academy of Sciences. 114 (47), E10037-E10045 (2017).
- Malik-Garbi, M. et al. Scaling behaviour in steady-state contracting actomyosin networks. Nature Physics. 15 (5), 509-516 (2019).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences. 119 (5), e2115895119 (2022).
- Roostalu, J., Rickman, J., Thomas, C., Nédélec, F., Surrey, T. Determinants of polar versus nematic organization in networks of dynamic microtubules and mitotic motors. Cell. 175 (3), 796-808.e714 (2018).
- Cerbino, R., Trappe, V. Differential dynamic microscopy: probing wave vector dependent dynamics with a microscope. Physical Review Letters. 100 (18), 188102 (2008).
- Giavazzi, F., Brogioli, D., Trappe, V., Bellini, T., Cerbino, R. Scattering information obtained by optical microscopy: differential dynamic microscopy and beyond. Physical Review E. 80 (3), 031403 (2009).
- Giavazzi, F., Cerbino, R. Digital Fourier microscopy for soft matter dynamics. Journal of Optics. 16 (8), 083001 (2014).
- He, K., Spannuth, M., Conrad, J. C., Krishnamoorti, R. Diffusive dynamics of nanoparticles in aqueous dispersions. Soft Matter. 8 (47), 11933-11938 (2012).
- Lu, P. J. et al. Characterizing concentrated, multiply scattering, and actively driven fluorescent systems with confocal differential dynamic microscopy. Physical Review Letters. 108 (21), 218103 (2012).
- Giavazzi, F. et al. Viscoelasticity of nematic liquid crystals at a glance. Soft Matter. 10 (22), 3938-3949 (2014).
- Bayles, A. V., Squires, T. M., Helgeson, M. E. Dark-field differential dynamic microscopy. Soft Matter. 12 (8), 2440-2452 (2016).
- Wulstein, D. M., Regan, K. E., Robertson-Anderson, R. M., McGorty, R. Light-sheet microscopy with digital Fourier analysis measures transport properties over large field-of-view. Optics Express. 24 (18), 20881-20894 (2016).
- Richards, J. A., Martinez, V. A., Arlt, J. Particle sizing for flowing colloidal suspensions using flow-differential dynamic microscopy. Soft Matter. 17 (14), 3945-3953 (2021).
- Ferri, F. et al. Kinetics of colloidal fractal aggregation by differential dynamic microscopy. The European Physical Journal Special Topics. 199 (1), 139-148 (2011).
- Lanfranco, R. et al. Adaptable DNA interactions regulate surface triggered self assembly. Nanoscale. 12 (36), 18616-18620 (2020).
- Cho, J. H., Cerbino, R., Bischofberger, I. Emergence of multiscale dynamics in colloidal gels. Physical Review Letters. 124 (8), 088005 (2020).
- Giavazzi, F., Trappe, V., Cerbino, R. Multiple dynamic regimes in a coarsening foam. Journal of Physics: Condensed Matter. 33 (2), 024002 (2020).
- He, K. et al. Diffusive dynamics of nanoparticles in arrays of nanoposts. ACS Nano. 7 (6), 5122-5130 (2013).
- Jacob, J. D. C., He, K., Retterer, S. T., Krishnamoorti, R., Conrad, J. C. Diffusive dynamics of nanoparticles in ultra-confined media. Soft Matter. 11 (38), 7515-7524 (2015).
- Sentjabrskaja, T. et al. Anomalous dynamics of intruders in a crowded environment of mobile obstacles. Nature Communications. 7, 11133 (2016).
- Hitimana, E., Roopnarine, B. K., Morozova, S. Diffusive dynamics of charged nanoparticles in convex lens-induced confinement. Soft Matter. 18 (4), 832-840 (2022).
- Wilson, L. G. et al. Differential dynamic microscopy of bacterial motility. Physical Review Letters. 106 (1), 018101 (2011).
- Martinez, V. A. et al. Differential dynamic microscopy: a high-throughput method for characterizing the motility of microorganisms. Biophysical Journal. 103 (8), 1637-1647 (2012).
- Germain, D., Leocmach, M., Gibaud, T. Differential dynamic microscopy to characterize Brownian motion and bacteria motility. American Journal of Physics. 84 (3), 202-210 (2016).
- Croze, O. A. et al. Helical and oscillatory microswimmer motility statistics from differential dynamic microscopy. New Journal of Physics. 21 (6), 063012 (2019).
- Safari, M. S., Vorontsova, M. A., Poling-Skutvik, R., Vekilov, P. G., Conrad, J. C. Differential dynamic microscopy of weakly scattering and polydisperse protein-rich clusters. Physical Review E. 92 (4), 042712 (2015).
- Wang, J., McGorty, R. Measuring capillary wave dynamics using differential dynamic microscopy. Soft Matter. 15 (37), 7412-7419 (2019).
- Cerbino, R., Giavazzi, F., Helgeson, M. E. Differential dynamic microscopy for the characterization of polymer systems. Journal of Polymer Science. 60 (7), 1079-1089 (2021).
- Cerbino, R., Cicuta, P. Perspective: differential dynamic microscopy extracts multi-scale activity in complex fluids and biological systems. The Journal of Chemical Physics. 147 (11), 110901 (2017).
- Drechsler, M., Giavazzi, F., Cerbino, R., Palacios, I. M. Active diffusion and advection in Drosophila oocytes result from the interplay of actin and microtubules. Nature Communications. 8 (1), 1-11 (2017).
- Burla, F., Sentjabrskaja, T., Pletikapic, G., Beugen, J. v., H. Koenderink, G. Particle diffusion in extracellular hydrogels. Soft Matter. 16 (5), 1366-1376 (2020).
- Regan, K., Wulstein, D., Rasmussen, H., McGorty, R., Robertson-Anderson, R. M. Bridging the spatiotemporal scales of macromolecular transport in crowded biomimetic systems. Soft Matter. 15 (6), 1200-1209 (2019).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), eaay5912 (2019).
- Lee, G. et al. Active cytoskeletal composites display emergent tunable contractility and restructuring. Soft Matter. 17 (47), 10765-10776 (2021).
- Achiriloaie, D. H. et al. Kinesin and myosin motors compete to drive rich multi-phase dynamics in programmable cytoskeletal composites. arXiv:2112.11260 .(2021).
- Chen, X. et al. Coaxial differential dynamic microscopy for measurement of Brownian motion in weak optical field. Optics Express. 26 (24), 32083-32090 (2018).
- Reufer, M., Martinez, V. A., Schurtenberger, P., Poon, W. C. K. Differential dynamic microscopy for anisotropic colloidal dynamics. Langmuir. 28 (10), 4618-4624 (2012).
- Giavazzi, F., Haro-Pérez, C., Cerbino, R. Simultaneous characterization of rotational and translational diffusion of optically anisotropic particles by optical microscopy. Journal of Physics: Condensed Matter. 28 (19), 195201 (2016).
- Cerbino, R., Piotti, D., Buscaglia, M., Giavazzi, F. Dark field differential dynamic microscopy enables accurate characterization of the roto-translational dynamics of bacteria and colloidal clusters. Journal of Physics: Condensed Matter. 30 (2), 025901 (2017).
- Safari, M. S., Poling-Skutvik, R., Vekilov, P. G., Conrad, J. C. Differential dynamic microscopy of bidisperse colloidal suspensions. npj Microgravity. 3 (1), 21 (2017).
- Giavazzi, F., Pal, A., Cerbino, R. Probing roto-translational diffusion of small anisotropic colloidal particles with a bright-field microscope. The European Physical Journal E. 44 (4), 61 (2021).
- Schwarz-Linek, J. et al. Escherichia coli as a model active colloid: a practical introduction. Colloids and Surfaces B: Biointerfaces. 137, 2-16 (2016).
- Kurzthaler, C. et al. Probing the spatiotemporal dynamics of catalytic Janus particles with single-particle tracking and differential dynamic microscopy. Physical Review Letters. 121 (7), 078001 (2018).
- Mandal, S., Kurzthaler, C., Franosch, T., Löwen, H. Crowding-enhanced diffusion: an exact theory for highly entangled self-propelled stiff filaments. Physical Review Letters. 125 (13), 138002 (2020).
- Norouzisadeh, M., Chraga, M., Cerchiari, G., Croccolo, F. The modern structurator: increased performance for calculating the structure function. The European Physical Journal E. 44 (12), 146 (2021).
- Gu, M., Luo, Y., He, Y., Helgeson, M. E., Valentine, M. T. Uncertainty quantification and estimation in differential dynamic microscopy. Physical Review E. 104 (3), 034610 (2021).
- Hoyer, S., Hamman, J. xarray: N-D labeled arrays and datasets in Python. Journal of Open Research Software. 5 (1), 10 (2017).
- Aufderhorst-Roberts, A., Koenderink, G. H. Stiffening and inelastic fluidization in vimentin intermediate filament networks. Soft Matter. 15 (36), 7127-7136 (2019).
- Guo, M. et al. The role of vimentin intermediate filaments in cortical and cytoplasmic mechanics. Biophysical Journal. 105 (7), 1562-1568 (2013).
- Lavenus, S. B., Tudor, S. M., Ullo, M. F., Vosatka, K. W., Logue, J. S. A flexible network of vimentin intermediate filaments promotes migration of amoeboid cancer cells through confined environments. Journal of Biological Chemistry. 295 (19), 6700-6709 (2020).
- Patteson, A. E. et al. Loss of vimentin enhances cell motility through small confining spaces. Small. 15 (50), 1903180 (2019).
- Lin, Y.-C. et al. Origins of elasticity in intermediate filament networks. Physical Review Letters. 104 (5), 058101 (2010).
- Pawelzyk, P., Mücke, N., Herrmann, H., Willenbacher, N. Attractive interactions among intermediate filaments determine network mechanics in vitro. PLOS ONE. 9 (4), e93194 (2014).
- Schepers, A. V. et al. Multiscale mechanics and temporal evolution of vimentin intermediate filament networks. Proceedings of the National Academy of Sciences. 118 (27), e2102026118 (2021).
- Wu, H. et al. Effect of divalent cations on the structure and mechanics of vimentin intermediate filaments. Biophysical Journal. 119 (1), 55-64 (2020).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews Molecular Cell Biology. 20 (1), 38-54 (2019).
- Giavazzi, F., Malinverno, C., Scita, G., Cerbino, R. Tracking-free determination of single-cell displacements and division rates in confluent monolayers. Frontiers in Physics. 6, 120 (2018).
- Cho, J. H. Multiscale Probing of Colloidal Gelation Dynamics., Massachusetts Institute of Technology (2018).
- Krall, A. H., Weitz, D. A. Internal dynamics and elasticity of fractal colloidal gels. Physical Review Letters. 80 (4), 778-781 (1998).
- Bayles, A. V., Squires, T. M., Helgeson, M. E. Probe microrheology without particle tracking by differential dynamic microscopy. Rheologica Acta. 56 (11), 863-869 (2017).
- Edera, P., Bergamini, D., Trappe, V., Giavazzi, F., Cerbino, R. Differential dynamic microscopy microrheology of soft materials: a tracking-free determination of the frequency-dependent loss and storage moduli. Physical Review Materials. 1 (7), 073804 (2017).
- Wang, B., Kuo, J., Bae, S. C., Granick, S. When Brownian diffusion is not Gaussian. Nature Materials. 11 (6), 481-485 (2012).
- soft-matter/trackpy: Trackpy v0.5.0. Zenodo (2021).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- Nixon-Luke, R., Arlt, J., Poon, W. C. K., Bryant, G., Martinez, V. A. Probing the dynamics of turbid colloidal suspensions using differential dynamic microscopy. Soft Matter. 18 (9), 1856-1867 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved