Method Article
高分解能肺活量測定法を用いた初代ヒト網膜色素上皮細胞における生体エネルギーのリアルタイム解析
要約
ヒト網膜色素上皮細胞(H-RPE)の代謝状態は、その健康と機能を反映しています。ここでは、高解像度の呼吸測定を使用してH-RPEのリアルタイムの代謝フラックスを調べるための最適化されたプロトコルを紹介します。
要約
網膜色素上皮細胞(RPE)の代謝機能障害は、加齢黄斑変性症(AMD)や増殖性硝子体網膜症(PVR)などの網膜疾患の主要な病原性ドライバーです。RPEは代謝活性の高い細胞であるため、代謝状態の変化は健康と機能の変化を反映しています。高分解能呼吸法は、細胞外酸性化率(ECAR)と酸素消費速度(OCR)をそれぞれ定量化することにより、解糖系とミトコンドリア酸化的リン酸化(OXPHOS)の2つの主要な生体エネルギー経路のリアルタイム速度論的分析を可能にします。以下は、初代ヒト網膜色素上皮細胞(H-RPE)で高解像度呼吸測定を実施するための最適化されたプロトコルです。このプロトコルは、RPEの基礎および最大のOXPHOSおよび解糖能力を定義するために、RPEの生体エネルギープロファイルの生成に関連するステップの詳細な説明を提供します。H-RPEをミトコンドリアおよび解糖系機械を標的とするさまざまな薬物注射に曝露すると、定義された生体エネルギープロファイルが得られ、そこから主要な代謝パラメータを計算できます。このプロトコルは、シアン化カルボニルp-トリフルオロメトキシフェニルヒドラゾン(FCCP)と比較して、RPEの最大呼吸能力を誘導するための脱共役剤としてのBAM15の応答の向上を強調しています。このプロトコルは、さまざまな疾患条件下でのRPEの生体エネルギー状態を研究し、RPEの基礎代謝状態の回復における新薬の有効性をテストするために利用できます。
概要
網膜色素上皮細胞(RPE)は、脈絡毛細血管の光受容体と開窓内皮の間に戦略的に位置する色素性上皮細胞の単層として存在します。RPEは代謝活性が高く、(1)脱落した光体椎間板の貪食、(2)視覚サイクルを維持するための視覚色素のリサイクル、(3)栄養素、代謝物、イオン、水の輸送、(4)光の吸収、(5)光酸化に対する保護、(6)網膜の完全性をサポートする必須因子の分泌、(7)外側の血液網膜関門の形成など、多くの機能を持っています1。.RPEの変性は、代謝機能障害やミトコンドリア欠損を伴い、加齢黄斑変性症(AMD)や増殖性硝子体網膜症(PVR)2などの失明性眼疾患を引き起こします。
2つの重要な生体エネルギー経路には、細胞質で起こる解糖系と、ミトコンドリアで起こる酸化的リン酸化(OXPHOS)が含まれます。解糖中に、1分子のグルコースが2分子のピルビン酸に変換され、2分子のアデノシン三リン酸(ATP)が正味産生される。解糖とは対照的に、OXPHOSははるかに高いレベルのATP(グルコース分子あたり~32-38分子のATP)を生成します。特に、OXPHOSは酸素を消費し、機能的なミトコンドリアが起こる必要がありますが、解糖は細胞質で起こり、酸素を必要としません。
ミトコンドリア呼吸を調べるための蛍光またはリン光ベースの技術の導入に先立ち、クラーク型酸素電極3を備えたチャンバー内の透過処理細胞懸濁液中の酸素レベルを測定しました。クラーク電極は蛍光ベースの呼吸測定よりもはるかに安価であり、非接着細胞で機能しますが、スループットは比較的低く、各呼吸ランは約15〜20分続き、各サンプル3にはるかに大量の細胞を必要とします。したがって、蛍光ベースの呼吸測定技術は、クラーク電極に大きく取って代わり、代謝およびミトコンドリア研究の分野で人気のある技術になりました。
このプロトコルは、生細胞のOXPHOSおよび解糖系生体エネルギープロファイルを速度論的に測定する、ハイスループット、高分解能、蛍光ベースの呼吸測定技術について説明しています。OXPHOSのプロセスは酸素を消費するため、OXPHOSの生体エネルギープロファイルは、時間の経過に伴う酸素消費率(OCR)の変化をマッピングすることによって生成されます4。この技術では、2つの蛍光色素をセンサーカートリッジスリーブに埋め込み、光を発する光ファイバーバンドルに接続して蛍光色素を励起します。蛍光色素の発光の変化は、高感度の蛍光センサーによって測定され、光ファイバーバンドルを介して送信され、OCR読み出しに変換されます5。蛍光色素は酸素によってクエンチされるため、酸素フラックスまたはOCRとして知られるアッセイ培地中の細胞外酸素レベルの測定が可能になります。もう一方の蛍光色素は、プロトン流出の変化に敏感なpHセンサープローブであり、細胞外酸性化速度(ECAR)の測定値に変換されます。測定中、蛍光色素が埋め込まれた光ファイバーバンドルは、細胞単層から200 μm上まで下げられ、迅速なリアルタイム読み取りを可能にする過渡マイクロチャンバーが作成されます。酸素またはプロトンレベルの10%の変化が検出されると、センサーは上向きに持ち上げられ、大量の媒体が過渡マイクロチャンバー媒体と混合され、OCRおよびECAR値がベースラインに戻ります。各センサーカートリッジには4つのポートが装備されており、アッセイ中にウェルあたり最大4つの化合物を順次投与できます。各ポートへの化合物の注入の前後に測定値を収集することができ、細胞の代謝状態に関する重要な情報を明らかにすることができます。
これらの2つの異なる代謝経路を調べることで、さまざまな病原性刺激への曝露後のRPEの代謝状態に関する重要な発見が得られるため、RPE 6,7,8の代謝完全性を回復する薬物の有効性をテストするために使用できます。ハイスループット呼吸測定の出現と特定のミトコンドリア阻害剤の利用可能性により、RPEの生体エネルギープロファイルを定義し、病状中の代謝とミトコンドリアの欠陥を特定するためのより多くの研究が刺激されました6、7、8、9、10、11、12、13.高分解能呼吸法は、AMDやPVRなどの網膜病理におけるRPEの代謝リプログラミングの重要な役割を強調しています。AMDおよびPVRの病因に関与する2つの重要なサイトカインは、形質転換成長因子ベータ2(TGFβ2)および腫瘍壊死因子アルファ(TNFα)である。TGFβ2による上皮間葉転換(EMT)の誘導は、ミトコンドリア機能障害、OXPHOS抑制、およびRPE6の解糖能力の代償的増加を伴う。最近では、炎症誘発性サイトカインであるTNFαが、H-RPE7において基底OXPHOSの有意なアップレギュレーションと解糖系の低下を誘導することが示されています。フマル酸ジメチルの投与は、H-RPEにおけるTNFα誘発炎症を有意に抑制し、ミトコンドリアの形態と基礎生体エネルギープロファイルを回復させました7。これら2つの成長因子によって誘発される異なる代謝プロファイルは、網膜疾患における代謝リプログラミングの関与に関する興味深い機構論的質問を刺激します。次のプロトコルは、高解像度の呼吸測定を使用してH-RPEのOXPHOSおよび解糖系生体エネルギープロファイルを評価するための手順を説明しています。
プロトコル
1. 細胞培養プレートへのH-RPEのめっき
- RPE増殖培地サプリメント(4 mM L-グルタミン、25 ng/mL FGF-2、2% FBS、30 mg/mLゲンタマイシン、および15 μg/mLアムホテリシン)を添加したヒトRPE培地のT25フラスコでH-RPEを解凍します。
- 加湿インキュベーター内で細胞を37°Cおよび5%CO2 でインキュベートする。翌日培地をリフレッシュし、細胞が少なくとも80%のコンフルエントに達するのを待ってから、T75フラスコに1:3の比率で継代します。
- コンフルエントになったら、トリプシン/EDTA 0.025%溶液、トリプシン中和溶液、およびHEPES緩衝生理食塩水(pH 7.0-7.6)からなる継代試薬キットを使用して細胞を継代します。
- H-RPEを3 mLのHEPES緩衝生理食塩水でやさしくすすいでください。次に、3 mLのトリプシン/ EDTAを加え、5分間(または顕微鏡で観察するように、細胞がフラスコのベースから浮き上がるまで)インキュベートします(37°Cおよび5%CO2)。3 mLのトリプシン中和溶液でトリプシン/EDTAを中和します。
- 細胞を200 x g で3.5分間遠心分離し、細胞ペレットを形成します。上清を注意深く吸引して廃棄します。
- 細胞をヒトRPE培地に再懸濁し、ウェルあたり100 μLあたり20,000細胞の最終濃度にします。
- 細胞懸濁液が均一であることを確認するために複数回ピペットアップおよびダウンし、マルチチャンネルピペットを使用して、96ウェル細胞培養マイクロプレートへのピペッティングの容易さと一貫性を実現します。ピペットチップをウェル上部の円形リムのすぐ下に置いて、均一で均質な細胞層を作ります。
注:細胞はマイクロプレートによく接着するため、コーティングは必要ありません。 - バックグラウンド補正ウェルとして機能するために、4つのコーナーウェルに細胞(100 μLの培地のみ)を空のままにしてください(図1A)。
注:マイクロプレートは、典型的な96ウェルプレート設計でフォーマットされています。ただし、各ウェルの表面積は0.106 cm2であり、標準の96ウェルプレートよりも40%小さくなっています。この細胞密度では、細胞は翌日100%コンフルエントになるはずです。治療をテストする前に、まず細胞密度最適化実験を実行して、基礎OCRとECARの読み取り値がそれぞれ約50〜100 pmol/分と10〜20 mpH/分であることを確認することをお勧めします。
- 細胞懸濁液が均一であることを確認するために複数回ピペットアップおよびダウンし、マルチチャンネルピペットを使用して、96ウェル細胞培養マイクロプレートへのピペッティングの容易さと一貫性を実現します。ピペットチップをウェル上部の円形リムのすぐ下に置いて、均一で均質な細胞層を作ります。
- 細胞培養プレートを室温(RT)で1時間放置してから、インキュベーター(5%CO2、37°C、加湿)に戻して、エッジの影響を最小限に抑えます。エッジ効果は、蒸発による96ウェルプレートの周辺境界のウェル内の培地体積の変化である14。
注:細胞は一晩接着し、翌日コンフルエントな単層を形成します。H-RPEは、2〜3日ごとに増殖培地の半分をリフレッシュすることにより、プレート内で少なくとも1ヶ月間成熟させる。 - 培地を交換する前に顕微鏡で細胞を調べて、細胞の形態と色素沈着レベルを確認します。細胞が特徴的な石畳のような形態とコンフルエントであり、Shuらの形態画像に見られるように、時間の経過とともに色素沈着を獲得することを確認します7。
2. アッセイ実施前日
- アッセイの前日に、ユーティリティプレートの各ウェルに200 μLの脱イオン水を満たして、センサーカートリッジが水和されていることを確認します。
注:ユーティリティプレートの蓋には、各ウェルの酸素およびpHレベルを測定するための蛍光バイオセンサーが含まれています。センサーは、さまざまな励起波長で光を照射し、光学フィルターを介して蛍光信号を光検出器に送信する光ファイバー導波路に結合されています。 - 水に浸したセンサーカートリッジを、~20 mLのキャリブラント(翌日使用するためにウォームアップするため)とともに、37°Cの加湿オーブン(CO2なし)に一晩入れます。
注意: キャリブラントは、センサーカートリッジのキャリブレーション用に設計された独自のソリューションであり、リン酸塩緩衝生理食塩水(PBS)と組成が似ている可能性があります。カートリッジの水分補給の最小時間は4時間ですが、一晩の水分補給で最良の結果が得られます。 - 機器の電源がオンになっていることを確認し、ソフトウェアを起動して、機器が一晩37°Cに安定するようにします(図2)。一般的に、機器は使用しないときでもオンのままにしておくことができます。
3. 細胞外フラックス分析装置を用いたリアルタイム水戸ストレステスト
- アッセイ当日、アッセイを実行する少なくとも45分前に、ユーティリティプレート内の水を等量の温めたキャリブラントと交換します。
- 表1に示すようにサプリメントを添加してフェノールレッドを含まないベース培地を用いて水戸ストレステストアッセイ培地を作製した。メディアを37°Cに温め、pHを7.4に調整し、チューブトップフィルターユニットを使用してメディアを真空ろ過します。フルプレートを実行するには、~25 mLのアッセイ培地を作ります。
- ヒトRPE培地を取り出し、新たに調製したアッセイ培地180 μLと交換します(ステップ3.2)。アッセイを開始する前に、細胞培養プレートを加湿した37°Cのオーブン(CO2なし)に1時間入れます。
注:これは、セルプレートを脱ガスするために重要であり、CO2 拡散を可能にします。細胞はもはやそれらの増殖培地中になく、もはやCO2を含むインキュベーター中に存在しないので、それらの生存率は時間とともに低下するので、アッセイをできるだけ効率的に実施するように注意すべきである。また、細胞培養プレートに気泡がないように注意する必要があります。ある場合は、ピペットまたは針でポップします。 - 各センサーカートリッジには、アッセイ中に細胞培養プレートのウェルに試験化合物を注入するためのウェルごとに4つの試薬送達ポートがあります(図1C、D)。 表2に従って、それぞれのアッセイ培地で薬剤ストックを希釈することにより、~3mLの10x薬物溶液を調製します。例えば、Mito Stress Testアッセイ培地に溶解した25 μMのオリゴマイシンをポートAにロードし、薬剤量が機器によってウェルに注入されたときに、各細胞がさらされる最終濃度が2.5 μMになるようにします。 10倍の医薬品原料20 μLをポートAにピペット、 ポートBに22 μL、 ポートCに25 μLを挿入し、各ウェルで指定された最終薬物濃度を達成します。4つの薬剤ポートすべてを必要とするプロトコルの場合は、28 μLをポートDにピペットで入れます。
注:ポートA/B/C/Dの正しい向きについては、薬物を薬剤ポートにピペッティングする場合は 、図1B を参照してください。カートリッジの端にあるノッチは、ドラッグポートをロードするときに左下隅に配置する必要があります。各薬剤ポートに斜めにピペッティングすることで、気泡を最小限に抑えることができます。気泡がある場合は、ピペットまたは針でそれらをポップするように注意する必要があります。 - 分析ソフトの 「テンプレート 」タブを開き、「 水戸ストレステスト」を選択して、 グループ定義を入力します。
- 注射戦略の詳細を入力します(この場合、水戸ストレステスト薬として事前に入力されています)。アッセイ内のさまざまな実験グループに関する詳細を入力します(例:コントロールまたは治療)。アッセイ培地に詳細を入力し(ベースアッセイ培地へのさまざまなサプリメントとその特定の濃度の追加)、最後に細胞タイプを追加します。
- 次のタブ「プレートマップ」をクリックすると、検査対象のさまざまなグループが96ウェルプレートマップ上の特定の場所に割り当てられます。これが完了したら、[プロトコル]タブをクリックして、デフォルトのMitoストレステストプロトコルの機器プロトコルを確認します。
注:デフォルトの Mitoストレステスト テンプレートはすぐに使用できますが、実験デザインに合わせて任意の方法で変更できます。たとえば、デフォルトの測定時間は3分ですが、必要に応じて5分に変更できます。
- アッセイの実行をクリックし、キャリブラント溶液に沈められたセンサーカートリッジをユーティリティプレートに挿入します。このプロセスには約25分かかります。このステップでは、各バイオセンサは、既知のpHおよび酸素濃度のキャリブラント溶液中で測定されたセンサ出力に基づいて独立して較正される。
- これが校正されたら、ユーティリティプレートを取り外し、細胞培養プレートを挿入します。
注:細胞培養プレートは最初に平衡化され、その後、装置はアッセイ培地の混合を開始し、OCRおよびECAR値を測定します。このステップには約1.5時間かかり、ユーザーの介入なしに機器内で実行されます。OCRとECARのベースライン読み取り値は、最初にアッセイ媒体を3分間混合し、次にOCRとECARを3分間測定することによって確立されます。この装置は、ミキシングと測定の3つのループを実行します。 - ベースライン測定後、機器は自動的にポートA薬液を各ウェルに注入します。これに続いて、混合と測定の3つのループが続きます(それぞれ3分)。同じパターンは、その後の各薬物注射(ポートBおよびC)の後に発生します。
- これが校正されたら、ユーティリティプレートを取り外し、細胞培養プレートを挿入します。
- 実行が完了したら、細胞培養プレートとセンサーカートリッジを取り外します。品質管理の目的で、センサーカートリッジ内のすべての薬物ポートが注入されていることを確認し、ポートを調べて残留薬物が残っていないことを確認します。センサーカートリッジとユーティリティプレートは使い捨てのアイテムであるため、廃棄してください。
- 顕微鏡下で細胞培養マイクロプレート内の細胞を調べて、細胞のコンフルエントな単層がまだあることを確認します。アッセイ培地を廃棄し、各ウェルに60 μLの1x溶解バッファーを入れ替えます。
注:溶解バッファーは、1 mMフェニルメチルスルホニルフルオリド(PMSF)を添加した脱イオン水中で1xに希釈した10x溶解バッファーから作られています。 - プレートの端をパラフィルムで包み、蒸発を防ぎ、-80°Cの冷凍庫に入れて一晩細胞溶解を助けてから、BCAアッセイを使用してタンパク質含有量を定量します。
- データ解析では、OCR値とECAR値を各ウェルのタンパク質のマイクログラムで割って、すべてのデータを正規化します。データ分析ソフトウェアを使用してMitoストレステストパラメータを自動的に計算するExcelマクロを利用するMitoストレステストレポートジェネレーターをエクスポートします。
注:これは、基礎呼吸、最大呼吸、予備呼吸容量、陽子漏れ、ATP産生、および非ミトコンドリア呼吸を決定するために使用できます。これらの計算の定義を 表 3 に示します。
4. 細胞外フラックス分析装置を用いたリアルタイム解糖系ストレス試験
- 表 1 および 表2に示す異なるアッセイ培地サプリメントおよび薬物注射を使用すること以外は、水戸ストレス試験と同じ手順に従って解糖系ストレス試験を実施する。
- データ分析のために、Excelマクロを利用してデータ分析ソフトウェアから解糖系ストレステストパラメータを自動的に計算する解糖系ストレステストレポートジェネレーターをエクスポートします。
注:これは、非解糖系酸性化、解糖系、解糖能力、および解糖系予備能を決定するために使用できます。これらの計算の定義を 表 3 に示します。
5. BCAタンパク質定量アッセイ
注:ビシンチョン酸(BCA)タンパク質定量アッセイ(スミスアッセイ15とも呼ばれます)は、サンプル中の総タンパク質含有量を決定するために使用される銅ベースの比色アッセイです。OCRおよびECARデータを各ウェルのタンパク質のマイクログラムに正規化することで、各ウェル内の異なる量の細胞/タンパク質が測定値を歪めないようにします。BCAアッセイのメカニズムは、2つの化学反応に基づいています。まず、タンパク質中のペプチド結合は、第二銅イオン(Cu2+)を第一銅イオン(Cu +)に還元しますが、これは高温(37〜60°C)によって支援される温度依存反応です。より多くのペプチド結合がある場合は、Cu2+の量を溶液16中のタンパク質含量に比例させる。この反応により、緑色から強烈な紫色の溶液に色が変化し、562nmにピーク吸光度がもたらされます16。サンプル中のタンパク質含有量が高いほど、この波長での吸光度は高くなります。このキットの動作範囲は20〜2,000μg/mLです。
- BCAアッセイキットには、タンパク質濃度の標準物質であるウシ血清アルブミン(BSA)を2 mg/mLで1 mLアリコートで含有しています。希釈していない2 mg/mL BSAから始めて、透明な平底96ウェルプレートで段階希釈液を調製し、その後、脱イオン水(2、1、0.5、0.25、0.125 mg/mLなど)で希釈して濃度を半分にします。既知の濃度のタンパク質を使用すると、実験サンプルのタンパク質含有量を計算するために使用される標準曲線の計算が可能になります。計算されたタンパク質含有量測定の精度を向上させるには、各アッセイの実験サンプルと一緒にタンパク質濃度参照標準の吸光度測定値を測定します。
- 各BSA段階希釈液25 μLを96ウェルプレートに25 μLずつピペットで入れます。
- 25 μLの1x溶解バッファーを96ウェルプレートに複製してピペットし、ブランクとして使用します。
- 細胞培養プレートを室温まで解凍し、各細胞ライセート25 μLを96ウェルプレートに25 μLずつピペットで入れます。
- BCAキット試薬A:Bの50:1の比率で作業試薬を調製し、ボルテックスによって完全に混合して作業試薬の濁りを取り除き、均質な緑色の溶液にします。200 μLの作業試薬を各ウェルに加えます。
- プレートをホイルで覆ってプレートを光から保護し、37°Cのオーブンで20分間インキュベートします。
- 96ウェルプレートリーダーで562 nmの吸光度を測定します。
- データ分析では、重複するすべての値を平均します。すべてのサンプルの測定から1x溶解バッファーウェルから決定されたブランク吸光度レベルを差し引きます。各BSA標準物質の吸光度を既知の濃度(μg/mL)にプロットすることにより、検量線を決定します。検量線から導出された一次方程式を使用して、実験サンプルのタンパク質濃度を決定します。
結果
機器は、実行ごとにOCRとECARの両方を同時に測定します。Mitoストレステストでは、パラメータ計算はOCRの読み取り値に基づいて行われますが(図3A)、解糖系ストレステストでは、パラメータ計算はECARの読み取り値に基づいています(図3B)。図3は、水戸ストレステストOCR曲線の経時的な代表的なグラフ(図3C)と、H-RPEのパラメータ計算を棒グラフの形で示しています(図3D)。解糖系ストレステストは経時的なECAR曲線として表され(図3E)、パラメータ計算はH-RPEの棒グラフで表示されます(図3F)。
基礎呼吸は、基礎条件下での細胞のエネルギー要求の理解を提供します17。第1の薬物注射であるオリゴマイシン(Oligo)は、ATP合成酵素阻害剤であり、したがって、第1の薬物注射後のOCRの任意の低下は、ATP結合呼吸の尺度である18。その後の薬物注射後に残っている基礎呼吸は、ATP合成に結合していないため、プロトンリークと見なされます。プロトンリークの増加は、生理学的に存在するが肥満、癌、2型糖尿病、心血管疾患などの病状にも関連しているタンパク質の脱共役によって調節されるミトコンドリアの脱共役の増加を示している可能性があります19。第2の注射は、ミトコンドリアの最大呼吸電位を決定するために、BAM15またはFCCPなどの脱共役剤の注射である。脱共役剤はプロトン勾配を崩壊させ、ミトコンドリア内膜を横切るプロトン原動力を低下させます。その結果、電子伝達系(ETC)を通る電子の流れが妨げられず、酸素消費率が上昇し、ミトコンドリア呼吸が最大容量20に達します。予備呼吸数(SRC)は、最大呼吸と基礎呼吸の差であり、挑戦されたときにエネルギー要求の変化に応答する細胞の能力を示し、細胞の適応度を示します。重要なことに、H-RPEにおける水戸ストレス試験では、最大呼吸数と予備呼吸能力が500 nMまたは1 μM FCCPと比較して10 μM BAM15で有意に高いため、BAM15はミトコンドリア呼吸能力の向上においてFCCPよりも優れています(図4A、B)。どちらのFCCP用量間でも有意差は観察されなかった。ロテノンとアンチマイシンA(Rot / AA)の3回目と最後の注射は、ミトコンドリア呼吸を遮断するETCのミトコンドリア複合体IとIIIをそれぞれ阻害します。残留OCRは、非ミトコンドリア源21によるものである。
解糖中、1分子のグルコースは酸素の非存在下で2分子の乳酸塩に変換される。細胞からの乳酸塩の押し出しは、乳酸分子当たり1個のプロトンの流出を伴い、したがって細胞外空間の酸性化を引き起こす。培地中のプロトン生成のフラックスは、ECARの変化によって測定されます。基礎解糖レベルが最初に確立され、その後、グルコースを含まないアッセイ媒体にグルコースが注入されて解糖を誘発し、ECARレベル22を増強する。オリゴマイシンは、ミトコンドリアATP産生を停止させ、解糖によって細胞にそのATPを誘導させるので、「最も高い」ECARを誘導するために注射される。最後に、解糖系23の最初の酵素であるヘキソキナーゼを阻害する2DGを添加することにより、解糖がシャットダウンされます。残存するECARは、OXPHOS中のTCAサイクルによるCO2 産生などの他の酸性化源に起因する可能性が高く、非解糖系ECARと表記される。解糖系予備力は、グルコースの存在下での「最も高い」ECARとECARとの差として計算されます。解糖能力は、解糖と解糖予備力の合計です。
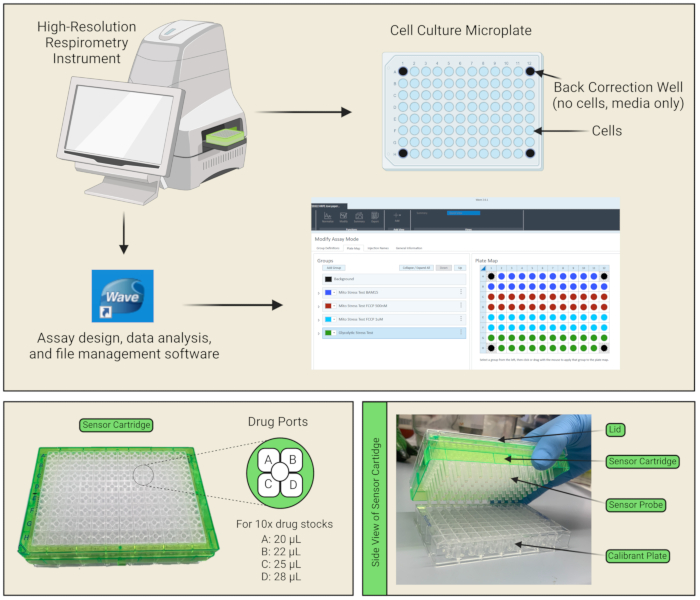
図1:プレートとセンサーカートリッジのコンポーネント 。 (A)機器、データ解析ソフトウェア、およびプロトコルセットアップインターフェイスが表示されます。96ウェル培養プレートレイアウトでは、細胞は青色のウェルに播種され、4つのコーナーウェルは培地のみを含む(細胞を含まない)後方修正ウェルとして機能するため、黒色でマークされています。(B)センサーカートリッジの各ウェルには、薬剤A、B、C、Dを装填できる4つの薬剤ポートがあります。各ポートにピペットで入れる容量は、10倍の医薬品ストック製剤の計算に基づいてリストされています。(C)センサーカートリッジは、キャリブラントで満たされたユーティリティプレートに直接配置されるセンサープローブで構成されています。 この図の拡大版を表示するには、ここをクリックしてください。
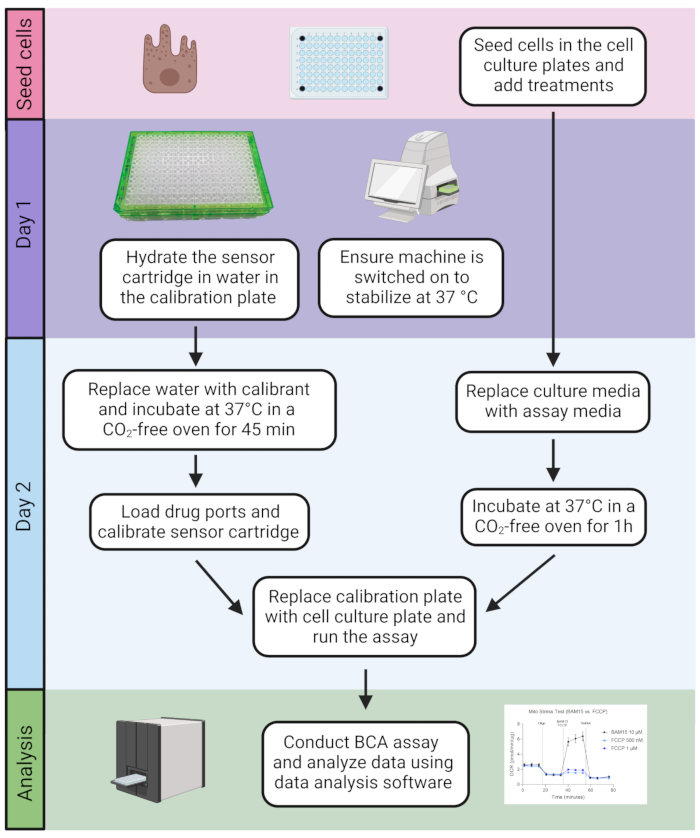
図2:アッセイのタイムライン。 細胞を細胞培養プレートに播種する。準備ができたら、アッセイには2日間の手順が含まれ、その後BCAアッセイを使用してタンパク質含有量を定量し、その後のデータ分析を行います。 この図の拡大版を表示するには、ここをクリックしてください。
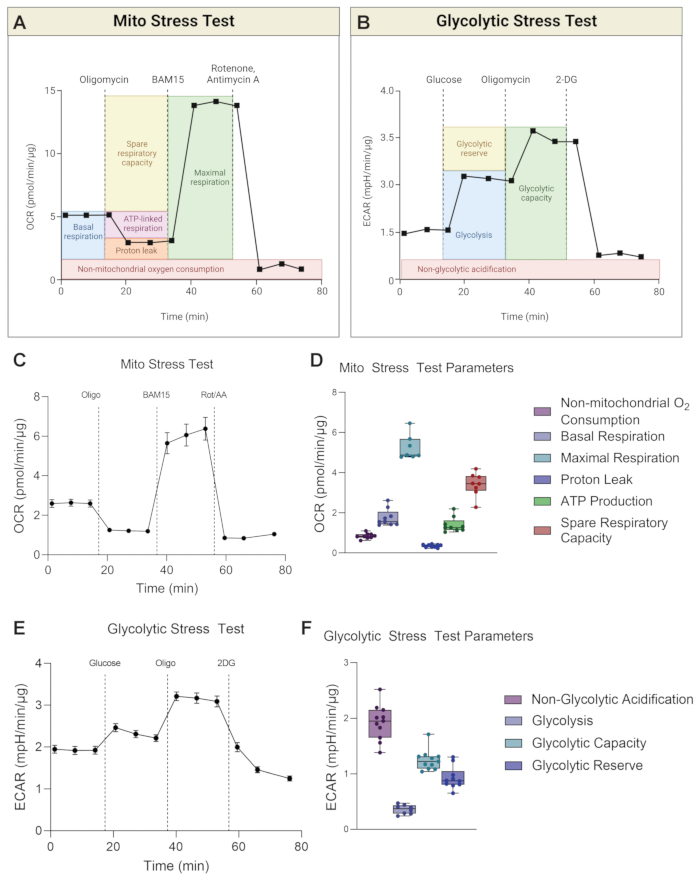
図3:水戸ストレス試験と解糖系ストレス試験の代表的なグラフ。 (A)水戸ストレステストと(B)解糖系ストレステストのパラメータの計算は、回路図に示されています。(C)H-RPEの代表的な酸素消費量(OCR)曲線と(D)水戸ストレステストパラメータを示します。(E)代表的な細胞外酸性化率(ECAR)曲線と(F)H-RPEの解糖系ストレス試験パラメータを示す。エラーバーはSEM±手段です。 この図の拡大版を表示するには、ここをクリックしてください。
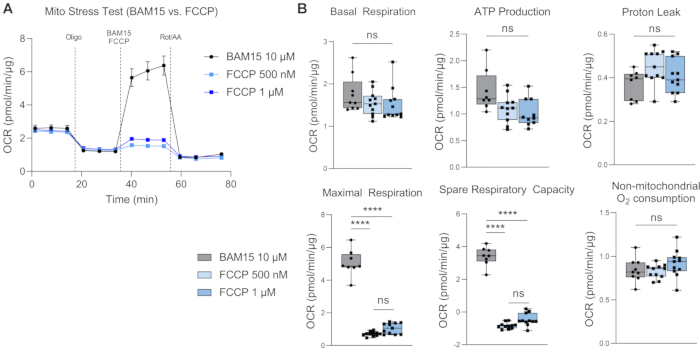
図4:脱共役剤としてのBAM15とFCCPの比較。 10 μM BAM15、500 nM FCCP、または1 μM FCCPを用いて最大呼吸を誘導する有効性を比較したH-RPEの水戸ストレス試験で、(A)酸素消費率(OCR)曲線と(B)水戸ストレステストパラメータを示します。エラーバーはSEM±手段です。 **** p ≤ 0.0001;NS、重要ではありません。 この図の拡大版を表示するには、ここをクリックしてください。
| 試験 | グルコース(mM) | グルタマックス(mM) | ピルビン酸ナトリウム | ヘペス(mM) |
| 水戸ストレステスト | 25 | 2 | 1 | 1 |
| 解糖系ストレス試験 | 何一つ | 0.5 | 何一つ | 1 |
表1:水戸および解糖系ストレス試験用のアッセイ培地に添加したサプリメントの濃度。
| 試験 | ポート A | ポート B | ポート C |
| 水戸ストレステスト | オリゴマイシン 2.5 μM | FCCP 500 nM または BAM15 10 μM | ロテノン 2 μM およびアンチマイシンA 2 μM |
| 解糖系ストレス試験 | グルコース 10 mM | オリゴマイシン 2 μM | 2-デオキシグルコース 50 mM |
表2:水戸および解糖系ストレステストの薬物ポート注射の濃度。 これらは、各ウェルへの薬物の注射後に細胞がさらされる最終濃度であることに注意することが重要です。薬物ポートをロードするときは、薬物を10倍強力に準備する必要があります。
| 用語 | 定義 | |||
| キャリブラント | キャリブラントは、センサーカートリッジのキャリブレーションに使用されるソリューションです。その処方は独自のものであり、PBSと同様の組成を持っています。 | |||
| センサーカートリッジ | センサーカートリッジには、センサーカートリッジスリーブに埋め込まれた2つの蛍光色素が含まれており、光を発する光ファイバーバンドルに接続され、蛍光色素を励起します。1つの蛍光色素は酸素フラックスを測定し、もう1つの蛍光色素はプロトンフラックスを測定します。各センサーカートリッジには4つのポートも装備されており、アッセイ中にウェルあたり最大4つの化合物を順次投与できます。 | |||
| ユーティリティプレート | ユーティリティプレート(キャリブラントプレートとも呼ばれます)は、センサーのキャリブレーションに使用されます。キャリブラント溶液はユーティリティプレートに配置されます。 | |||
| 水戸ストレステスト | 水戸ストレステストは、時間の経過に伴うOCRの変化をプロットすることにより、ミトコンドリア呼吸の生体エネルギープロファイルを提供するアッセイの名前です。 | |||
| 解糖系ストレス試験 | 解糖系ストレステストは、時間の経過に伴うECARの変化をプロットすることにより、解糖系の生体エネルギープロファイルを提供するアッセイの名前です。 | |||
| 酸素消費率 (OCR) | 酸素消費率は酸素フラックス(pmol/min)の尺度であり、ミトコンドリアの代謝状態を示します。 | |||
| 細胞外酸性化率(ECAR) | 細胞外酸性化速度は、陽子流出(mpH/分)の尺度であり、解糖代謝状態を示します。 | |||
| ウェーブソフトウェア | Waveソフトウェアは、アッセイとその後のデータ分析のプログラミングに使用されます | |||
| 非ミトコンドリア酸素消費量 | ロテノン/抗マイシンA注射後の最小速度測定 | |||
| 基礎呼吸 | (初回注入前の最終速度測定)–(非ミトコンドリア呼吸数) | |||
| 最大呼吸 | (FCCP注射後の最大速度測定)–(非ミトコンドリア呼吸) | |||
| H+( プロトン)リーク | (オリゴマイシン注射後の最小速度測定)–(非ミトコンドリア呼吸 | |||
| ATP プロダクション | (オリゴマイシン注射前の最終速度測定)–(オリゴマイシン注射後の最小速度測定) | |||
| 予備の呼吸能力 | (最大呼吸)–(基礎呼吸) | |||
| %としての予備呼吸能力 | (最大呼吸数) / (基礎呼吸数) × 100 | |||
| カップリング効率 | ATP産生率) / (基礎呼吸数) × 100 | |||
| 解糖 | (オリゴマイシン注射前の最大速度測定)–(グルコース注射前の最後の速度測定) | |||
| 解糖能 | (オリゴマイシン注射後の最大速度測定)–(グルコース注射前の最後の速度測定) | |||
| 解糖系保護区 | (解糖能力) – (解糖系) | |||
| %としての解糖系埋蔵量 | (解糖系)/(解糖系)×100 | |||
| 非解糖系酸性化 | グルコース注射前の最終速度測定 | |||
表3:アッセイの主要成分の定義のリスト。
ディスカッション
H-RPEの高分解能呼吸測定用に最適化されたこのプロトコルでは、一般的に使用されるFCCPの代わりにBAM15をアンカプラーとして使用します。RPEの高分解能呼吸法に関する以前の研究ではFCCP 9,24が使用されていましたが、BAM15はFCCPと比較してH-RPEの最大呼吸レベルのより堅牢な誘導を誘導するようです。FCCPとBAM15はどちらも細胞内で安全に使用できますが、BAM15はFCCPまたはカルボニルシアニド-3-クロロフェニルヒドラゾン(CCCP)と比較して正常細胞での副作用が少ないと報告されています25。Kenwoodらは、BAM15が原形質膜電位に影響を与えることなくミトコンドリアを脱分極し、したがって低い細胞毒性で持続的な最大ミトコンドリア呼吸速度を誘導することを示した26。一方、FCCPは、ミトコンドリアと原形質膜の両方を脱分極させ、より高い細胞毒性を示します26。
プロトコルには、マイクロプレートのすべての実験用ウェルで、細胞がRPEのコンフルエントで均一で均質な単層に適切に播種されていることを確認するなど、いくつかの重要なステップがあります。成熟RPEはエネルギー生成をOXPHOSに大きく依存しているため、アッセイ中にRPEが適切な基礎および最大OCR測定値を生成するように、細胞を少なくとも1か月間成熟させる必要があります。CO2はアッセイ培地のpHに影響を与える可能性があるため、細胞培養プレートを加湿オーブン(CO2なし)で37°Cで1時間脱ガスしてから装置に入れることは、正確なECAR測定値にとって非常に重要です。アッセイ当日に信頼性の高いOCRおよびECAR測定値が得られるように、アッセイの前日にセンサーカートリッジを水和することを忘れないでください。凍結/解凍サイクルを最小限に抑えるために、注射する薬物を適切に再構成し、再構成された医薬品ストックを長期保存のために少量に分注するように注意する必要があります。.アッセイ培地で満たされた各ウェルへの薬物の注入からの希釈を考慮するために、それぞれのアッセイ培地で希釈された10倍の薬物溶液を調製することが重要です(例:Mitoストレステスト用のMitoストレステストアッセイ培地で希釈)。その後の薬物注射ごとに、各ウェルにより多くの培地が存在するため、装填される薬物の量は注射ごとに増加するため、プロトコルで指定された量に従うように注意する必要があります。実験の完了時に、センサーカートリッジを調べて残留薬物が明らかでないことを確認し、顕微鏡で細胞培養プレートを観察して、コンフルエントで均質な細胞単層が残っていることを確認することにより、品質チェックを行うことが重要です。
このプロトコルの変更には、ポートにさまざまな薬物を注入し、これらの薬物がOCRおよびECARの読み取りにどのように影響するかを決定することが含まれます。一般的な変更の1つは、通常の水戸または解糖系ストレステスト薬を注射する前に、ポートAとして選択した実験薬を注射することです。このタイプのプロトコルは、選択した薬物の急性注射がその後のOXPHOSおよび解糖系パラメーターにどのように影響するかについての洞察を提供します。その他の変更には、さまざまな細胞タイプの検査が含まれます。これには、最適な播種細胞密度の初期トラブルシューティングと、OCRの基本測定値がOCRで50〜100 pmol/分、ECARで10〜20 mpH/分の範囲であることを確認することによるアッセイ培地の最適化が必要です。注射された薬物の最適濃度は、薬物の連続希釈に対するOCRおよびECAR応答を観察することによって検査される新しい細胞タイプごとに決定される必要があります。
プロトコルの主な制限は、細胞が通常の増殖培地中のCO2 インキュベーター内にないため、細胞生存率が時間とともに低下することであり、したがって、最大の細胞生存率を確保するためにアッセイを3〜4時間以内に完了する必要があります。さらに、各ウェルに注入されたミトコンドリア毒素への曝露は、時間の経過とともに細胞の生存率をさらに低下させる可能性があります。アッセイが完了したら、OCRおよびECARの読み取り値を正規化するためにタンパク質含有量を評価するために細胞を溶解する必要があるため、後続の分子生物学的アッセイのために同じ細胞を回収することはできません。
生体エネルギープロファイリングのためのタツノオトシゴの代替品には、オロボロスオキシグラフ2k(O2k)27、バロヒューズ28,29、およびリシファー(ルシッドサイエンティフィック)7が含まれます。オロボロスO2kは、S1クラーク型ポーラログラフ酸素電極を利用した密閉型2室呼吸計です。Oroboros O2kはリアルタイムの代謝フラックスの高感度測定を行いますが、オペレーターは各薬物30を手動で注入する必要があるため、この装置は労働集約的です。BaroFuseは、ガス圧を使用して複数の並列灌流実験を可能にし、酸素検出システムにリンクしてOCRを測定する新しいマルチチャネルマイクロ流体灌流システムです。このフロー培養システムの利点は、より長いアッセイで細胞生存率が低下するタツノオトシゴとは対照的に、組織の機能と生存率が維持されることです。Resipherは、細胞がインキュベーター内の96ウェルプレートにある間に、高感度の光学酸素センサーを使用してOCRを測定するため、数週間から数か月にわたる継続的なOCR測定が可能です。特に、これらの機器はECARを測定しないため、タツノオトシゴにはOXPHOSと解糖の両方を同時に探索できるという利点があります。
OXPHOSと解糖系のリアルタイムの生体エネルギープロファイルを調べることは、RPEの健康と機能を特徴付ける重要な要素として浮上しています。高分解能呼吸法は、正常なRPEと疾患のRPEの代謝状態を比較する効率的な手段を可能にし、AMDやPVRなどの網膜疾患に対する薬効をスクリーニングする新しい道を開きます。RPEの高分解能呼吸法の将来の方向性には、トランスウェルフィルター上で成長した高分極RPE単分子膜の生体エネルギープロファイルを調べるためのプロトコルの最適化が含まれます。Caltonら(2016)は、トランスウェルフィルター31上で成長した偏光RPE単層の三角形の断面を切断することによってこれを達成することに成功した。方法論のさらなる拡大には、異なる網膜変性状態の患者から単離された人工多能性幹細胞由来RPE(iPSC-RPE)の生体エネルギープロファイルを調べることが含まれる32。AMDおよびPVRに関与する病原性サイトカインがRPE代謝の動的性質にどのように影響するかを調べることで、新規創薬可能な標的の同定に役立つ代謝の脆弱性を明らかにすることができます。
開示事項
著者は開示するものは何もありません。
謝辞
この研究の一部は、Fight for Sight Leonard & Robert Weintraub Postdoc Fellowship(D.Y.S.)からの助成金によって支援されました。黄斑変性症研究におけるブライトフォーカス財団ポスドクフェローシッププログラム(M2021010F、D.Y.S.);国防総省、賞番号VR180132(M.S.-G.およびL.A.K.)に基づく脊椎視覚研究プログラム。国立衛生研究所の国立眼研究所、賞番号R01EY027739(L.A.K.)。ブライトフォーカス財団のプログラムである黄斑変性研究M2021010Fの寄付者には、この研究の支援を謝辞として表彰します。回路図は Biorender.com で作成されました
資料
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose | Sigma | D8375-5G | Reconstituted in the Glycolytic Assay Media from its powder form and used in the Glycolytic Stress Test (Port C injection) |
| 96 Well Non-Treated Plate, 5/Pack, Sterile | VWR | 229597 | BCA Assay 96-well plate |
| Antimycin A from Streptomyces sp. | Sigma | A8674-25MG | Inhibitor of Complex III of the electron transport chain (part of the Port C drug injection together with rotenone) |
| BAM15 | Sigma | SML1760-5MG | Uncoupling agent used for the Mito Stress Test (Port B injection) |
| BCA Assay | ThermoFisher | 23225 | To determine total protein content in each well |
| Calibrant Solution | Seahorse Bioscience | 100840-000 | Solution used to calibrate the probes of the sensor cartridge |
| Cell Lysis buffer 10x | Cell Signaling Technologies | 9803S | Dilute 10x Cell Lysis Buffer to a 1x solution using deionized water and add 1 mM PMSF before use |
| D-(+)-Glucose solution | Sigma | G8644-100ML | Supplement to be added to the Mito Stress Test assay media and also used in the Glycolytic Stress Test (Port A injection) |
| DMSO, Cell culture grade | Sigma-aldrich | D4540-100ML | For reconstituting all mitochondrial drugs except for 2DG |
| FCCP | Sigma | C2920-10MG | Uncoupling agent used for the Mito Stress Test (Port B injection) |
| GlutaMAX | Gibco | 35050061 | Supplement to be added to the assay media for both the Mito and Glycolytic Stress Tests |
| HEPES solution | Sigma | H0887-100ML | Supplement to be added to the assay media for both the Mito and Glycolytic Stress Tests |
| H-RPE – Human Retinal Pigment Epithelial Cells | Lonza | 194987 | Primary human fetal RPE cells |
| Oligomycin - CAS 1404-19-9 - Calbiochem | Sigma | 495455-10MG | ATP synthase inhibitor used for the Mito Stress Test (Port A injection) and Glycolytic Stress Test (Port B injection) |
| Parafilm | Bemis | PM996 | To seal the plate once the cells are lysed to prevent evaporation in the freezer |
| Phenylmethylsulfonyl fluoride (PMSF) Protease Inhibitor | Gold Biotechnology Inc | 50-153-2823 | Used at 1 mM for the 1x Cell Lysis Buffer solution |
| ReagentPack Subculture Reagents, 100 mL | Lonza | CC-5034 | Passaging reagents for primary human fetal RPE cells. Each kit contains 100 mL Trypsin/EDTA, Trypsin Neutralizing Solution, HEPES Buffered Saline |
| Rotenone | Sigma | R8875-1G | Inhibitor of Complex I of the electron transport chain (part of the Port C drug injection together with antimycin A) |
| RtEGM Retinal Pigment Epithelial Cell Growth Medium BulletKit - RtEBMTM Basal Medium (00195406) and RtEGMTM SingleQuots Supplements (00195407) | Lonza | 195409 | Media for primary human fetal RPE cells |
| Seahorse XFe96 Analyzer | Agilent | High-Resolution Respirometry Instrument | |
| Seahorse XFe96 FluxPak | Agilent | 102416-100 | This contains the 96-well Seahorse Cell Culture Microplate, the sensor cartridge and the calibrant solution |
| Sodium pyruvate solution | Sigma | S8636-100ML | Supplement to be added to the Mito Stress Test assay media |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 50 mL process volume, 0.22 µm pore size | Millipore-Sigma | SCGP00525 | Tube top filter unit for sterile filtration of the assay media |
| Synergy H1 Plate Reader | BioTek | Plate Reader for measuring absorbance at 562 nm for the BCA assay | |
| XF base medium without phenol red | Agilent | 103335-100 | Base media for running the Seahorse assay |
参考文献
- He, Y., et al. Mitochondria impairment correlates with increased sensitivity of aging RPE cells to oxidative stress. Journal of Ocular Biology Diseases and Informatics. 3 (3), 92-108 (2010).
- Shu, D. Y., Butcher, E., Saint-Geniez, M. EMT and EndMT: Emerging roles in age-related macular degeneration. International Journal of Molecular Sciences. 21 (12), 4271 (2020).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the Seahorse XF analyzer or a Clark-type oxygen electrode. Current Protocols in Toxicology. 60, 2-16 (2014).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio Protocol. 8 (10), 2850 (2018).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Shu, D. Y., Butcher, E. R., Saint-Geniez, M. Suppression of PGC-1α drives metabolic dysfunction in TGFbeta2-induced EMT of retinal pigment epithelial cells. International Journal of Molecular Sciences. 22 (9), 4701 (2021).
- Shu, D. Y., et al. Dimethyl fumarate blocks tumor necrosis factor-alpha-driven inflammation and metabolic rewiring in the retinal pigment epithelium. Frontiers in Molecular Neuroscience. 15, 896786 (2022).
- Satish, S., Philipose, H., Rosales, M. A. B., Saint-Geniez, M. Pharmaceutical induction of PGC-1α promotes retinal pigment epithelial cell metabolism and protects against oxidative damage. Oxidative Medicine and Cellular Longevity. 2018, 9248640 (2018).
- Ferrington, D. A., et al. Altered bioenergetics and enhanced resistance to oxidative stress in human retinal pigment epithelial cells from donors with age-related macular degeneration. Redox Biology. 13, 255-265 (2017).
- Cai, H., et al. High-throughput screening identifies compounds that protect RPE cells from physiological stressors present in AMD. Experimental Eye Research. 185, 107641 (2019).
- Kurihara, T., et al. Hypoxia-induced metabolic stress in retinal pigment epithelial cells is sufficient to induce photoreceptor degeneration. Elife. 5, 14319 (2016).
- Ishii, M., Beeson, G., Beeson, C., Rohrer, B. Mitochondrial C3a receptor activation in oxidatively stressed epithelial cells reduces mitochondrial respiration and metabolism. Frontiers in Immunology. 12, 628062 (2021).
- Rosales, M. A. B., Shu, D. Y., Iacovelli, J., Saint-Geniez, M. Loss of PGC-1α in RPE induces mesenchymal transition and promotes retinal degeneration. Life Science Alliance. 2 (3), 201800212 (2019).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Huang, T., Long, M., Huo, B. Competitive binding to cuprous ions of protein and BCA in the bicinchoninic acid protein assay. Open Biomedical Engineering Journal. 4, 271-278 (2010).
- Gu, X., Ma, Y., Liu, Y., Wan, Q. Measurement of mitochondrial respiration in adherent cells by Seahorse XF96 Cell Mito Stress Test. STAR Protocols. 2 (1), 100245 (2021).
- Symersky, J., Osowski, D., Walters, D. E., Mueller, D. M. Oligomycin frames a common drug-binding site in the ATP synthase. Proceedings of the National Academy of Sciences. 109 (35), 13961-13965 (2012).
- Divakaruni, A. S., Brand, M. D. The regulation and physiology of mitochondrial proton leak. Physiology. 26 (3), 192-205 (2011).
- Demine, S., Renard, P., Arnould, T. Mitochondrial uncoupling: A key controller of biological processes in physiology and diseases. Cells. 8 (8), 795 (2019).
- Herst, P. M., Tan, A. S., Scarlett, D. J., Berridge, M. V. Cell surface oxygen consumption by mitochondrial gene knockout cells. Biochimica Biophysica Acta. 1656 (2-3), 79-87 (2004).
- Pike Winer, L. S., Wu, M. Rapid analysis of glycolytic and oxidative substrate flux of cancer cells in a microplate. PLoS One. 9 (10), 109916 (2014).
- Laussel, C., Leon, S. Cellular toxicity of the metabolic inhibitor 2-deoxyglucose and associated resistance mechanisms. Biochemical Pharmacology. 182, 114213 (2020).
- Miyagishima, K. J., et al. AMPK modulation ameliorates dominant disease phenotypes of CTRP5 variant in retinal degeneration. Communications Biology. 4 (1), 1360 (2021).
- Gao, Z. X., et al. The new mitochondrial uncoupler BAM15 induces ROS production for treatment of acute myeloid leukemia. Biochemical Pharmacology. 198, 114948 (2022).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2014).
- Ye, F., Hoppel, C. L. Measuring oxidative phosphorylation in human skin fibroblasts. Analytical Biochemistry. 437 (1), 52-58 (2013).
- Rountree, A., et al. Barofuse a novel pressure-driven, adjustable-throughput perfusion system for tissue maintenance and assessment. Heliyon. 2 (12), 00210 (2016).
- Kamat, V., et al. Fluidics system for resolving concentration-dependent effects of dissolved gases on tissue metabolism. Elife. 10, 66716 (2021).
- Mas-Bargues, C., Garcia-Dominguez, E., Borras, C. Recent approaches to determine static and dynamic redox state-related parameters. Antioxidants. 11 (5), 864 (2022).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Molecular Vision. 24, 425-433 (2018).
- Chichagova, V., et al. Human iPSC disease modelling reveals functional and structural defects in retinal pigment epithelial cells harbouring the m.3243A > G mitochondrial DNA mutation. Scientific Reports. 7 (1), 12320 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved