Method Article
モノクローナル抗体の安全性予測のためのサイトカイン放出アッセイの頑健性を確認するための参照試薬の使用
要約
サイトカイン放出アッセイ参照試薬を使用することで、免疫療法モノクローナル抗体の再現性と標準化された in vitro 安全性プロファイルが可能になります。ここでは、サイトカイン放出アッセイをリファレンス試薬パネルと併用して、一部の治療用モノクローナル抗体の安全性を予測する方法について説明します。
要約
特定の免疫細胞を直接刺激するか、免疫系の内因性調節因子を阻害または活性化して免疫応答を間接的に増強するように設計された新しい免疫賦活抗体医薬は、サイトカイン放出症候群(CRS)などの重篤な免疫関連有害事象を引き起こす可能性があります。したがって、ヒトへの先入投与前に 、in vivo 実験と in vitro 実験を組み合わせて、このような薬剤の安全性プロファイルを評価することが重要です。サイトカイン放出アッセイ(CRA)は、提案された抗体治療薬をヒト免疫細胞(末梢血単核細胞(PBMC)や全血など)と共培養し、産生される炎症性サイトカインの量を測定するもので、ハザードの特定に重要です。しかし、異なる対照抗体を使用する異なる検査室は、CRAの調和を脅かす可能性があり、臨床的に関連性のあるコントロール(TGN1412など)の調達が困難になる可能性があり、その結果、精度や信頼性が低下したり、検査室間で比較するのが難しいデータが得られたりする可能性があります。CRAにポジティブコントロールとネガティブコントロールを含めることで、結果の精度と信頼性を確保できます。米国国立生物標準管理研究所(NIBSC)は、さまざまなCRAプラットフォームで使用することを目的とした凍結乾燥抗体コントロールのパネルを作成し、さまざまなラボやアッセイ方法間で結果を調和させています。3つの異なるポジティブコントロール抗体のセットには、抗CD52、抗CD3、および抗CD28スーパーアゴニスト(SA)が含まれ、これらは患者に用量依存的なCRSを誘導することが知られています。各抗体には、アイソタイプにマッチしたネガティブコントロール抗体が付属しています。このリファレンス試薬のパネルは、これまでに良好なラボ間再現性を示しており、さまざまなCRAプラットフォームからの安全性データの信頼性と堅牢性を高めるための適切なコントロールです。
概要
誘導性サイトカイン放出は、一部の免疫調節モノクローナル抗体(mAb)の予想および望ましい効果であり得る。しかし、炎症誘発性サイトカインの予期せぬ放出は、発熱、疲労、さらには多臓器不全を特徴とする患者にサイトカイン放出症候群(CRS)を引き起こす可能性があります1。したがって、新しい免疫賦活性mAbは、サイトカイン放出アッセイ(CRA)でサイトカインの放出を測定することにより、CRSを引き起こす可能性について in vitro で試験することが重要です。
TGN1412は、CD28スーパーアゴニスト(CD28SA)として作用することによりB細胞慢性リンパ性白血病の潜在的な治療法として開発されたモノクローナル抗体であり、共刺激受容体CD28を架橋することによりTリンパ球を活性化することができる2。2006年には、臨床試験でTGN1412投与された6人の健康なボランティアが、薬を投与されてから数時間以内にCRSを含む重篤な副作用を経験しました1。これにより、試験は中止され、TGN1412はさらなる開発から取り下げられました。副作用としてCRSを引き起こすことが知られている他の抗体には、抗CD52 mAbであるCampath-1H3、および抗CD3 mAbであるムロモナブ(OKT3)4が含まれます。患者に用量依存的なCRSを誘導する能力があるため、TGN1412、OKT3、およびCampath-1Hは、CRAから堅牢で信頼性の高い結果を生成するのに適したポジティブコントロール抗体です。しかし、これらのコントロール抗体は、高コストや入手性の制限により、以前は容易に入手できませんでした。
しかし、これら3つの抗体5,6,7とアイソタイプが一致したネガティブコントロールの再製造された凍結乾燥リファレンスパネルが、最近、National Institute for Biological Standards and Control(NIBSC)によって利用可能になりました。この参照試薬パネルは、これまでにラボ間での再現性が良好であることが示されており8、したがって、さまざまなCRAプラットフォームからの安全性データの信頼性と堅牢性を高めるための適切なコントロールです。したがって、これらの試薬と併用してこのプロトコルを使用する根拠は、CRAの調和を改善することであり、これらの試薬の利点は国際共同研究で検証されています8。
ここでは、固相(SP)PBMC CRA および水相(AQ)全血(WB)CRAでこの参照試薬パネルを使用して、抗体誘導性CRSを予測する最適な方法について説明します。これらのCRAフォーマットはどちらも、抗体の提示方法(固相では間接的、水相では直接的)と、レスポンダー細胞の異なるグループを標的とするという事実により、補完的です。同じプロトコールを、希釈した全血(dWB)または内皮(PBMC共培養)と併用して使用することができます。
プロトコル
以下のプロトコルは、NIBSC研究倫理委員会のガイドラインに従っています。適用される規制およびガイドラインに従って、健康なドナーまたは患者の書面によるインフォームドコンセントを取得します。滅菌技術を使用して、層流細胞培養フードでプロトコールのすべての調製ステップを実行します。すべての試薬と機器の詳細については 、材料の表 を参照してください。
1. 固相(SP)アッセイのためのmAb添加コーティングプレートの調製
- 参照試薬アンプルの内容物を1 mLの滅菌蒸留水で再構成します。抗体溶液を混合し、滅菌キャップ付きチューブに移す前に、水分補給のために5〜10分待ちます。
- 1 mL の水に再溶解した後、次の組換え抗体のストック濃度は 200 μg/mL になります: 抗 CD3 (15/162)、抗 CD52 (15/178)、抗 CD52 の IgG1K アイソタイプ制御 (15/198)、抗 CD3 の IgG2a アイソタイプ制御 (15/218)、抗 CD28SA の IgG4 アイソタイプ制御 (15/232)。
- 1 mLの水に再溶解した後、抗CD28SA(15/144)のストック濃度は100 μg / mLになります。7日間までの短期保存の場合は、再構成した材料を滅菌キャップ付きチューブに入れて4°Cに移します。
- 再構成した抗体および試験抗体を滅菌PBSで10 μg/mLに希釈し、滅菌した非TC処理U底ポリプロピレン96ウェルマイクロタイタープレートのウェルを100 μLの希釈抗体溶液(1 μg/ウェル)でコーティングし、4°Cで一晩インキュベートします。
注:タンパク質の吸着にはポリプロピレンプレートを使用することが重要です、これらは標準試薬9の検証に使用されました。
2. PBMCの調製
- 最低30 mLの末梢全血(WB)をヘパリン化/ヘパリン含有チューブに収集し、数回反転させてヘパリンナトリウムとの適切な混合を確保します。.
- 15 mLのWBを別のチューブに移し、後で水相全血アッセイの調製に使用します(ステップ3.1)
- 残りの15 mLの血液をPBSまたは無血清のRPMI-1培地で1:1の容量比で希釈し、希釈した血液を15 mLの密度勾配培地(例:.、lymphoprep、Ficoll-Hypaque)の上に穏やかに重ねます50 mLチューブ内。
- チューブを500 x g で室温で20分間遠心分離し、ブレーキなしで加速を抑えたスイングアウトローターで血液をさまざまな成分に分離します。
- 遠心分離後、密度勾配は血漿の最上層として分離し、続いてPBMCを含むバフィーコートの薄層、赤血球(RBC)および好中球や好酸球などの多形核顆粒球を含む最下層として分離します。ピペットを上部血漿層から直接PBMCに挿入して、PBMCを慎重に採取します。または、細胞を採取する前に上層を取り外してください。
- バフィーコートを10 mLのPBSまたは無血清RPMI-1640培地に静かに再懸濁します。.チューブを再び500 x g で10分間遠心分離し、細胞をペレット化します。上清を取り除き、捨てます。
- 洗浄手順2.6を繰り返します。ペレットを 2 mL の RPMI に 10% FCS (完全 RPMI-1640、cRPMI) で再懸濁します。
- 血球計算盤を使用して細胞をカウントします10。
- PBMCをcRPMIで1 x 106 細胞/mLの濃度に調整します。
3. 水相(AQ)全血(WB)サイトカイン放出アッセイの調製
- 190 μLのWBを96ウェルU底ポリスチレンプレートのウェルに加えます。まだ100 μg/mLでない場合は、すべての処理用抗体および参照試薬をPBSで100 μg/mLに事前に希釈します。
- 希釈した抗体10 μLを190 μLのWBに加えると、最終抗体濃度は95% WB中5 μg/mLになります。
- プレートを加湿インキュベーターで37°Cに48時間インキュベートします。
4. 固相(SP)PBMCサイトカイン放出アッセイの調製
- マルチチャンネルピペットを使用して、コーティングされたプレートから抗体溶液を取り出して廃棄し(ステップ1で説明)、試薬リザーバーにPBSを充填し、プレートを200μLのPBSで3回洗浄して、未結合のmAbを除去します。
- ステップ2.8の細胞懸濁液200μLを各ウェルに加えます。プレートを加湿インキュベーターで37°C、5%CO2で48時間インキュベートします。
5. 上清または血漿の採取
- コントロールmAbおよび試験mAbsを用いて48時間インキュベートした後、400 x g で5分間プレートを遠心分離し、細胞ペレットを乱さないように注意しながら、細胞馴染培地または血漿を回収します。採取した上清または血漿を-20°Cで凍結します。
注:血漿を採取するときは、赤血球ペレットを乱さないように注意してください。
6. 上清または血漿中のサイトカインの定量化
- 採取した上清または血漿を使用して、好ましいマルチプレックスオプションを使用して、IFN-γ、IL-2、TNF-α、およびIL-6濃度のサイトカイン分析を行います。サイトメトリービーズアッセイを用いたマルチプレックスサイトカイン解析の方法の例は、以前に発表されている11。
注:代表的な結果の生成に使用したマルチプレックスキットの 材料表 を参照してください。
結果
SPアッセイの結果は、48時間後のすべての陽性対照抗体からのpg/mL範囲のIL-2、IFN-γ、IL-6、およびTNF-α 12 の放出を示すべきであり、一致するアイソタイプ対照よりも統計的に有意に大きいはずです。私たちの代表的な結果は、ポジティブコントロール抗体であるαCD28、αCD3、およびαCD28SAが、PBMC SPアッセイで実行した場合、マッチドアイソタイプコントロールと比較して有意に高レベルのIFN-γ、IL-6、およびTNF-αを誘導することを示しています(図1)。また、このアッセイは、αCD28SAによる刺激によるIL-2放出の倍率変化が、その一致したアイソタイプ(859.0)と比較して高いという特徴もあります。一方、αCD3とαCD52は、IL-2の発現を誘導しながら、αCD28SAよりも倍率変化が少なくなります(αCD3とαCD52ではそれぞれ6.2と3.3、 図2)。
WB AQアッセイ(図3)では、検出可能なサイトカインのレベルはPBMC SPアッセイよりも著しく少ないですが、αCD52抗体(図2および図3)による刺激に対する感度が高く、IL-2、IFN-γ、およびIL-6の平均倍率変化が100を超えるという特徴があります。
将来のファーストインヒューマン投与が、関連するアイソタイプコントロールと比較してサイトカイン放出の予期せぬ有意な増加を引き起こさないと予想される試験抗体。ただし、新しい治療用mAbの開発を止めるのではなく、CRAの肯定的な結果はリスク/ベネフィット管理の一部として考慮する必要があります13。新しいCRAプラットフォームを開発するときは、プラットフォームの再現性を確保するために、異なるドナーセットを使用してアッセイを繰り返す必要があります。また、ドナー間の反応のばらつき14を考慮することも重要視されるべきであり、したがって、検出力の高い実験が推奨される15。反応の幅を理解し、ドナーの反応で観察される可能性のある変動性を完全に表現するためには、反復実験で治療薬をアッセイするだけでなく、複数の個々のドナーを用いてアッセイを実施するのが理想的です。

図1:PBMC-SP実験によるサイトカイン放出。 PBMC-SPサイトカイン放出アッセイ(1回の実験につき5-8人のドナーを含む3つの独立した実験、n=8、n=10、n=5[上から下へ])から得られたIFN-γ、IL-2、IL-6、TNF-α放出の代表的な結果。略語:PBMC =末梢血単核細胞;SP =固相;IFN-γ = インターフェロン-ガンマ;IL-2 =インターロイキン2;IL-6 =インターロイキン6;TNF-α = 腫瘍壊死因子アルファ。 この図の拡大版を表示するには、ここをクリックしてください。
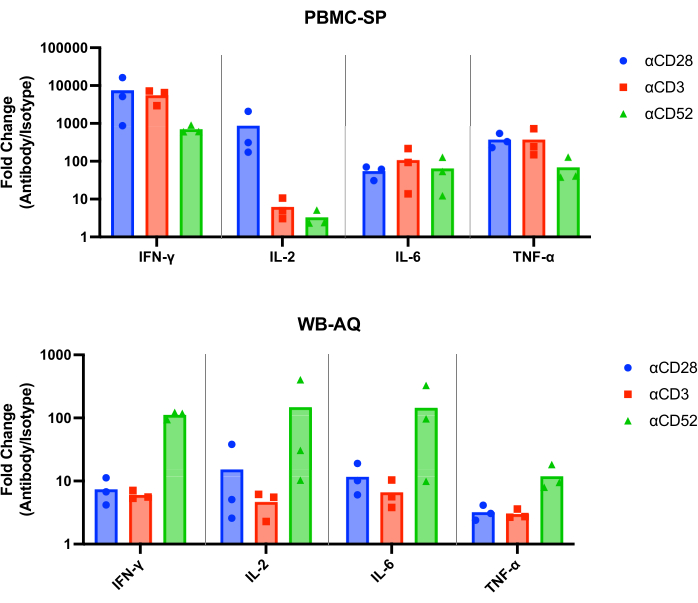
図2:PBMC-SPおよびWB-AQ実験によるサイトカイン倍率変化の増加。 48時間後のPBMC-SPおよびWB-AQサイトカイン放出アッセイから得られた、CRS誘導抗体参照試薬のIFN-γ、IL-2、IL-6、およびTNF-α放出の、それらの一致したアイソタイプコントロールと比較した倍率変化。略語:PBMC =末梢血単核細胞;SP =固相;WB = 全血;AQ =水性(相);IFN-γ = インターフェロン-ガンマ;IL-2 =インターロイキン2;IL-6 =インターロイキン6;TNF-α = 腫瘍壊死因子アルファ;CRS = サイトカイン放出症候群。 この図の拡大版を表示するには、ここをクリックしてください。
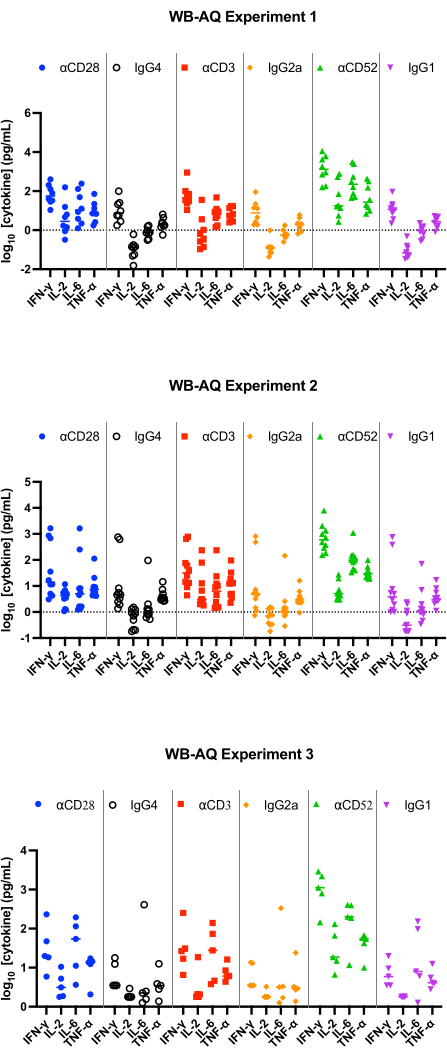
図3:WB-AQ実験によるサイトカイン放出。 WB-AQサイトカイン放出アッセイ(1回の実験につき5-8人のドナーを含む3つの独立した実験、n=8、n=10、n=5 [上から下])から得られたIFN-γ、IL-2、IL-6、TNF-αの代表的な結果を参照試薬抗体を使用した場合の48時間後。略語:WB =全血;AQ =水性(相);IFN-γ = インターフェロン-ガンマ;IL-2 =インターロイキン2;IL-6 =インターロイキン6;TNF-α = 腫瘍壊死因子アルファ。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここでは、抗体コーティングプレートからの抗体媒介刺激後、または溶液中の抗体を用いて、ポジティブコントロールおよびネガティブコントロール用の参照試薬パネルを使用して、PBMCおよびWBからのサイトカイン放出を測定する方法を説明します。これらのアッセイにはそれぞれ、関連する長所と短所があります。PBMCアッセイとWBアッセイは、リンパ球、単球、顆粒球などのさまざまな免疫細胞の割合がCRAに使用される2つの実験マトリックスで異なるため、補完的です。興味深いことに、WBアッセイはPBMC単培養とは対照的に in vivo 条件をより適切に表す可能性がありますが、前者のプラットフォームはTGN1412およびOKT3からのT細胞媒介性CRSリスクをあまり予測できません15。IL-2を介したT細胞増殖を阻害するRBC上のグリコフォリンAの結果16。それにもかかわらず、抗CD52によるCRSリスクの予測は、好中球の存在によりWB CRAでも損なわれません(ステップ2で説明した従来の密度勾配法で失われ、PBMC単離に使用)。
CRA の形式 (SP または AQ プレゼンテーション) は、CRS の特定のメカニズムを検出するために重要です。例えば、ヒトリンパ球17,18に対するmAbの水性相提示は、TGN1412の前臨床in vitro安全性試験中に用いられたが、局在性細胞受容体のクラスタリングおよび関与19の欠如、およびその結果として水性相の抗体によって媒介されるT細胞活性化のために、CRSリスクを特定することができなかった。実際、TGN1412媒介CRSは、ここで提示されているように、Fc-γR(FcγR)架橋を人工的に複製するSPフォーマット、またはPBMC前培養における高密度およびCD32+免疫細胞(B細胞20や単球21など)とのFc相互作用における接触依存性プライミングによってのみ、正確に検出することができた。
これらのプラットフォームに加えて、より複雑な共培養システムでCRAを実行する他の方法があります。これらの方法に記載されているものに代わるCRAの例は、PBMCを自家血液増殖内皮細胞(BOEC)22と共培養することである。このアッセイは、2015年に、当時の従来の混合ドナーであるHUVEC:PBMCアッセイを、交絡組織のミスマッチを除去することにより改善したものとして記載されました。これは、WBアッセイよりも抗CD28SA CRSに対する優れた感受性を示し、 また、in vivoに存在する内皮細胞と白血球の組み合わせを模倣することにより、PBMC単一培養アッセイの制限を克服するが、特殊な細胞培養技術を必要とするより長い手続きステップを犠牲にする22。
さらに、このプロトコルは特にIFN-γ、IL-2、IL-6、およびTNF-αの放出に焦点を当てていますが、MHRAの同僚は以前にこの設定でIL-12などを調べていました23。IL-12の産生は、これらのポジティブコントロールCRS抗体によって増加しますが、特に感度が高いわけではないため、このモダリティではCRSの優れた予測因子ではないかもしれません。IL-15などの一部のサイトカインは、私たちのプロトコルで評価された4つのサイトカインがCRSの潜在的なリスクの良い指標を提供しますが、テストされたことはありません。もちろん、モダリティや試験した抗体によっては、他のサイトカインを評価することもできます。
これらの観察結果を組み合わせると、参照試薬の使用は新しい抗体のCRSリスクを特定するのに役立つが、CRSの可能性を特定できない可能性のある最適でないCRAプラットフォームを避けるよう注意する必要があることに注意することの重要性が強調されています。重要なことは、治療薬の予測される作用機序は、そのFc領域 を介して であろうと、抗原発現細胞に対する仮定された作用であろうと、アッセイの生物学と一致しなければならないということです。したがって、この記事で取り上げた試験用治療用試薬と参照試薬の作用機序の違いは、試験抗体に関連するCRAが参照試薬の生物学的特性と互換性がないという潜在的な制限をもたらす可能性がありますが、このアッセイは、ハザードを特定するための堅牢で信頼性の高いプラットフォームを提供します。ただし、さまざまな作用機序と免疫細胞サブセットをカバーするいくつかのCRAフォーマットの結果は、安全性評価データの信頼性を最適化するために必要になる場合があります。
開示事項
EMは以前、医薬品・医療製品規制庁(MHRA)に雇用されていました。残りの著者には利益相反はありません。
謝辞
この研究は、National Institute for Biological Standards and Controlによって資金提供されました。原稿を査読し、有益なコメントや提案をくださったSandra Dieboldに感謝します。また、ビデオを撮影してくれたKa Seng Ieongにも感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 ml Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | |
| Fetal Bovine Serum, qualified, heat inactivated | ThermoFisher | 10500064 | |
| Heparinized tubes | ThermoFisher | 12967676 | |
| Heracell 150i CO2 Incubator | ThermoFisher | 16406639 | |
| MESO QuickPlex SQ 120 Human Proinflammatory Panel 1 V-PLEX kit | Meso Scale Discovery | K15049 | |
| MESO QuickPlex SQ 120MM | Meso Scale Discovery | AI1AA-0 | |
| Neubauer Improved Haemocytometer Counting Chamber | Hawksley | AS1000 | |
| Panel of lyophilized recombinant antibody controls for Cytokine Release Assays | NISBC | 19/156 | |
| PBS | ThermoFisher | 10010023 | |
| Polypropylene 96-well microtiter plate | Corning | 3879 | |
| Polystyrene 96-well microtiter plate | Corning | 3799 | |
| RPMI 1640 | ThermoFisher | 11875093 | |
| Sorvall ST 40 Centrifuge | ThermoFisher | 75004525 | |
| Sterile water | ThermoFisher | 15230162 |
参考文献
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. The New England Journal of Medicine. 355 (10), 1018-1028 (2006).
- Hünig, T. The storm has cleared: lessons from the CD28 superagonist TGN1412 trial. Nature Reviews Immunology. 12 (5), 317-318 (2012).
- Wing, M. G., et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. Journal of Clinical Investigation. 98 (12), 2819-2826 (1996).
- Gaston, R. S., et al. OKT3 first-dose reaction: Association with T cell subsets and cytokine release. Kidney International. 39 (1), 141-148 (1991).
- Riechmann, L., Clark, M., Waldmann, H., Winter, G. Reshaping human antibodies for therapy. Nature. 332 (6162), 323-327 (1988).
- Kung, P., Goldstein, G., Reinherz, E. L., Schlossman, S. F. Monoclonal antibodies defining distinctive human T cell surface antigens. Science. 206 (4416), 347-349 (1979).
- Ball, C., et al. Antibody C region influences TGN1412-like functional activity in vitro. Journal of Immunology. 189 (12), 5831-5840 (2012).
- Vessillier, S., et al. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine: X. 2 (4), 100042(2020).
- Findlay, L., et al. Improved in vitro methods to predict the in vivo toxicity in man of therapeutic monoclonal antibodies including TGN1412. Journal of Immunological Methods. 352 (1-2), 1-12 (2010).
- oVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. Journal of Visualized Experiments. , (2023).
- Lehmann, J. S., Zhao, A., Sun, B., Jiang, W., Ji, S. Multiplex Cytokine Profiling of Stimulated Mouse Splenocytes Using a Cytometric Bead-based Immunoassay Platform. Journal of Visualized Experiments. (129), e56440(2017).
- Murthy, H., Iqbal, M., Chavez, J. C., Kharfan-Dabaja, M. A. Cytokine Release Syndrome: Current Perspectives. Immunotargets Therapy. 8, 43-52 (2019).
- Vidal, J. M., et al. In vitro cytokine release assays for predicting cytokine release syndrome: the current state-of-the-science. Report of a European Medicines Agency Workshop. Cytokine. 51 (2), 213-215 (2010).
- Grimaldi, C., et al. Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine. 85, 101-108 (2016).
- Vessillier, S., et al. Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials - Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. Journal of Immunological Methods. 424, 43-52 (2015).
- Chu, J. W. K., Sharom, F. J. Glycophorin A interacts with interleukin-2 and inhibits interleukin-2-dependent T-lymphocyte proliferation. Cellular Immunology. 145 (2), 223-239 (1992).
- Stebbings, R., Eastwood, D., Poole, S., Thorpe, R. After TGN1412: recent developments in cytokine release assays. Journal of Immunotoxicology. 10 (1), 75-82 (2013).
- Hanke, T. Lessons from TGN1412. Lancet. 368 (9547), author reply 1570 1569-1570 (2006).
- Stebbings, R., et al. #34;Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. Journal of Immunology. 179 (5), 3325-3331 (2007).
- Bartholomaeus, P., et al. Cell contact-dependent priming and Fc interaction with CD32+ immune cells contribute to the TGN1412-triggered cytokine response. Journal of Immunology. 192 (5), 2091-2098 (2014).
- Hussain, K., et al. Upregulation of FcγRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood. 125 (1), 102-110 (2015).
- Reed, D. M., et al. An autologous endothelial cell:peripheral blood mononuclear cell assay that detects cytokine storm responses to biologics. The FASEB Journal. 29 (6), 2595-2602 (2015).
- Eastwood, D., et al. Severity of the TGN1412 trial disaster cytokine storm correlated with IL-2 release. British Journal of Clinical Pharmacology. 76 (2), 299-315 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved