イメージングマイクロプレート中のプレキャストポリ(エチレングリコール)(PEG)ヒドロゲルを用いた血管化骨形成骨髄ニッチの簡単な確立
要約
骨髄血管ニッチの in vitro モデルは、間葉系細胞および内皮細胞をプレキャスト3D PEGヒドロゲル上に播種することによって確立される。内皮ネットワーク、ECM成分、およびニッチのALP活性は、使用される成長因子によって異なります。このプラットフォームは、高度ながんモデルに使用できます。
要約
骨と骨髄は高度に血管新生し、構造的に複雑な臓器であり、癌と転移形成の部位です。血管新生を含む骨および骨髄特異的機能を再現し、薬物スクリーニングと適合する in vitro モデルが非常に望ましい。このようなモデルは、単純で構造的に無関係な2次元(2D)in vitro モデルと、より高価で倫理的に困難な in vivo モデルとの間のギャップを埋めることができます。この記事では、血管新生した骨形成性骨髄ニッチを生成するための、操作されたポリ(エチレングリコール)(PEG)マトリックスに基づく制御可能な3次元(3D)共培養アッセイについて説明します。PEGマトリックス設計により、カプセル化を必要としない簡単な細胞播種ステップで3D細胞培養の開発が可能になり、複雑な共培養システムの開発が可能になります。さらに、マトリックスは透明で、ガラス底の96ウェルイメージングプレートにプレキャストされているため、システムは顕微鏡検査に適しています。ここに記載のアッセイでは、ヒト骨髄由来間葉系間質細胞(hBM-MSC)を、十分に発達した3D細胞ネットワークが形成されるまで最初に培養する。続いて、GFP発現ヒト臍帯静脈内皮細胞(HUVECs)が添加される。培養開発に続いて、明視野顕微鏡および蛍光顕微鏡が続きます。hBM-MSCネットワークの存在は、 そうでなければ形成されず、少なくとも7日間安定している血管様構造の形成を支持する。血管様ネットワーク形成の程度は容易に定量化することができる。このモデルは、共培養の4日目と7日目のアルカリホスファターゼ(ALP)活性の増加によって評価されるように、hBM-MSCの骨形成分化を促進する骨形成タンパク質2(BMP-2)を培地に補充することにより、骨形成性骨髄ニッチに向けて調整できます。この細胞モデルは、さまざまながん細胞を培養し、それらが骨および骨髄特異的な血管ニッチとどのように相互作用するかを研究するためのプラットフォームとして使用できます。また、自動化やハイコンテント解析にも適しており、再現性の高い培養条件下での抗がん剤スクリーニングが可能です。
概要
骨と骨髄は、人間の健康の中心となる構造的および機能的に複雑な器官です。これは、造血と骨の維持を調節する明確なニッチの存在によって反映されています1。健康な骨髄では、造血幹細胞と骨格幹細胞、ならびにそれらの子孫の維持と拡大が、異なるニッチによって制御されていることが現在広く受け入れられています。これらのニッチは、骨系細胞、間葉系幹細胞、内皮および血管周囲細胞、神経細胞およびグリア細胞、脂肪細胞、破骨細胞、マクロファージ、好中球など、さまざまな細胞タイプで構成されています2。当然のことながら、これらの主に血管系に関連するニッチは、さまざまな種類の白血病の発症にも関与しており3、さまざまな癌の転移部位です4。骨形成、リモデリング、および骨(骨髄)の維持におけるその特定の役割のために、骨関連血管系は、体の他の場所で見られる血管系とは異なる明確な特殊な構造を持っています5,6,7。したがって、全身に適用される抗血管新生または血管系調節薬は、これらの特殊な環境内で異なる効果を有し得る8。したがって、骨および骨髄の生理学的特性の維持、骨および骨髄の再生、ならびに治療的処置への応答に関与する分子機構を調査するためのモデルが非常に望ましい。
古典的な2次元(2D)組織培養と動物モデルを使用したin vivo調査は、骨と骨髄の発生に関与するさまざまな細胞と分子プレーヤーの役割に関する貴重な洞察を提供しました9,10。関連するヒト細胞を用いたハイスループット実験を可能にするモデルは、これらの非常に複雑なシステムで選択されたパラメータを調節する方法についての理解を深める可能性があります。
過去10年間で、組織工学から派生した原理が3D組織モデルを生成するために採用されてきました11,12。これらは主に、3D単培養または共培養を確立するために、組織関連細胞を生体材料にカプセル化することに依存してきました13。最も使用されている生体材料の中には、フィブリン14、コラーゲン15、およびマトリゲル16,17があり、これらはすべて生体適合性が高く、多くの細胞タイプの増殖に適した条件を提供します。これらの生体材料は、in vivoで見られるさまざまな血管ニッチの重要な側面を再現するin vitroモデルを生成する能力を持っています18。さらに、灌流された血管骨および骨髄モデルを生成するためのマイクロ流体デバイスの使用は、より複雑なin vitroモデルの生成に寄与している19、20、21、22。
天然に存在する生体材料の組成を制御し、特性を設計することの難しさは、予測可能な物理的、化学的、および生物学的特性で合理的に設計できる合成類似体の開発に影響を与えました23,24。我々は、RGDペプチドおよびマトリックスメタロプロテアーゼ(MMP)切断部位で機能化され、細胞の付着およびリモデリングを容易にする完全合成第XIII因子(FXIII)架橋ポリ(エチレングリコール)(PEG)ベースのヒドロゲルを開発しました25,26。これらの生体材料のモジュール設計は、3D血管化骨および骨髄モデルの形成のための条件を最適化するために首尾よく使用されている27、28。
多数の異なる培養条件や新しい治療法の試験には、より高いスループット能力を備えたモデルが必要です。最近、PEGヒドロゲルのFXIII架橋が、詳細なヒドロゲル剛性勾配が形成されるような電気化学的プロセスによって制御できることを示しました29。細胞がそのようなヒドロゲルの上に添加されると、それらは内部に向かって移動し、徐々に高度に相互接続された3Dセルラーネットワーク30に発達する。通常、他の3Dスキャフォールドとともに存在するヒドロゲルに細胞をカプセル化する必要がなくなるため、実験デザインが簡素化されるだけでなく、異なる時点で異なる細胞タイプを順次追加して、複雑な共培養システムを生成できます。これらのヒドロゲルは、ガラス底の96ウェルイメージングプレートにプレキャストできるため、手動および自動の細胞播種プロトコルで3D培養の確立が可能です。PEGヒドロゲルの光学的透明性により、プラットフォームは顕微鏡と互換性があります。
ここでは、このすぐに使用できる合成プラグアンドプレイプラットフォーム内で血管新生骨形成ニッチを生成および特性評価するための簡単な方法を紹介します。血管網の発達は、in vitro骨形成の誘導に一般的に使用される成長因子である骨形成タンパク質-2(BMP-2)で刺激され、骨形成分化は線維芽細胞成長因子2(FGF-2)の補給によって防止できることを示しています27,31。形成されるネットワークは、FGF-2刺激ネットワークと比較すると、全体的な外観、ならびに細胞およびECM分布の点で異なる。また、アルカリホスファターゼをマーカーとして骨形成誘導をモニターした。このマーカーの発現が経時的に増加していることを実証し、定性的および定量的方法を使用してFGF-2刺激ネットワークでの発現と比較します。最後に、このモデルの生成されたニッチが2つの潜在的なアプリケーションに適していることを実証します。まず、予め形成されたニッチにベバシズマブを添加し、その存在下で血管網の分解をモニタリングすることにより、概念実証薬物感受性アッセイを実施しました。次に、MDA-MB-231乳がんとU2OS骨肉腫細胞を予め形成された骨形成ニッチに添加し、これらのニッチを使用してがん細胞とその環境との相互作用を研究できることを示しました。
プロトコル
図 1 は、以下のプロトコル セクションをまとめたものです。
1. 3D間質モノカルチャーの確立
- hBM-MSC細胞懸濁液を調製する。
- 10%FBS、1%ペニシリン-ストレプトマイシン、および5 ng/mL FGF-2を添加したMEMα中で、加湿雰囲気中の37°Cおよび5%CO2 のインキュベーターでhBM-MSCを70%〜90%のコンフルエンスレベルまで増殖させます。細胞は継代6まで使用してもよい。
- 細胞をPBSで洗浄し、0.05%トリプシン-EDTAを用いて37°Cで3〜5分間剥離します。 基礎培地(MEMαに10%FBSおよび1%ペニシリン - ストレプトマイシンを添加したもの)で洗い流すことによって剥離プロセスを停止します。懸濁した細胞を50 mLのコニカル遠心管に回収します。
- 血球計算盤または自動セルカウンターを使用して細胞をカウントし、懸濁液中の細胞の総数を決定します。
- 細胞を200 x g で5分間遠心分離してペレット化します。上清を慎重に取り除きます。
- 細胞を適切な量の基礎培地に再懸濁して、1 x 107 細胞/mLのストック溶液の濃度を達成します。
- 必要量の基礎培地(FGF-2およびBMP-2を規定の濃度、例えば0 ng/mL、25 ng/mL、50 ng/mL、100 ng/mL、または200 ng/mL)を含む50 mLコニカル遠心チューブを準備します。ウェルあたり、200 μLが必要です。自動リキッドハンドラーを使用して細胞播種を行う場合は、装置のデッドボリュームも考慮してください。手動の細胞播種の場合、10%を超える体積で十分です。
- ストック溶液からhBM-MSCを1:66.67の希釈率で添加し、1.5 x 105 細胞/mLの濃度にします。
- 播種用のプレートを準備します。
- 96ウェルハイドロゲルプレートを覆っているポリプロピレン接着フィルムをはがします。
- ヒドロゲルを覆っている貯蔵バッファーを注意深く吸引します。この作業には、マイクロプレートウォッシャーを使用します。ただし、手動処理は可能です。
- 手動アスピレーターまたはマルチチャンネルピペットを使用する場合は、チップをウェルの壁に当て、バッファーを吸引しながら、ウェルの内側の端に向かってゆっくりと下に移動します。これにより、ヒドロゲル表面の損傷が回避されます。
- 自動プレートウォッシャーを使用する場合は、吸引ノズルをプレートキャリアから少なくとも3.8 mm(これはヒドロゲルプレートの内輪から0.8 mmに相当)およびウェルの端に向けて設定します。より詳細な手順および96ウェルヒドロゲルプレートのプレート図を入手するには、製造元のマニュアルを参照してください。
- ステップ1.1.7で調製した細胞懸濁液を200 μL/ウェル加え、十分に混合した後、細胞が均一に分布するようにします。播種中は、基質の1つの領域における細胞の不均一な沈降を避けるために、プレートを傾けないでください。手動播種の場合は、混合物を均一に保つために(3つのウェルを播種した後)細胞懸濁液を定期的に混合する。自動播種の場合は、分注直前に血清学的ピペットと混合して、同数の細胞を含む容量を分注します。
- 培養物を加湿雰囲気中で37°Cおよび5%CO2 に維持する。
- 必要に応じて、5倍の対物レンズを備えた明視野顕微鏡で培養の発達を監視します。播種後約30分で参照画像を取得し、添加細胞数を評価します。
2. 3次元間質-内皮細胞共培養の確立
- GFP-HUVEC細胞懸濁液を調製します。
- 150 μg/mL ラットテールコラーゲン I を 0.02 M 酢酸溶液で 37 °C で 30 分間コーティングすることにより、HUVEC 培養用のフラスコを準備します。 使用前にPBSで一度すすいでください。
- GFP-HUVECをEGM-2で80%〜100%のコンフルエンスレベルまで成長させ、37°Cのインキュベーターで10%FBSを、加湿雰囲気で5%CO2 を添加します。細胞は継代7まで使用してもよい。
- 細胞をPBSで洗浄し、0.05%トリプシン-EDTAを用いて37°Cで2〜3分間剥離します。 基礎培地(MEMαに10%FBSおよび1%ペニシリン - ストレプトマイシンを添加したもの)で洗い流すことによって剥離プロセスを停止します。懸濁した細胞を50 mLのコニカル遠心管に回収します。
- 血球計算盤または自動セルカウンターを使用して細胞をカウントし、懸濁液中に存在する細胞の総数を決定します。
- 細胞を200 x g で5分間遠心分離してペレット化します。上清を慎重に取り除きます。
- 細胞を適切な量の基礎培地に再懸濁して、1 x 107 細胞/mLのストック溶液の濃度を達成します。
- ステップ1.1.6でhBM-MSCについて説明しましたように、それぞれの成長因子(定義された濃度のFGF-2およびBMP-2、たとえば、0 ng / mL、25 ng / mL、50 ng / mL、100 ng / mL、または200 ng / mL)を添加した必要量の基礎培地を含む50 mLのコニカル遠心チューブを準備します。
- ステップ1.1.7でhBM-MSCについて説明したように、ストック溶液からGFP-HUVECを1:66.67の希釈で添加して、1.5 x 105 細胞/mLの濃度を達成します。
- 間質単培養を含むプレートから培地を吸引します(ステップ1.2.2でバッファー除去について説明したように)。
- ステップ1.3のhBM-MSC添加について説明したように、ステップ2.1.8で調製したGFP-HUVEC細胞懸濁液を200 μL/ウェル加えます。
- 加湿雰囲気中で37°C、5%CO2 でインキュベートします。3〜4日ごとに培地を交換してください。
- 必要に応じて、5倍の対物レンズを使用して明視野顕微鏡および蛍光顕微鏡で培養の進展を監視します。初期または中間の特性評価のために、共培養の4日目または7日目まで、それぞれ、または所望に応じて培養を維持する。
3.特性評価手順1:内皮細胞ネットワーク形成の定量化
- 目的の時点で、定量化に適した設定(すなわち、最高の焦点、高コントラスト、および低倍率(例えば、より広い視野のための5倍))を使用して、蛍光顕微鏡でGFP-HUVECからGFP信号を取得します。
- 同じ日に取得したすべての画像を均等に前処理して(たとえば、フィジー32を使用)、コントラストをさらに高めます。GFPシグナルは培養時間とともに暗くなる可能性があることに注意してください。したがって、異なる日に取得された画像は、異なる処理を必要とする場合があります。
- フィジーまたはImageJを使用している場合は、同じ時点のすべてのGFPチャンネル画像を開き、 明るさとコントラスト メニューを開きます。中間条件(最も暗い信号でも明るい信号でもない)を表す画像を選択し、[自動]を選択してコントラストを 自動調整します。[ 設定] を選択し、[ 開いている他のすべてのイメージに反映する] をオンにします。
- 自動的に選択された範囲が現在の時点のすべての画像に適合するかどうかを視覚的に評価し、必要に応じて手動で再調整してすべての画像に再伝播します。
- 調整した画像をTIFファイルとして保存し、取得した他の時間ポイントに対して手順3.2.1と手順3.2.2を繰り返します。
- すべての画像にメディアンぼかしフィルター(たとえば、2048x2048画像の場合は半径3)を適用して、下流のアーティファクト認識を回避し、正確なネットワーク識別を容易にします。ビニング(2x2)でサイズを縮小し、すべての前処理された画像をグレースケールRGBカラーTIFファイルとして定量化用のフォルダーに保存します。これらの手順は、手動またはバッチモードで、作成者が要求に応じて共有するマクロを使用して実行できます。
- 手順3.1-3.3で作成したフォルダ内のすべての画像を、ImageJ33用血管新生分析装置のバッチ処理モードを使用して解析します。イメージのサイズと使用可能な作業メモリによっては、イメージごとに数分かかる場合があることに注意してください。
- 認識された構造と元の画像のオーバーレイを調べることにより、定量化結果を検証します。アルゴリズムが、元の画像に少数の細胞しか見られない、またはまったく見えない人工構造を認識する場合は、前処理パラメータを調整し、元の画像を再分析するか、そのような問題のある領域を除外したり、画像を分析から複製したりします。
- 各サンプルの値に分析面積と1 mm2の比率を掛けて、得られた値を1 mm2の面積に正規化します。この手順は、異なるサイズの画像を使用する場合に特に重要です。
- 解析から、ネットワーク全体の長さ、ジャンクション数、セグメント数、孤立セグメント数、分岐間隔、平均メッシュサイズなどのさまざまなネットワークパラメータを抽出し、それらを使用して、さまざまな時点およびさまざまな培養条件下での内皮ネットワークの特性評価を行います。
4. 特性評価手順2:ECM堆積の評価
- 目的の終了時点で、免疫蛍光を使用してECM沈着を評価します。以下に説明するように、培養の最後の6時間中または固定後に、100 μLの培養液にさまざまなECM分子に対する一次抗体を追加します。
- 培養物を200 μL/ウェルのPBSでRTで5分間1回洗浄し、100 μL/ウェルの4%パラホルムアルデヒドで化学ヒュームフードの下でRTで30分間固定します。 このステップでは周囲の培養物が損傷する可能性があるため、プレートのすべてのウェルを同時に固定することをお勧めします。固定培養物を200 μL/ウェルのPBSでRTで3回ずつ5分間洗浄し、200 μL/ウェルのPBSで4°Cで保存するか、すぐに次のステップに進みます。
- 固定後にECM分子に対する一次抗体とインキュベートする前に、ブロッキング溶液としてPBS中の1%BSAの200 μL/ウェルで固定培養物をRTで30分間インキュベートします。
- ブロッキング溶液を吸引し、PBS中の1%BSA中の100 μL/ウェルの一次抗体溶液とともに4°Cで一晩インキュベートします。 200 μL/ウェルのPBSで、RTでそれぞれ5分間、少なくとも3時間、および5分間、3回洗浄します。
注:ヒドロゲルから未結合抗体を完全に拡散させるには、長い洗浄ステップが必要です。
- ブロッキング溶液を吸引し、PBS中の1%BSA中の100 μL/ウェルの一次抗体溶液とともに4°Cで一晩インキュベートします。 200 μL/ウェルのPBSで、RTでそれぞれ5分間、少なくとも3時間、および5分間、3回洗浄します。
- 細胞内対比染色を含む二次染色溶液の浸透を促進するために、培養物の細胞密度に応じて、PBS中の0.3%Triton X-100および1%BSAを使用して、RTで30〜90分間培養物を透過処理します。
注:細胞内分子の抗体ベースの染色の場合、このステップは、ステップ4.1.2で説明した一次抗体とのインキュベーションの前に実行する必要があります。 - それぞれの二次抗体を含む二次染色液を調製し、所望により対比染色剤(例えば、DAPIなどの核染色剤やファロイジン・ローダミンなどの細胞骨格染色剤など)を調製します。
- PBS中の0.1%Triton X-100、1%BSAからなる染色バッファーを調製し、対比染色(例:1 μg/mL DAPIおよび1:4,000ファロイジン-ローダミン)し、それぞれの二次抗体を推奨希釈液で添加します。
- 100 μL/ウェルの二次染色液を加え、4°Cで一晩インキュベートします。 一次抗体インキュベーション後の手順と同様に、200 μL/ウェルのPBSで5分間、少なくとも3時間、および5分間、RTでそれぞれ3回洗浄します。
- 構造の3D解像度には、ガラス底部から2.5 μmのzステップで最終高さ500 μmに達する共焦点スタックを取得し、10倍の対物レンズと0.75倍のデジタルズームを使用します。フィジーでGFPおよびF-アクチン信号の3D再構成を生成するには、コンポジットを作成してFiji 3D Viewerを使用して再構成を生成する前に、各チャンネルを個別にしきい値化します。
- 免疫染色から沈着したECMを可視化するには、高さ100 μmの共焦点スタックを5 μmのzステップ、10倍の対物レンズ、1.5倍のデジタルズームで取得します。コンポジットを作成する前に、フィジーで最大強度の投影を生成し、各チャンネルの明るさとコントラストを個別に調整します。
- 細胞外環境の直接色染色を行います。
- 200 μL/ウェルのピクロシリウスレッド染色溶液をパラホルムアルデヒド固定ウェルに加え、RTで1時間インキュベートします。
- 次に、染色したウェルを蒸留水で5回洗浄し、続いてサンプルの色透明化を監視しながら3〜4日間、毎日または2日ごとに2回洗浄します。長時間の洗浄ステップ(つまり、6時間を超えるもの)の間は、プレートを4°Cに保ちます。
- カラーカメラを搭載した明視野顕微鏡で染色サンプルの画像を取得し、条件全体で均一なホワイトバランスを維持します。サンプルの概要を取得するには、低倍率(2.5倍など)を使用してウェル全体をスキャンします。顕微鏡に自動ステッチングをサポートするソフトウェアが付属していない場合は、手動で行います(たとえば、フィジー34のペアワイズステッチングを使用します)。
注:蛍光画像の取得が完了していれば、以前に免疫蛍光に使用されたウェルをこれに使用できます。 - 手順4.2.1-4.2.3のピクロシリウスレッド染色で説明したのと同じ手順に従って、アリザリンレッド染色、洗浄、およびイメージングを実行します。
5.特性評価手順3:ALP活性のモニタリングによる骨形成分化の評価
- 異なる培養終了時点(共培養の4日目と7日目など)で、5-ブロモ-4-クロロ-3-インドリルリン酸(BCIP)/ニトロブルーテトラゾリウム(NBT)染色を使用してALP活性を定量的に評価します。
- 培養液を200 μL/ウェルのPBSで1回洗浄してから、製造元の指示に従って調製したBCIP/NBT基質溶液でインキュベートしてください。発色を定期的にモニタリングしながら37°Cでインキュベートします。非骨形成状態で色が発達し始めたら、ステップ4.1.1で説明されているように、4%パラホルムアルデヒドで固定する前に、すぐに200 μL/ウェルのPBSで1回洗浄します。
- ピクロシリウスレッド染色のステップ4.2.3で説明したように、染色されたサンプルのカラー画像を取得します。
- 異なる培養終了時点(例えば、共培養の4日目および7日目)において、細胞溶解物中のALP活性を定量化する。
- 培養液を200 μL/ウェルのPBSで3回洗浄した後、200 μL/ウェルの0.25%トリプシン-EDTAを37°Cでインキュベートします。 10分ごとに、消化を促進するために上下に激しくピペッティングして培養物を攪拌し、標準的な細胞培養顕微鏡で培養形態をモニターします。
- ウェル内に細長い細胞構造を持たない液体の単一細胞懸濁液が得られたら(通常20〜30分後)、サンプルを2 mLチューブに移し、トリプシンを抑制するために200 μLのMSC基礎培地を加え、500 x g で5分間遠心分離して、回収した細胞をペレット化します。上清をデカントし、ペレットを-80°Cで凍結するか、ステップ5.2.3に直接進みます。
- ステップ5.2.2で得られた細胞ペレットを解凍し、0.56 M 2-アミノ-2-メチル-1-プロパノール、0.2% Triton X-100、pH 10からなる500 μLの溶解バッファーとともに、氷上で30分間インキュベートします。次に、16,100 x g で4°Cで10分間遠心分離し、サンプルを氷上に保ちます。ステップ5.2.7で説明した測定の後、サンプルを-20°Cまたは-80°Cで凍結するか、ステップ5.2.8で説明したようにDNA定量を直接続行します。
注:溶解バッファーは、事前に調製し、滅菌ろ過し、4°Cで保存することができます。 - 溶解バッファー中で20 mM 4-ニトロフェニルリン酸二ナトリウム塩六水和物と4 mM MgCl2 からなるALP試薬を調製します。
注:定量当日にこの溶液を新鮮に調製するのが最善です。 - ペレット状の破片を乱すことなく、ステップ5.2.3で調製した細胞ライセート上清50 μLを、標準的な透明な組織培養96ウェルプレートのウェルに二重に分注します。溶解バッファーをブランクコントロールとして2つのウェルに加えます。
- マルチチャンネルピペットを使用して、ステップ5.2.5で充填したウェルに50 μL/ウェルのALP試薬を追加します。プレートを短時間振とうし、光から保護しながら37°Cで10分間インキュベートします。ALP活性が高いウェルは黄色で表示されます。マルチチャンネルピペットを使用して1 M NaOHを100 μL/ウェル添加して反応を停止します。
- プレートリーダーを使用して410nmでの光学濃度を読み取ります。技術的な重複を平均し、空白のコントロールの平均を減算します。
- DNA定量を行い、前のステップで決定したALP活性を全細胞数に対して正規化する。ここでは、蛍光測定に基づく方法が記載されているが、細胞ライセート中のDNA定量のための他の任意の方法は、アッセイに適合する。DNA定量に必要な試薬やDNA標準物質は、市販のキットを使用し、メーカーの指示に従って調製してください。
注:DNA標準物質の調製には溶解バッファーを使用することをお勧めします。 - 手順5.2.3で説明したALP定量に使用したサンプルが凍結されている場合は、解凍し、16,100 x g で4°Cで2分間遠心分離し、氷上に置きます。ペレット状の破片を乱すことなく、50 μLの細胞ライセート上清を黒色の96ウェルプレートのウェルに二重に分注します。サンプルを-20°Cまたは-80°Cで凍結し、必要に応じてALPおよびDNA定量を繰り返します。DNA標準を重複して追加します。
- マルチチャンネルピペットで、50 μLのDNA染色剤を添加し、インキュベートして、製造元の指示に従って蛍光強度を読み取ります。検量線値を使用して、測定された強度値のDNA濃度への変換を決定し、適用します。
- ステップ5.2.7で得られたALP値を、各サンプルのそれぞれのDNA濃度で割って正規化します。
6.アプリケーション1:薬剤感受性アッセイの実施
- 内皮ネットワークが完全に発達したら(通常、間質-内皮細胞共培養の4日目に)、ベバシズマブなどの抗血管新生化合物を新鮮な培養培地の培養物に加え、経時的に異なる条件下で(例えば、異なる濃度のFGF-2またはBMP-2)でそれらの活性をテストします。
- それまでそれぞれの培養に用いたのと同じ成長因子を含む新鮮な培養液を調製する。
- 目的化合物の希釈液(例:ベバシズマブの場合:60 mg/mL α-トレハロース二水和物、0.4 mg/mL Tween20、5.8 mg/mLリン酸ナトリウム、一塩基性および一水和物、1.2 mg/mLリン酸ナトリウム二塩基性無水物)からなる対照溶液を調製し、滅菌ろ過します。
- 目的の化合物を所望の濃度(例:10 μg/mLベバシズマブ)で、等量のコントロール溶液を、それぞれ試験条件とコントロール条件に指定された培地に加えます。
- それまでそれぞれの培養に用いたのと同じ成長因子を含む新鮮な培養液を調製する。
- 培養液から培地を吸引し、ステップ6.1.1で調製したばかりの培地200 μL/ウェルを追加します。試験する化合物に適した時間インキュベートします(例:ベバシズマブの場合:2日間)。培養の発達を監視し、セクション3に記載されているように内皮ネットワークを特徴付けます。GFP画像とステップ3.7で説明した分析から抽出された定量的ネットワークパラメータを使用して、血管新生の阻害または事前に形成された構造のアブレーションにおける化合物の有効性を評価します。
7. 応用2:多様ながん細胞との高度な共培養系の構築
- 共培養の4日目に、内皮ネットワークがほとんど確立されたら、MDA-MB-231またはU2OSがん細胞などの他の細胞タイプを新鮮な培地での培養物に追加します。
- 共培養中のGFP標識HUVECおよび非標識hBM-MSCと区別できるようにするために、製造元の指示に従って細胞適合性の生色素を使用して癌細胞を標識します。
- それまでそれぞれの培養に使用していたのと同じ成長因子を含む新鮮な培養液に、1.5 x 104 cells/mLの濃度の癌細胞の懸濁液を調製します。
- 必要に応じて、培養の進展とがん細胞の局在をモニターします。
注:がんの種類、活動、環境によっては、間質-内皮細胞共培養で血管構造に到達するまでに数日かかる場合があります(例:MDA-BM-231およびU2OSの場合は2日)。したがって、がんと血管細胞の相互作用を視覚化するためのタイムラプスイメージングは、それに応じてタイミングを合わせる必要があります。
代表的な結果
血管ニッチ培養は、96ウェルイメージングプレート内に剛性勾配を有するプレキャストPEGベースのヒドロゲル上にhBM-MSCおよびGFP-HUVECを順次播種することによって確立されました(図1)。培養物を生落射蛍光顕微鏡で縦方向にモニターし、選択した時点でさらに特性評価しました。細胞外コンパートメントは、直接カラー染色および抗体ベースの染色によって評価した。ALP活性は、生成されたニッチから細胞を取り出し溶解した後に定量化した。さらに、抗血管新生薬感受性アッセイおよびがん共培養モデルの基礎としてのこのプラットフォームの適合性を実証します。
hBM-MSCとGFP発現HUVECの共培養は、プロトコルに記載されているように、成長因子の非存在下、またはFGF-2またはBMP-2のいずれかの存在下で50 ng/mLで3 x 104 細胞/ウェルを播種することによって確立されました。初期の時点から、GFP-HUVECのみを示す明視野画像と蛍光画像の両方から培養物の違いを観察することができました(図2A)。同じ領域を縦方向に観察することにより、FGF-2の存在下でのより速い発達など、培養の発達の違いに気付くことができました。一般に、培養物は、成長因子が存在しない場合、発達が遅れているように見え、どちらのタイプの細胞も広がりが少なく、無細胞領域が存在するように見えました。対照的に、明視野画像は、BMP-2の存在下で最も密度の高い培養を示した。しかし、成長因子含有条件の両方で血管様ネットワークが形成され、FGF-2で最も広範で相互接続されたネットワークが形成された。これらの観察された違いは、ImageJの 血管新生分析装置 を使用して定量化することもできます。実際、総ネットワーク長はFGF-2の存在下で最も高く、成長因子がない場合で最も低かった(図2B)。ネットワーク内の分岐点を示すジャンクションの数は、全長と同じ傾向をたどりました(図2C)。逆に、両方の成長因子含有条件は、成長因子を含まない条件よりも有意に少ない孤立セグメントを示し、より高い相互接続性を示しました(図2D)。さらに、3D共焦点イメージングにより、FGF-2刺激条件では深さの点で内皮細胞の浸透が強いことが明らかになりました(図2E)。
hBM-MSC/GFP-HUVEC 共培養を FGF-2 または BMP-2 存在下で 7 日間維持した後、固定し、ECM 成分を染色しました。免疫細胞化学染色とそれに続く共焦点レーザー走査型顕微鏡法は、成長因子補給の種類によって培養形態に顕著な違いを示しました(図3A)。FGF-2では、培養は内皮細胞と間葉系細胞の両方で高密度の凝縮微小血管様構造に組織化されましたが、BMP-2の存在下では、hBM-MSCははるかに広い領域にまたがっていました。ECMタンパク質のフィブロネクチンとコラーゲンIは同様の方法で局在していましたが、ラミニンとコラーゲンIVは内皮構造の周りにより集中していました。しかしながら、内皮構造周囲のこの増加した濃度は、BMP-2の存在下よりもFGF-2の存在下ではるかに顕著であった。抗体ベースの染色に加えて、ECMの全体的な線維化状態を評価するために直接カラー染色を実施しました(ピクロシリウスレッド染色; 図3B)、ならびにECM上へのCaの沈着(アリザリンレッド染色; 図3C)形成されたニッチの。ピクロシリウスレッド染色は、BMP-2で培養したニッチでより強く、より広範囲であり、アリザリンレッド染色も同じ傾向に従いました。
次に、培養物を、初期の骨形成マーカーとしてのALP活性を評価することにより、骨形成能の観点から特徴付けました。共培養の4日目と7日目に、ヒドロゲルをトリプシンで消化することによって細胞をニッチから回収しました。ALP活性を定量するために、回収した細胞を溶解し、pNPPアッセイを実施した。得られた値は、条件間の細胞数の潜在的な違いを説明するために、各サンプルの総DNAに対して正規化されました。実際、条件のDNA含量の間にわずかな差が観察され、成長因子を含まない条件から最も少ない細胞が回収された(図示せず)。しかし、正規化されたALP活性は条件によって大きく異なり、BMP-2の濃度が高いほど活性が上昇し、100 ng/mLでプラトーになる傾向がありました(図4A、B)。最も低い活性レベルは、50 ng/mLのFGF-2を含む状態で特定されました。評価された両方の時点で同様の傾向が観察されましたが、すべての値は、4日目から7日目までの培養で時間とともに有意に増加しました。定量的アッセイに加えて、BCIP/NBT基質変換に基づく直接色染色を用いてALP活性を定性的に可視化することができた。FGF-2と比較して、BMP-2の存在下でより広範囲でより強い紫色染色が観察された(図4C)。
特徴付けられた骨形成ニッチの2つの潜在的な用途を実証するために、概念実証薬物感受性研究と癌共培養が実施されました。薬物感受性アッセイのために、ベバシズマブまたはベバシズマブ製剤の希釈液からなる対照溶液を、新鮮なBMP-2を含む培養液に添加した。4日目に、50 ng/mL BMP-2の存在下で確立されたネットワークが形成されたとき、通常の培地交換中にコントロール溶液またはベバシズマブ含有培地のいずれかを添加し、蛍光イメージングを使用して培養をモニターしました。10 μg/mLのベバシズマブの添加は、以前に形成されたネットワークの収縮またはアブレーションをもたらしましたが、対照条件は培地交換の2日後に依然として広範なネットワークを特徴としていました(図5A、B)。これらの変化は、毎日取得される蛍光画像上でImageJの 血管新生分析装置 を使用してネットワークの全長を追跡することによっても定量化できました(図5C)。あるいは、ベバシズマブまたは他の化合物を共培養の最初から添加して、ネットワークの形成に対するそれらの影響を評価することもできます。ベバシズマブの場合、これは内皮ネットワークの形成を完全に阻害した(図示せず)。
2番目のアプリケーションでは、MDA-MB-231乳がんまたはU2OS骨肉腫細胞を、50 ng/mL BMP-2を含む新鮮な培養培地中で1.5 x 103 細胞/ウェルの密度で4日目の共培養に加えました。GFP標識されたHUVECおよび非標識hBM-MSCと区別するために、癌細胞を骨形成ニッチに播種する直前にCellTrace FarRedでインキュベートしました。培養物を蛍光顕微鏡でモニターした。当初、ほとんどの癌細胞は基質の表面近くに局在していましたが、2日後には、血管共培養を含む層の近くに見つけることができました。したがって、2日目をタイムラプス顕微鏡検査の開始点として選択し、癌細胞と血管ニッチ内の細胞との間の相互作用のダイナミクスを示しました。興味深いことに、MDA-MB-231細胞は内皮構造に近づいたり遠ざかったりしているのを見ることができ、したがって、それらの環境をプローブまたはリモデリングしている可能性があります(図5D)。CellTrace FarRedをがん細胞の標識として、GFPをHUVECの標識として、およびF-アクチンの追加染色を使用して、共焦点レーザー走査型顕微鏡を使用してすべての細胞型を区別することができました(図5E)。
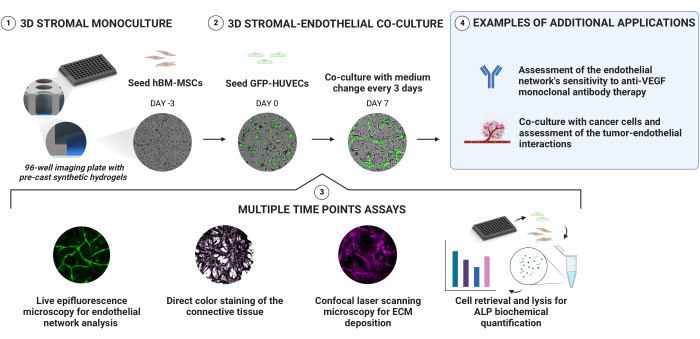
図1:血管新生、骨形成ニッチの信頼性の高い生成のための簡単なアプローチ。 詳細な剛性勾配を備えたプレキャスト合成ヒドロゲルにより、直接カプセル化を必要とせずに、シーケンシャルセルシーディングを介して3D培養物を生成できます。hBM-MSCは、GFP発現HUVECを添加する前に3日間前培養されます。培養物は、明視野およびGFPシグナルを縦方向に取得することによって監視されます。選択された時点で、ニッチはそれらのECM沈着および骨形成状態についてさらに評価される。アルカリホスファターゼ活性は、直接カラー染色、ニッチから細胞を回収し、細胞溶解物に対してpNPPアッセイを行うことによって評価されます。 この図の拡大版を表示するには、ここをクリックしてください。
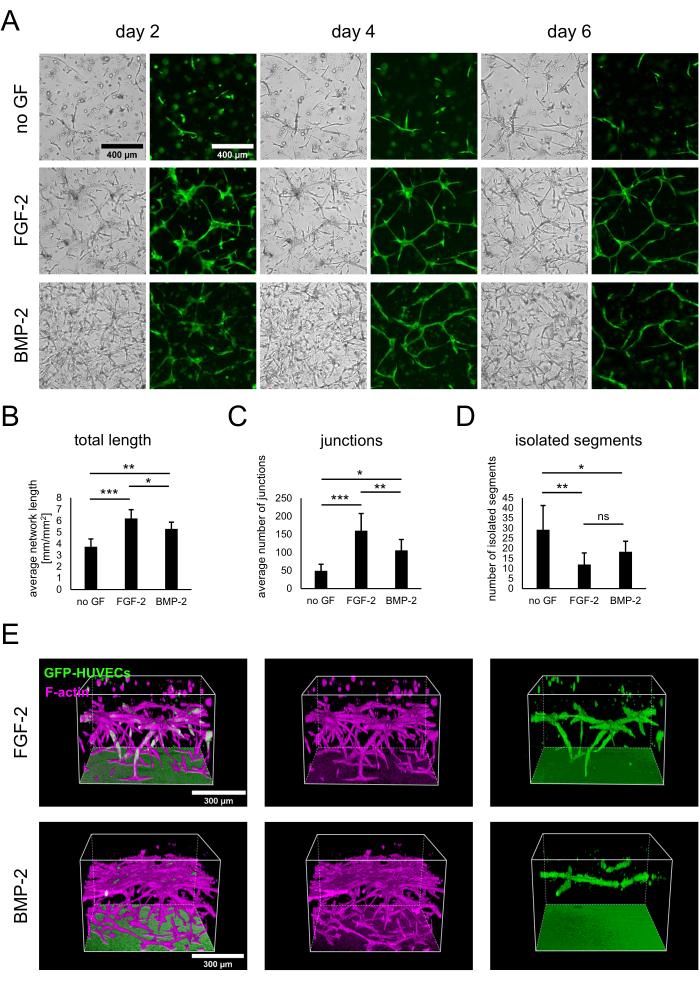
図2:FGF-2またはBMP-2による血管様ネットワークの刺激。 (A)明視野および蛍光(GFP)画像は、成長因子非存在下またはFGF-2またはBMP-2の存在下で増殖した細胞の共培養の2日目、4日目、および6日目に、いずれも50 ng/mLで取得されました。スケールバー:400 μm。 (B-D)共培養4日目に画像化されたGFP-HUVECネットワークの定量化されたパラメータを、ImageJ用血管新生分析装置を用いて分析した。データは平均±標準偏差として表されます。統計解析はGraphPad Prism 9.5.1を用いて行った。ダネットの多重比較検定による通常の一元配置分散分析は、n≥4で実行されました。* P < 0.05;** P < 0.01;P < 0.001(E)FGF-2-(上段)およびBMP-2-(下段)のGFPおよびF-アクチンシグナルの共焦点スタック(全高:547.5 μm、zステップ:2.5 μm)から生成された3次元再構成。スケールバー:300 μm。 この図の拡大版を表示するには、ここをクリックしてください。
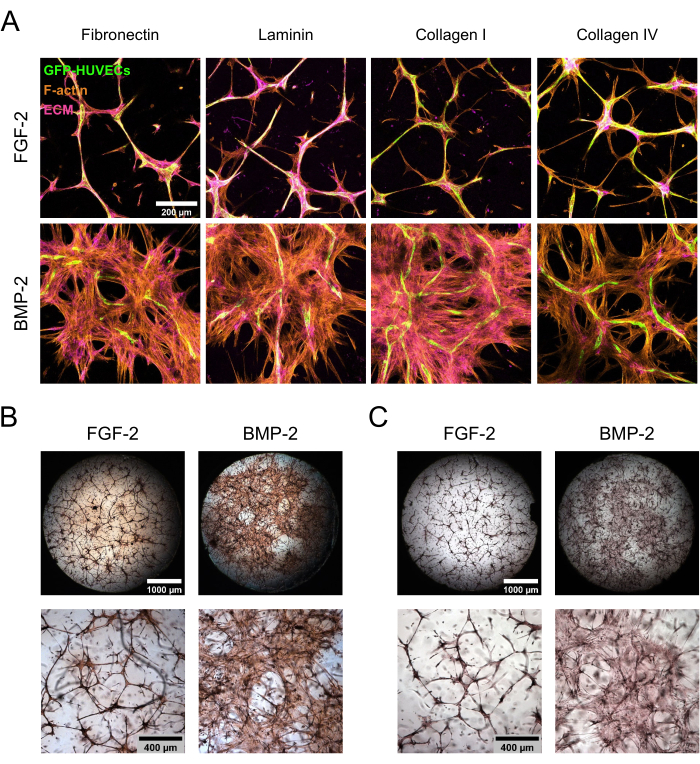
図3:BMP-2による非局在hBM-MSC拡散およびECM沈着の誘導。 (A-C)FGF-2またはBMP-2のいずれかの存在下で増殖させた7日間の共培養物を、(A)免疫蛍光法または(B、C)直接色染色に供した。(A)培養物をF-アクチンおよびECMタンパク質フィブロネクチン、ラミニン、コラーゲンI、およびコラーゲンIVについて染色した。画像は、共焦点スタックの最大強度投影を示しています(全高:100 μm、zステップ:5 μm)。スケールバー:200μm。 (B、C)培養物を、(B)ピクロシリウスレッドおよび(C)アリザリンレッドを用いて染色した。上段は、2.5倍の倍率(スケールバー:1,000 μm)で取得した画像のウェル全体の概観をステッチして示し、下段は5倍の倍率(スケールバー:400 μm)で取得した1つの視野を示しています。この図の拡大版を表示するには、ここをクリックしてください。
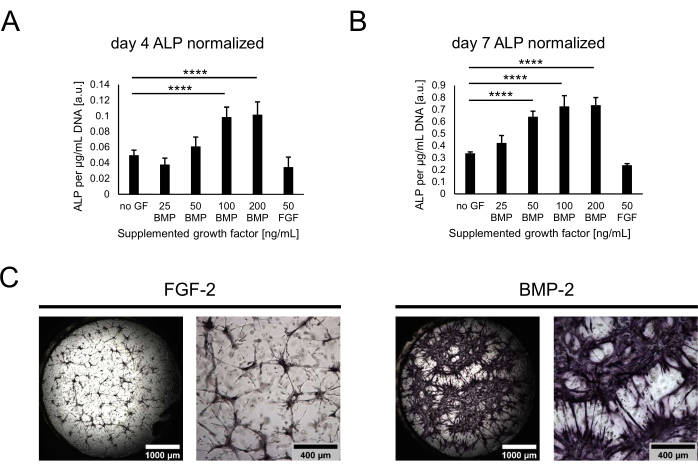
図4:直接色染色によるBMP-2誘導性ALP活性の生化学的評価。 (A,B)ALP活性は、成長因子の非存在下または異なる濃度のBMP-2またはFGF-2の存在下で(A)4日間、または(B)50 ng/mLで増殖させた培養物の細胞ライセートで測定されました。)7日間の共培養。ALP活性を、各ライセートサンプルのDNA含量に対して標準化して示す。データは平均±標準偏差として表されます。統計解析はGraphPad Prism 9.5.1を用いて行った。ダネットの多重比較検定による通常の一元配置分散分析は、n = 5で実行されました。P < 0.0001 です。(C)50 ng/mL FGF-2またはBMP-2の存在下で7日間の共培養で増殖させたニッチにおけるALP活性の直接色染色。左側の画像は、2.5倍の倍率(スケールバー:1,000 μm)で取得した画像のウェル全体のオーバービューをステッチして示し、右側の画像は、5倍の倍率(スケールバー:400 μm)で取得した1つの視野を示しています。この図の拡大版を表示するには、ここをクリックしてください。
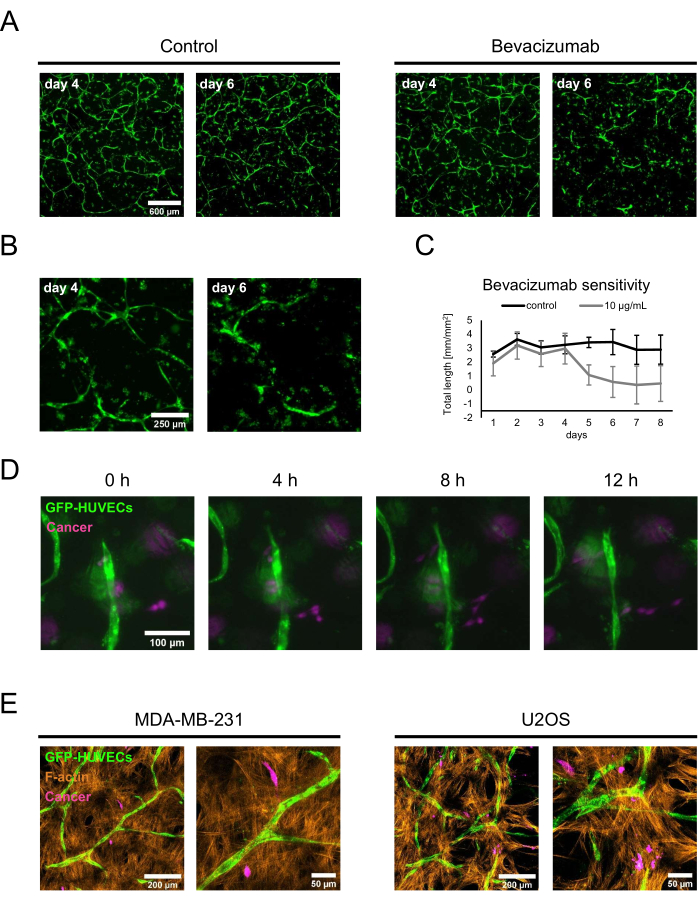
図5:進行がんモデルにおける骨形成性血管新生ニッチの採用。 (A)BMP-2存在下で増殖させた培養物のGFPシグナルを共培養4日目に画像化し、対照溶液(左)または10 μg/mLのベバシズマブ(右)を2日間添加した後、培養物を再び画像化しました(共培養6日目)。スケールバー:600 μm。 (B)ベバシズマブ処理培養物の高倍率画像を Aに示す。スケールバー:250 μm。 (C) Aに示す内皮ネットワークの全長を、毎日取得された画像からImageJの 血管新生分析装置 を使用して定量化しました。n ≥ 3.(D)CellTrace FarRed標識MDA-MB-231乳癌細胞をBMP-2存在下で増殖させた4日間の共培養に添加し、癌細胞添加後2日目からタイムラプス画像を取得しました。スケールバー:100 μm。 (E) D に記載されているように生成され、F-アクチンについて固定および染色されたトリプル共培養の共焦点スタック(全高:70 μm、zステップ:2.4 μm)の最大強度突起。左:MDA-MB-231乳がん細胞を特徴とするニッチ。右:U2OS骨肉腫細胞を特徴とするニッチ。左側の画像のスケールバー:200 μm;右の画像のスケールバー:50 μm。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここでは、骨および骨髄生物学研究、組織工学、および癌研究においてさまざまな用途を有する、完全に合成および制御可能な3D PEGベースのマトリックスにおける高度に血管新生された骨および骨髄ニッチの in vitro モデルを確立するためのプロトコルについて説明します。このモデルは、RGDペプチドおよびMMP切断部位で官能化され、ガラス底96ウェルイメージングプレート30上に詳細な密度勾配でキャストされる合成PEGベースのヒドロゲル上に構築される。このプラグアンドプレイプラットフォームは、細胞をヒドロゲルにカプセル化することなく、高度に相互接続された3Dセルラーネットワークの確立を可能にすることが示されました。先に説明した細胞カプセル化プロトコルと同様に、この研究では、細胞型特異的微小環境を作り出すための細胞固有のECM28 による基質のリモデリングを示す。したがって、この方法では、再現性の高い有機型3D培養条件下で、薬物スクリーニングアッセイおよびハイコンテント分析を容易に実施することができる。ガラス底の96ウェルプレートと光学的に透明なヒドロゲルにより、このプラットフォームはリキッドハンドリングオートメーションとハイスループット顕微鏡と互換性があります。
骨形成性血管骨髄ニッチを生成する最初のステップは、少なくとも3日間のPEGヒドロゲル上でのhBM-MSCの前培養です。この間、それらはヒドロゲルに付着し、それを貫通し、そして細胞間接触およびECM沈着を確立し始める。hBM-MSCをシードする前に、ストレージバッファーを除去する必要があります。ヒドロゲルは96ウェルイメージングプレートの標準ウェル内のインナーウェル内にあるため、インナーウェルリングに触れるまでウェルの側面に沿って吸引チップを挿入しても安全です。真空ポンプは、吸引力をできるだけ低く設定すれば吸引に使用できます。あるいは、ノズルの高さを内側のウェルリングから少なくとも0.8mm上に調整した自動プレートウォッシャーを使用して、ヒドロゲルプレートからバッファーを吸引することができます。液体処理に自動化を使用すると、ヒドロゲル表面への損傷を最小限に抑え、結果として得られる培養物の再現性を高めることができます。細胞がヒドロゲル上に沈降すると、ヒドロゲル表面の小さな欠陥が見えるようになり、欠陥のあるヒドロゲル領域の下部焦点面に現れる。したがって、0日目に参照画像を取得することは、細胞播種の均一性およびヒドロゲル表面完全性のための良好な品質管理として役立つ。小さなヒドロゲル表面の欠陥はウェルのさらなる使用を妨げるものではないが、細胞は欠陥領域にクラスター化する傾向があり、非代表的なパターンに成長するか、またはより迅速に底部ガラスに到達し、そこで単層に成長する可能性がある。これらのアーティファクトは、これらの井戸を使用/評価する際に注意する必要があります。同様の考慮事項は、アッセイの全期間中に実施される培地の変更にも適用されます。
プロトコルの第2ステップでは、予め形成されたhBM-MSC単培養(共培養の0日目)にGFP-HUVECを添加する。hBM-MSCによって寄託されたECMは、内皮細胞の増殖のための大きな足場を提供し、この研究では、hBM-MSC馴化培地の存在下でも、ヒドロゲル上に丸い細胞クラスターを形成することしかできませんでした(図示せず)。hBM-MSC培養物に播種すると、HUVECは統合され、細胞カプセル化によって生成された共培養で観察されたものに匹敵する微小血管様構造を形成します27,28。通常、よく発達した3D微小血管様ネットワークは共培養から4日以内に形成され、これはGFP標識HUVECを使用して縦断的に監視できます。これらの構造は、培養中に少なくとも7日間維持することができ、抗血管新生薬のスクリーニングなどの治療に応答して血管網組織の変化を追跡するのに十分な時間があることを意味する。内皮ネットワークの形態学的要素は、ImageJ33の血管新生分析プラグインなどの確立されたツールを使用してGFP画像をセグメント化することにより、バッチモードで定量化することができ、それらのパラメータを使用して、例えば、薬効および薬力学を評価することができる。
多くの潜在的な用途のための記載された細胞モデルの1つの重要な利点は、その可塑性である。培地に異なる成長因子を補充するだけで、共培養の外観を変えることができます。例えば、単培養および共培養期間を通してBMP-2が存在すると、骨形成血管ニッチが生成し、ALP活性の増加、細胞外カルシウム沈着、ならびにECMアセンブリおよび沈着を示す。それどころか、FGF-2の存在下では、骨形成マーカーは存在せず、共培養はより少ない側方細胞会合を形成するが、より顕著な3D細胞増殖を示す。FGF-2がALP活性を抑制し、BMP-2が成長因子処理なしと比較してより強いALP活性を誘発するという事実は、以前の観察と一致しています27。しかし、hBM-MSC間質成分のこれらの大きな違いにもかかわらず、微小血管網の範囲は、この研究における2つの成長因子処理条件において非常に類似していた。対照培養では、ほんの少しの短い血管網しか形成されず、おそらく血管新生が不十分な骨髄ニッチを表しています。これは、培地に添加する成長因子の種類、濃度、およびタイミングを変更するだけで、比較研究に必要な、明確に定義された血管化骨髄ニッチの範囲を製造できることを示唆しています。ただし、再現性のある結果を得るには、培養の進行と形態が使用する細胞の履歴(たとえば、日常の培養メンテナンス中に使用される継代数や剥離方法)によって異なる場合があり、アッセイ設計中にそのような要因を制御することをお勧めします。
ここでは、このモデルの最初のアプリケーションとして、10 μg/mLのベバシズマブによる治療に対する操作された微小血管ネットワークの感度を示します。特に、ネットワークが発達していない画像ではアーチファクトが生成されることが多いため、使用するアルゴリズムが内皮ネットワークを正確に認識できることを確認することが重要です。この場合、画像処理に使用されるパラメータ(セグメンテーション前とセグメンテーション中)は、多くの場合試行錯誤しながら微調整する必要があります。
第2の応用として、間葉系細胞、内皮細胞、がん細胞の逐次播種によって形成される高度な共培養モデルを紹介します。このモデルは、転移中の重要な要因である可能性のある癌細胞、間質、および骨髄の血管系の間の相互作用を研究することを可能にします。さらに、このモデルは、薬物スクリーニングアプリケーションや、血管新生以外の標的を持つ化合物の試験に使用できます。
2D培養では、細胞は生理学的微小環境シグナルを受け取らず、天然に存在する細胞形態を獲得せず、その結果、ネイティブ3D環境の細胞とは異なる方法で分化します35。操作された3Dヒドロゲルで増殖させると、細胞は早い段階で固有のECMを沈着させ、接着部位を提供し、積極的に改造することができます28,36。ここでは、スクリーニングアプリケーション用の簡略化された3Dモデルを確立するために、血管形成細胞を操作されたヒドロゲルの表面に播種し、灌流のない状態で血管ネットワークを確立させました。画像ベースの評価は、血管構造に寄与する内皮細胞の2D投影について実施されました。しかし、共焦点画像のみが、FGF-2刺激サンプルと比較して、BMP-2刺激サンプルにおける3D血管網の目立たない内部成長を明らかにした。これは、形成された血管構造の長さが過小評価されていたが、それらの接続性が過大評価されていたことを示唆している。さらに、血管周囲細胞と内皮細胞の間の相互作用と血管内腔形成は調査されていません。これらの側面は、特に薬物治療反応の観点から、さらなる注意を必要とするでしょう。最後に、最初に広範な3D血管ネットワークを確立し、次にそれらの骨形成分化を誘導するための洗練されたプロトコルは、より生理学的な骨および骨髄モデルを生成するために望ましいでしょう。
全体として、ここに示すモデルは非常に用途が広く、特定のアプリケーションに合わせて簡単に調整できます。例えば、異なる供給源からの間葉系細胞および内皮細胞を使用することができる。脂肪組織MSCおよび臍帯MSCは、BM-MSCと比較して異なる血管新生因子を発現することが知られており、代替間質成分として容易に置換することができる37。すでに定義された骨髄ニッチから単離された内皮細胞も、HUVECの代わりに使用することができる。また、血管新生筋共培養で最近提案されているように、個別化医療アプリケーションのために、患者由来の一致する骨髄間葉系細胞と内皮細胞との共培養を確立することもできます38。さらに、ヒドロゲルプレートの設計により、明視野顕微鏡と蛍光顕微鏡の両方で培養を縦方向に監視できるため、用途に応じて培養時間を短縮または延長することができます。あるいは、播種に使用される細胞密度を適宜調整して、このプロトコルよりも短いまたは長い観察時間が必要な場合に、細胞ネットワークの形成を加速または遅延させることができます。いずれにせよ、ヒドロゲルの収縮および最終的な細胞剥離につながる可能性があるシート状構造への細胞の過剰増殖を避けるために注意が必要である。
最後に、このモデルを使用して幅広いアッセイを実行できます。生培養または固定培養で実施される免疫蛍光および顕微鏡検査に加えて、3D培養物を酵素的に消化することができ、細胞を回収して任意のタイプの生化学的アッセイに供することができる。ここでは、比色/蛍光アッセイを使用して細胞ライセート中のALP活性の測定とDNA含有量の定量を示しますが、このシステムはPCR、RNAseq、プロテオミクスなど、他の多くの技術と互換性があります。目的のアッセイの感度がそれほど高くない場合は、複数のウェルからのサンプルをプールして、アッセイに利用可能なサンプルの量を増やすことができます。所望の用途がより速いゲル溶解を必要とする場合、プレート上のすべてのウェルがこのように使用されると仮定して、プレートの軌道振とうを少量の消化溶液と組み合わせて適用し、ウェル内の渦形成を確実にすることができる(生きている培養はそのような過酷な取り扱いに敏感である)。要約すると、ここでは、説明どおりに使用された場合、骨形成血管ニッチの重要な側面を要約する in vitro モデルの生成を保証するだけでなく、オーダーメイドのアプリケーション用に変更するのに十分な汎用性を備えたプロトコルを紹介します。
開示事項
エクティカ・テクノロジーズAGは、3DProSeedヒドロゲルウェルプレートのメーカーであり、商業的利益を有しています。Benjamin R. SimonaとMartin EhrbarはEctica Technologies AGの株主です。
謝辞
著者らは、リキッドハンドリングデバイスの技術支援を提供してくれたRiccardo Urbanetと、落射蛍光顕微鏡法のサポートを提供してくれたRodi Odabasiに感謝したいと思います。この研究は、スイス国立科学財団(助成金番号310030E_202429および205321_204318)とEctica Technologies AGによって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | 25200-072 | |
| 2 mL microtubes | Eppendorf | 30120094 | |
| 2-Amino-2-methyl-1-propanol | Sigma | A9199 | |
| 3DProSeed hydrogel well plate | Ectica Technologies | ECT.PS1.001.096 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate | Sigma | 71768 | |
| Alizarin Red S | Sigma | A5533 | |
| Anti-Collagen IV antibody | Abcam | ab6311 | |
| Anti-Laminin 1+2 antibody | Abcam | ab7463 | |
| Automated plate washer | Agilent Biotek | ELχ50 | |
| Automated washer/dispenser | Agilent Biotek | MULTIFLO FX equipped with a peristaltic pump 5uL cassette | |
| Bevacizumab | Evidentic | ID PS-E07-2019-00119 A009 | |
| BMP-2 | Peprotech | 120-02C | |
| BSA | AppliChem | A1391 | |
| Centrifuge | Eppendorf | 5415 R | To centrifuge 2 mL tubes at 16100 x g during ALP analysis |
| Confocal laser scanning microscope | Leica | Stellaris 5 | |
| Conical 50 mL centrifuge tubes | TPP | 91050 | |
| DAPI | Sigma | D9542 | |
| DyLight 649 Donkey anti-rabbit IgG (minimal x-reactivity) Antibody | Biolegend | 406406 | |
| DyLight 649 Goat anti-mouse IgG (minimal x-reactivity) Antibody | Biolegend | 405312 | |
| EGM-2 | Lonza | CC-3162 | |
| Epifluorescence microscope | Leica | DMI6000B | |
| FBS | Gibco | 10500-064 | |
| FGF-2 | Peprotech | 100-18B | |
| Fibronectin (IST-9) | Santa Cruz | sc-59826 | |
| GFP-HUVECs | PELOBiotech | PB-CAP-0001GFP | |
| hBM-MSCs | - | - | Isolated at University Hospital Basel; Papadimitropoulos A, Piccinini E, Brachat S, et al. Expansion of human mesenchymal stromal cells from fresh bone marrow in a 3D scaffold-based system under direct perfusion. PLoS One. 2014;9(7):e102359 |
| Inverted microscope | Zeiss | 200M | |
| Magnesium chloride | Sigma | M8266 | |
| MDA-MB-231 breast cancer cell line | - | Kindly obtained from J Massagué at the Memorial Sloan-Kettering Cancer Center | |
| MEMα | Gibco | 22571-038 | |
| Multimode imaging reader | Agilent Biotek | Cytation 1 | For automated imaging |
| Multimode imaging reader - fluorescence and absorbance | Agilent Biotek | Cytation 5 | For measuring absorbance and fluorescence intensity duing ALP analysis |
| Paraformaldehyde | Artechemis | US 040 | |
| PBS | Gibco | 10010-015 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Phalloidin-rhodamine | Invitrogen | R415 | |
| Picro-Sirius Red Solution | Abcam | ab246832 | |
| Quant-iT PicoGreen dsDNA Assay kit | ThermoFisher Scientific | P7589 | |
| Recombinant Anti-Collagen I antibody | Abcam | ab260043 | |
| SIGMAFAST BCIP/NBT | Sigma | B5655-25TAB | |
| Sodium hydroxide | Sigma | 1064981000 | |
| Sodium phosphate dibasic, anhydrous | Sigma | S-0876 | |
| Sodium phosphate monobasic, monohydrate | Merck | 1.06346 | |
| Triton X-100 | Sigma | T8787 | |
| Tween20 | AppliChem | A4974 | |
| U2OS osteosarcoma cell line | - | Kindly obtained from J Snedeker at the Institute for Biomechanics, Zurich | |
| α-trehalose dihydrate | Sigma | 90208 |
参考文献
- Mendez-Ferrer, S., et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466 (7308), 829-834 (2010).
- Calvi, L. M., Link, D. C. Cellular complexity of the bone marrow hematopoietic stem cell niche. Calcified Tissue International. 94 (1), 112-124 (2014).
- Behrmann, L., Wellbrock, J., Fiedler, W. Acute myeloid leukemia and the bone marrow niche-take a closer look. Frontiers in Oncology. 8, 444 (2018).
- Yip, R. K. H., et al. Mammary tumour cells remodel the bone marrow vascular microenvironment to support metastasis. Nature Communications. 12 (1), 6920 (2021).
- Potente, M., Makinen, T. Vascular heterogeneity and specialization in development and disease. Nature Reviews Molecular Cell Biology. 18 (8), 477-494 (2017).
- Augustin, H. G., Koh, G. Y. Organotypic vasculature: From descriptive heterogeneity to functional pathophysiology. Science. 357 (6353), (2017).
- Kusumbe, A. P., Ramasamy, S. K., Adams, R. H. Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone. Nature. 507 (7492), 323-328 (2014).
- Barillari, G. The anti-angiogenic effects of anti-human immunodeficiency virus drugs. Frontiers in Oncology. 10, 806 (2020).
- Owen, M., Friedenstein, A. J. Stromal stem-cells - Marrow-derived osteogenic precursors. Ciba Foundation Symposia. 136, 42-60 (1988).
- Sacchetti, B., et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell. 131 (2), 324-336 (2007).
- Traore, M. A., George, S. C. Tissue engineering the vascular tree. Tissue Engineering. Part B, Reviews. 23 (6), 505-514 (2017).
- Bessy, T., Itkin, T., Passaro, D. Bioengineering the bone marrow vascular niche. Frontiers in Cell and Developmental Biology. 9, 645496 (2021).
- Bray, L. J., et al. A three-dimensional ex vivo tri-culture model mimics cell-cell interactions between acute myeloid leukemia and the vascular niche. Haematologica. 102 (7), 1215-1226 (2017).
- Montano, I., et al. Formation of human capillaries in vitro: The engineering of prevascularized matrices. Tissue Engineering Part A. 16 (1), 269-282 (2010).
- Sun, Z. Y., Kemp, S. S., Lin, P. K., Aguera, K. N., Davis, G. E. Endothelial k-RasV12 expression induces capillary deficiency attributable to marked tube network expansion coupled to reduced pericytes and basement membranes. Arteriosclerosis Thrombosis and Vascular Biology. 42 (2), 205-222 (2022).
- Kleinman, H. K., et al. Basement-membrane complexes with biological-activity. Biochemistry. 25 (2), 312-318 (1986).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement-membrane in the morphological-differentiation of human-endothelial cells into capillary-like structures. Journal of Cell Biology. 107 (4), 1589-1598 (1988).
- Davis, G. E., et al. Control of vascular tube morphogenesis and maturation in 3D extracellular matrices by endothelial cells and pericytes. Methods in Molecular Biology. 1066, 17-28 (2013).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
- Bersini, S., et al. A microfluidic 3D in vitro model for specificity of breast cancer metastasis to bone. Biomaterials. 35 (8), 2454-2461 (2014).
- Wang, X. L., et al. Engineering anastomosis between living capillary networks and endothelial cell-lined microfluidic channels. Lab on a Chip. 16 (2), 282-290 (2016).
- Phan, D. T. T., et al. A vascularized and perfused organ-on-a-chip platform for large-scale drug screening applications. Lab Chip. 17 (3), 511-520 (2017).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nature Biotechnology. 23 (1), 47-55 (2005).
- Kyburz, K. A., Anseth, K. S. Synthetic mimics of the extracellular matrix: How simple is complex enough. Annals of Biomedical Engineering. 43 (3), 489-500 (2015).
- Ehrbar, M., et al. Enzymatic formation of modular cell-instructive fibrin analogs for tissue engineering. Biomaterials. 28 (26), 3856-3866 (2007).
- Ehrbar, M., et al. Biomolecular hydrogels formed and degraded via site-specific enzymatic reactions. Biomacromolecules. 8 (10), 3000-3007 (2007).
- Blache, U., et al. Dual role of mesenchymal stem cells allows for microvascularized bone tissue-like environments in PEG hydrogels. Advanced Healthcare Materials. 5 (4), 489-498 (2016).
- Blache, U., et al. Notch-inducing hydrogels reveal a perivascular switch of mesenchymal stem cell fate. Embo Reports. 19 (8), e45964 (2018).
- Simona, B. R., et al. Density gradients at hydrogel interfaces for enhanced cell penetration. Biomaterials Science. 3 (4), 586-591 (2015).
- Zhang, N., et al. Soft hydrogels featuring in-depth surface density gradients for the simple establishment of 3d tissue models for screening applications. SLAS Discovery. 22 (5), 635-644 (2017).
- Martin, I., Muraglia, A., Campanile, G., Cancedda, R., Quarto, R. Fibroblast growth factor-2 supports ex vivo expansion and maintenance of osteogenic precursors from human bone marrow. Endocrinology. 138 (10), 4456-4462 (1997).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Carpentier, G., Martinelli, M., Courty, J., Cascone, I. Angiogenesis Analyzer for ImageJ. 4th ImageJ User and Developer Conference. , 198-201 (2012).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Yamada, K. M., Cukierman, E. Modeling tissue morphogenesis and cancer in 3D. Cell. 130 (4), 601-610 (2007).
- Loebel, C., Mauck, R. L., Burdick, J. A. Local nascent protein deposition and remodelling guide mesenchymal stromal cell mechanosensing and fate in three-dimensional hydrogels. Nature Materials. 18 (8), 883-891 (2019).
- Curtis, M. B., Kelly, N., Hughes, C. C. W., George, S. C. Organotypic stromal cells impact endothelial cell transcriptome in 3D microvessel networks. Scientific Reports. 12 (1), 20434 (2022).
- Wust, R., Terrie, L., Muntefering, T., Ruck, T., Thorrez, L. Efficient co-isolation of microvascular endothelial cells and satellite cell-derived myoblasts from human skeletal muscle. Frontiers in Bioengineering and Biotechnology. 10, 964705 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved