硬質または軟質基板上に垂直に配向したカーボンナノファイバーアレイを使用して、生体分子および色素を植物に送達
要約
ここでは、垂直に配向したカーボンナノファイバー(VACNF)を微細加工し、VACNFをフレキシブル基板に転写し、硬質および軟質基板上のVACNFを植物に塗布して生体分子と色素を送達する方法について説明します。
要約
生体分子や不浸透性色素を無傷の植物に送達することは、大きな課題です。ナノマテリアルは、DNAを植物に送達するための新進気鋭のツールです。これらの新しいツールはエキサイティングですが、まだ広く適用されていません。硬質基板(バッキング)上に作製されたナノ材料は、湾曲した植物構造にうまく適用することが特に困難です。本研究では、垂直に配向したカーボンナノファイバーアレイを微細加工し、硬質基板から軟質基板に転写するプロセスについて述べる。これらの繊維(硬質または軟質基質上)を、植物への一過性形質転換または色素(フルオレセインなど)の送達にどのように使用できるかを詳述し、実証します。VACNFを硬質シリコン基板からフレキシブルSU-8エポキシ基板に転写して、フレキシブルVACNFアレイを形成する方法を示します。SU-8の疎水性を克服するために、可撓性フィルム中の繊維を薄い酸化ケイ素層(2〜3nm)でコーティングした。これらの繊維を湾曲した植物器官に送達するために、VACNFフィルムの繊維側に1μLの色素またはDNA溶液の液滴を付着させ、10分間待ってから、フィルムを植物器官に置き、転がる動きのある綿棒を使用して繊維を植物細胞に打ち込みます。この手法により、曲面を有する植物器官への色素・DNA送達を実現しました。
概要
植物の形質転換(一過性および安定的の両方)は、すべての植物組織および種において、まだ広く達成可能にはなっていない。植物の一過性形質転換とは、プラスミドにコードされた遺伝子が一時的に植物に導入されるが、ゲノムに安定的に取り込まれないプロセスです。プロトプラストの粒子衝撃、アグロバクテリア、エレクトロポレーション、またはポリエチレングリコール処理を使用する従来の方法は、時間がかかり、面倒な場合があります。さらに、それらはすべての植物種に適用できるわけではありません1,2,3,4。DNA送達のためのナノマテリアルの使用は、まだ初期段階にある急成長中の分野です5。ナノ材料、特にカーボンナノファイバーは、創傷反応を引き起こすことなく、タンパク質、デキストラン、染料を植物の葉に送達するためにも成功しています6。この研究の目標は、ナノ材料の一種であるカーボンナノファイバーを使用して、生体分子または色素を植物に送達するための詳細なプロトコルを提供することです。ここでは、さまざまな植物器官における細胞の一過性形質転換を可能にする生体分子としてDNAに着目します。
以前、Morganらは、硬質シリコン基板にカーボンナノファイバーを貼り付けて、レタス、N. benthamiana、ポプラの葉、およびシロイヌナズナの葉と根の両方を一過性に変化させることを実証しました。形質転換はさまざまな器官で成功しましたが、根や果実などの曲面を持つ植物組織に繊維を適用することはより困難でした。私たちは、ナノファイバーの柔軟な裏打ちが、臓器の形状によりよく適合することで、ナノファイバーの送達効率を向上させる可能性があると推論しました。
本稿では、垂直に配向したカーボンナノファイバーの作製と設計、VACNFのフレキシブル基板への転写、硬質基板と軟質基板の両方にVACNFを植物に塗布して生体分子と色素を送達する方法について詳述する。炭素ナノファイバーは、Ni触媒を用いた直流触媒プラズマ化学気相成長法(dc C-PECVD)を用いて作製した。Ni触媒ドットの位置、直径、高さは、Melechkoらによって記述されているように、電子ビームリソグラフィー、金属蒸着、およびリフトオフプロセスの組み合わせを使用して制御されました8,9。2層電子ビームレジストを用いることで、より厚いNi触媒を基板上に堆積させ、より長い繊維10を得ることができる。硬質基板からフレキシブル基板への繊維転写は、Fletcherら11に記載の方法の修正に基づいており、現在の方法は、非晶質炭素層または犠牲フォトレジスト層の使用を控えている。繊維転写によるSU-8のリフトオフは、SU-812,13,14のアンダーベークと露出不足から生じる固有の引張応力を利用することによって達成されます。複合ポリマーであるSU-8は、自然に疎水性であるため、DNA送達を促進するための使用は困難です。SU-8の疎水性を打ち消すために、SU-8に繊維を埋め込んだ後、原子層堆積15を介して酸化ケイ素の薄層を塗布します。生体分子/色素送達のための硬質基板上の繊維の適用は、Davern et al.6 で説明されているピンセットタッピングの衝撃力と、Morgan et al.7 で説明されているオンプラントおよびオンチップ法を利用します。柔軟なVACNFフィルムは、Morganらのオンチップ法7と同様に、まずフィルム上のDNAまたは色素の液滴を半乾燥させ、次に小さなメイクアップアプリケーターを使用して湾曲した植物表面にフィルムを転がすことによって、湾曲した植物表面に適用されます16,17。図1は、硬質および軟質基質の繊維を植物に適用するためのさまざまなアプローチを示しています。
プロトコル
1. VACNFの生成(図2 、 図3)
- シリコンウェーハをポリメチルメタクリレート(PMMA)495 A4でスピンコートし、4000rpmでレジストし、180°Cで5分間焼きます。
注意: 次のステップに進む前に、ウェーハを10秒間冷ましてください。 - レジストの2層目(PMMA 950 A2)をスピンコートし、180°Cで5分間焼成します。
- 電子線リソグラフィーを使用して、直径300 nmの触媒ドットを、指定された横方向の間隔(ピッチ:10 μm、または35 μm)で3 mm x 3 mmアレイで定義します。
- レジストを30〜40 mLの1:3メチルイソブチルケトン:イソプロピルアルコール(IPA)で1.5分間現像し、続いてIPAでリンスし、N2で乾燥させます。
注:明視野顕微鏡(20倍対物レンズ)を使用してドットの配列を確認します。 - シリコンエッチャー内の酸素プラズマ(デスカム)に6秒間曝露して、残留レジストのウェーハを洗浄します。
- 電子ビーム蒸着法を使用して、最初に金属の接着層(TiまたはCr、10 nm)を堆積させ、次にNi触媒(130 nmまたは150 nm)である2番目の層を堆積させます。TiまたはNi金属の堆積中は、見通し内堆積のために、電流を10kVで0.2A未満、圧力を5 x 10-6Torr 未満、および堆積速度を~1A/sに保ちます。
- シーケンシャルバス超音波処理を使用して、下地のレジスト層に堆積した金属(Ni)を除去し、Niをシリコンウェーハに直接堆積させます。このプロセスはリフトオフと呼ばれます。
- このために、アセトンを入れた3つの容器を準備し、ウェーハをアセトンで1分間超音波処理します。室温(室温、20°C)で周波数35kHzで3回繰り返します。IPAで洗い流し、N2で乾かします。
注意: ウェーハ上でアセトンを乾燥させないでください。最後のアセトン超音波処理の後、すぐにIPAですすぎ、次にN2 ガスで乾燥させます。いずれかの時点でウェーハが時期尚早に乾燥した場合(IPAリンス前)、余分な金属とレジストがすべて除去されず、アセトンが残留物を残す可能性があります。
- このために、アセトンを入れた3つの容器を準備し、ウェーハをアセトンで1分間超音波処理します。室温(室温、20°C)で周波数35kHzで3回繰り返します。IPAで洗い流し、N2で乾かします。
- 走査型電子顕微鏡(SEM)を用いて触媒形状の形状を確認します。VACNFチップのSEM画像をキャプチャするには、ステージを30°の角度に傾け、1〜3kVの電圧、ビーム電流~100pA、~5mmの作動距離を使用します。
注:触媒はホッケーパック(コンパクトなシリンダー)のように見えます(図4)。コンパクトなシリンダーの高さは、シリコンウェーハに堆積したNiの厚さを反映する必要があります。Niドットのプロファイルが高く、上部が火山のように凹んでいるように見える場合(図4)、触媒は複数のNi液滴に脱湿する可能性が高くなり、カーボンナノファイバー9が分岐します9。 このような問題は、堆積時間が長いことやリフトオフ手順の問題により、金属蒸着中のレジスト溶融が原因である可能性があります(図4および図5)。 - シリコンウェーハを四分の一にし、アセチレンとアンモニアの混合物と一緒に直流プラズマ強化化学気相成長チャンバー(dc-PECVD)に入れます。ナノファイバー(チップ<200 nm)の長さとテーパーを制御するために、成長パラメータを最適化します。
- 1〜1.5Aの電流と440〜560Vの電圧範囲を使用してください。繊維を成長させるときは、機械と基材が620°Cまで加熱されている間に、アンモニアフローによる前処理段階を使用します。 プラズマを開始する前に、必ず炭素源(アセチレン)を10秒間オンにしてください。
注:クォーターウェーハは、PECVDマシンの実行パラメータを最適化する必要がある場合に使用されます。長さが40μmを超え、先端の直径が200nm未満の繊維を製造するには、Ni触媒の厚さが130nmの場合、電流1.75A、成長時間70分、アセチレン:アンモニア比45標準立方センチメートル/分(sccm):100sccm)を使用します。Niの厚さが150nmの場合、電流1.5A、成長時間80分、アセチレン:アンモニア比48sccm:100sccmを使用します。触媒の厚さに関係なく、成長温度620°C、プラズマ中の圧力10トル、シャワーヘッドの高さ20mmのパラメータを使用してVACNFを成長させます(図6)。
- 1〜1.5Aの電流と440〜560Vの電圧範囲を使用してください。繊維を成長させるときは、機械と基材が620°Cまで加熱されている間に、アンモニアフローによる前処理段階を使用します。 プラズマを開始する前に、必ず炭素源(アセチレン)を10秒間オンにしてください。
- SEMを使用して、加速ポテンシャル1 kVで30°の傾きで得られたファイバーの形状を評価します。
注:最適な繊維は、まっすぐで枝分かれしていないものになります。Ni触媒の結晶方位を電子線蒸着器で制御することは不可能です。その結果、触媒脱湿潤9のために分岐する繊維がいくつか存在することになる。また、結晶方位によってVACNFが異なる高さに成長するため、すべてのVACNFの高さを均一にすることは困難です。 - フォトレジスト(SPR955)の層を1000rpmで45秒間繊維上にスピンコートします。次に、ダイシングソーを使用して、1/4ウェーハを3mm x 3mmのアレイにダイスします。後で使用するために、この時点でファイバーを保管します。
注意: ファイバーをフレキシブル基板に転写する場合は、ステップ1.11を実行しないでください。
2.VACNFをフレキシブル基板にランシングする(図7、図8)
- 繊維が合成された後、SU-8 2015フォトレジストをウェーハまたはクォーターウェーハ上に4000rpmで45秒間スピンコートします。
- ウェーハを95°Cで3分間ソフトベークします。
- コンタクトアライナーを使用して、95 mJ/cm2の電子ビームリソグラフィーから定義されたパターンに整列する3 mm 3 mmアレイパターンマスクでウェーハを露光します。
注意: 最も高いファイバーよりも20 μm大きい露出ギャップで近接接触モードを使用します。プロセスのこのステップ中に繊維が倒れる可能性があります。 - 95°Cで6分間の曝露後ベークを行います。
- ウェーハをSU-8現像液で15秒間現像し、IPAですすぎ、N2でウェーハを上から下に移動して乾燥させます。
注:ウェーハを現像するときは、完全に水没していることを確認してください。 - 薄いフォトレジスト(SPR 955 CM 0.7)の保護層でパターン化されたウェーハを3000rpmで45秒間スピンコートし、90°Cで30秒間ソフトベークします。
- 薄い酸化ケイ素層をウェーハ(2〜3nm)に堆積させ、100°Cで22サイクル原子層堆積させます。
- ダイシングソーを使用して、ウェーハを3mm×3mmの正方形に切断します。ダイシングソーをウェーハ上の既存のパターンに合わせます。
- SEMを使用して、30°の傾斜と3 kVの加速ポテンシャルで得られたファイバーの形状を評価します。
- チップを長期間(>1週間)保管する場合は、ここで停止してください。チップは暗闇に保管してください。
- 軟質基板と硬質基板を分離するには、個々のチップをアセトンに30分間、またはSU-8がカールし始めるまで置きます。
- SU-8フィルム(硬質基板に付着または剥離したもの)をIPAで5分間洗浄し、次に水で5分間洗浄します。チップを輸送するときは、粘着パッド付きの市販の箱に入れてください。
- オプション:SU-8フィルムのファイバーレス面を水溶性テープの上に置くか、薄いポリエチレンテレフタレート(PET)(厚さ12.5μm)の裏地が付いた薄いシリコーンゴムの上に置きます。
- ピンセットを使用してSU-8フィルムを転写します。SU-8の正方形の端を押して、テープ/シリコンゴム-PETにくっつくようにします。これは、繊維を壊さないようにするためです。この時点で、VACNFフィルムはすぐに使用できる状態になっています。
- シリコーンゴム/PETホルダーを準備するには、次のことを行います:シリコーンゴム用の2液型キットを使用して、2つの部品(エラストマーと架橋剤)を混ぜ合わせます。次に、PETの正方形を切り取り、透明なプラスチック皿にテープで留めます。PETの上にシリコーンゴムの非常に薄い層を注ぎ、80°Cで1〜2時間硬化させます。
3.硬質基板に繊維を使用するオンプラント法(送達する溶液を植物表面に一滴置く方法)(図1A)
- 使用前に、アセトン(100%、5分)、IPA(100%、5分)、およびddH2O(5分)を段階的に洗浄してフォトレジストを除去します。
- 串刺しにする植物組織を硬い表面に置いて支えます。
- 1 μLの液滴に色素またはDNA(200 ng)を植物組織の表面に置きます。
- 液滴の上に硬質基板を備えたVACNFチップを配置し、繊維が液滴と接触するように配向します。
注:チップの向きは、ウェーハの「光沢」によって決定できます。チップの光沢のある面には繊維があり、不透明な面にはありません。 - ピンセットの平らな面を使って、チップをタップします。チップが接触した植物の領域を、先端が柔らかいマーカーでマークします。納品後、VACNFチップを取り外してください。
注意: タッピング時に加えられる力の量は、使用する植物組織の種類によって異なります。繊維の串刺しを行う前に、切りくずのタッピングを練習することをお勧めします。植物組織への損傷を避けてください。損傷は、植物組織内のVACNFチップの輪郭が見える場合に明らかです。 - コントロール(+色素/DNA、-繊維、-色素/DNA、+繊維、および-色素/DNA、-繊維)について、手順3.1〜3.5を繰り返します。-ファイバーはチップのファイバーレス面です。
- 必要に応じて、無傷の植物または切除した植物器官を、長日条件(16時間の明るい、8時間の暗い)の湿気の多いチャンバーに保管します。切除された臓器の場合は、濡れたペーパータオルでプラスチック製のペトリ皿を使用します。
4. オンチップ方式(送達する溶液をVACNFチップ上に一滴垂らす)、硬質基板(図1B)
- 使用前に、アセトン(100%、5分)、IPA(100%、5分)、およびddH2O(5分)を段階的に洗浄してフォトレジストを除去します。
- 1 μLの液滴1μLの色素またはプラスミドDNA(200 ng)を、硬質基板を備えたVACNFチップのファイバー側にドロップキャストします。液滴をチップの中央に配置し、いくつかのファイバーを覆ってください。液滴を15分間乾かします。
注:チップの向きは、ウェーハの「光沢」によって決定できます。チップの光沢のある面には繊維があり、不透明な面にはありません。 - 葉やその他の切除された臓器を扱うときは、硬い表面の上に置きます。無傷の植物を扱う場合は、VACNFが適用される器官の下に硬い表面を置きます。
- 15分間の乾燥工程の後、繊維側が植物組織に接触するようにVACNFチップを配置します。ピンセットの後端でチップをタップします。
注意: タッピング時に加えられる力の量は、使用する植物組織の種類によって異なります。チップを叩く練習をすることをお勧めします。 - プラント内法の手順3.6〜3.7を繰り返します。
5. SU-8膜中のVACNFをオンチップ法で植物組織に適用(図1C)
- SU-8フィルムの繊維側に1μLの染料またはDNA(200ng)の液滴を置き、10分間乾燥させます。液滴は必ずチップの中央に置いてください。
注:使用する基材によって乾燥時間が異なります。 - 鋭利なピンセットを使用して、VACNFフィルムを植物の表面に置きます。
注:SU-8フィルムを空中に長く放置するほど、フィルムはより脆くなります。SU-8フィルムを紛失するリスクを抑えるために、すべてのプラント/サンプルと機器をSU-8フィルムの近くに配置してください。 - 小さなメイクアップアプリケーターをVACNFフィルムの上にそっと転がします。フレキシブル基板が置かれている領域に、先端の柔らかいマーカーで印を付けます。テープを使用して植物表面から柔軟な基板を取り除きます。
注意: メイクアップアプリケーターを転がすときに加えられる力の量は、使用する植物組織によって異なります。生体分子または色素の送達を行う前に、VACNFフィルムを塗布する練習をしてください。植物組織への目に見える損傷は、植物組織内のVACNFフィルムの輪郭を見ることができるときに明らかです。 - プラント内法のステップ5.1〜5.3で説明したように、コントロールと保管プラントについて手順3.7を繰り返します。
6. あらゆる配送方法に対応する顕微鏡検査と画像解析
- 共焦点顕微鏡を用いて、納品された蛍光プローブ/レポーターに適した発光波長と励起波長を用いてサンプルをイメージングします。
注:一過性形質転換に必要な時間は、植物種と送達されるマーカーによって異なります。例えば、蛍光マーカーの発現は、シロイヌナズナでは48時間後に検出されたのに対し、レタスの葉では96時間後に検出されました7。 - イメージングの際は、繊維が剥離した領域に焦点を合わせるようにしてください。繊維の配向は異なります。送達の成功は、切れた繊維の出現に依存しません。
注:繊維は、PECVD18の繊維形成から生じる窒化ケイ素層の形成により、最も一般的な励起/発光設定で蛍光を発します。 - サンプルごとに少なくとも 5 枚の画像をキャプチャします。結果の信号は変化します。
- ImageJ19を用いて、20 μm x 20 μmの共焦点画像領域7における全蛍光(積分密度)として蛍光値を測定する。
代表的な結果
硬質または軟質基板上のVACNFチップの明確な利点は、生体分子または色素を植物の特定の場所に送達できることです(図1)。ここでは、蛍光読み出しを使用して送達を評価しました。異なるプラント、基質、および送達方法(オンチップまたはオンプラント)を使用すると、色素フルオレセインの出現タイミングに違いが生じる可能性があります。VACNFチップ/フィルムが送達に適しているかどうかを判断するには、染料送達に繊維を使用するのが迅速なアプローチです(図9)。図 9 で異なる時間でラベル付けされた画像は、同じサンプルの異なる視野です。オンプラント法を使用する場合、フルオレセイン色素は、導入後すぐに蛍光顕微鏡を使用して観察できます。さらに、フルオレセイン色素を植物に送達した後、同じ視野を経時的に画像化すると、シグナル強度は時間の経過とともに明るくなります(図10)。フルオレセイン色素は、視野から原形質20,21を介して葉の他の領域に移動する可能性があります。オンプラント法と比較して、硬質基板上に繊維を載せたオンチップ法では、染料が突き刺さった領域全体への移動が遅くなります(図9)。これは、色素が細胞内の繊維から剥離/水分補給され、移動に時間がかかることが原因である可能性があります。
フレキシブル基板中の繊維は、イチゴやリンゴなどの曲面への色素送達に適していました(図11および図12)。イチゴを含む柔軟な基質を使用すると、強いフルオレセインシグナルがすぐに観察されましたが(図11)、リンゴでは強いフルオレセインシグナルが観察されるまでに2時間かかりました(図12B、D)。蛍光マーカーをコードするプラスミドの送達が成功したかどうかは、蛍光顕微鏡を用いて測定し、得られたシグナルを見つけることができます(図12F、図13、および図14)。選択した植物が、繊維で送達したい蛍光マーカーに類似した自家蛍光を発していないかどうかを判断するには、コントロールが必要です。ピンセットで加えられた衝撃力が植物組織に損傷を与えるのか、それともサンプル内で観察された蛍光が窒化ケイ素層18のために本質的に蛍光を発するVACNFによるものなのかを判断するには、ファイバーのみを使用するのに役立ちます(図13C-D)。植物組織に突き刺さった繊維は、H2O2産生によって評価されるような創傷反応を誘導しない6。最後に、+DNAのコントロールを用いて、-Fibersは、DNAがタッピングだけでは植物に侵入していないことを確認し、植物細胞への送達に繊維が必要であることを確認する必要がある(図13E-F)。硬質基板上でVACNFを使用するオンプラントまたはオンチップの送達方法を使用する場合、蛍光値に有意差がないことからわかるように、明確な違いはないはずです(図13I)。オンチップDNA送達で柔軟なVACNFフィルムを使用すると、市販のリンゴとタマネギの表皮細胞の一過性形質転換に成功しました(図12Fおよび図14)。
実験に失敗すると、異なる視野で繊維が切断される可能性がありますが、プラスミドDNAまたは色素を送達する試みから得られる蛍光シグナルはありません。植物に過度の圧力がかかると、明らかな組織損傷が生じます(図15)。この機械的損傷は、顕微鏡で植物を見ると、細胞の層が取り除かれたかのように、植物の小さな穴や透明な領域のように見えることがあります。チップの痕跡が見える場合があります。DNA導入後に蛍光タンパク質の発現が検出されない実験も、低品質のDNAを使用していることが原因である可能性があるため、新しいDNAを調製することが有用である可能性があります。
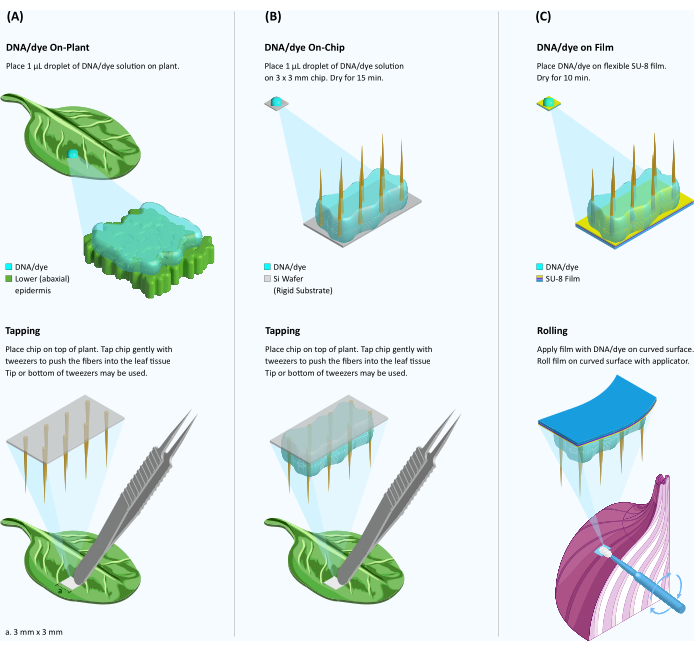
図1:硬質および軟質基質上の繊維を用いた植物組織への色素/DNA送達の概略図。 (A)植物上での繊維媒介色素/DNA送達。葉の表面に色素/DNA溶液の1μLの液滴を置き、その液滴の上にVACNFチップを置きます。ピンセットを使用して、チップを組織にそっとたたきます。硬質基質が除去され、組織内にナノファイバーが残ります。(B)オンチップファイバー媒介DNA送達。1 μLの液滴の色素またはDNA溶液をVACNFチップに滴下キャストし、15分間乾燥させます。半乾燥DNAのチップを葉の表面の上に置き、パネルAのように組織に叩き込みます。(C)オンチップSU-8膜DNA送達。繊維は、硬質シリコン基板から柔軟なSU-8バッキングに転写されます。1μLの液滴の色素/DNA溶液をVACNFフィルムに滴下し、10分間乾燥させます。次に、半乾燥した染料/DNAを含むVACNFフィルムを、メイクアップアプリケーターを使用して湾曲した植物表面に転がします。この図の拡大版をご覧になるには、ここをクリックしてください。
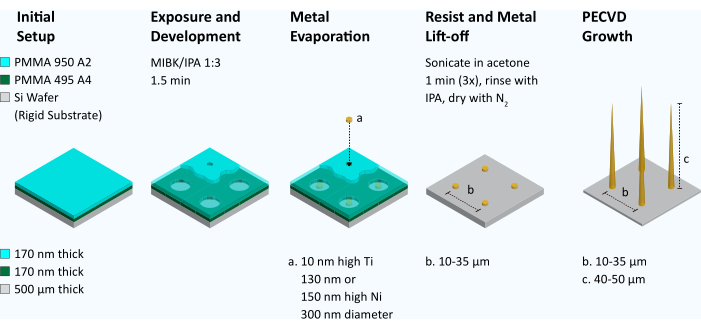
図2:垂直に配向したカーボンナノファイバーアレイを作製するためのワークフロー。 VACNFを製造するには、ポリメチルメタクリレート(PMMA 495 A4とPMMA 950 A2)の二重層をシリコンウェーハ上にスピンコートします。電子線リソグラフィーは、直径300nmのドットの配列を定義するために使用されます。次に、レジストをメチルイソブチルケトン/イソプロパノール(MIBK/IPA)中で1:3で1.5分間現像します。金属蒸着器を使用して、Ti(10 nm)の接着剤層をウェーハに塗布し、続いてNi(130 nmまたは150 nm)の層を塗布します。その後、残りのレジストはリフトオフ(アセトン中での浴超音波処理)によって除去されます。触媒ドットの形状をSEMで検査します。触媒がホッケーのパックに似ていて平らな場合は、プラズマ化学気相成長(PECVD)装置に入れられ、繊維が成長します。その後、SEMを使用して繊維を検査しました。 この図の拡大版を見るには、ここをクリックしてください。

図3:理想的な垂直配向カーボンナノファイバーのSEM画像。 (A)30°の角度で画像化された、~35μmピッチ、高さ10-15μmのVACNFの電子顕微鏡写真。この図は、図7Cに複製されています。(B)~20μmピッチ、高さ20-30μmのVANCFを30°の角度で撮像した電子顕微鏡写真。(C)~35μmピッチ、高さ50-60μm、30°の角度で撮像したVANCFの電子顕微鏡写真。(D)直径<200nmのVACNFチップの電子顕微鏡写真。繊維先端径(150-300nm)にばらつきがあります。繊維は30°の角度で撮影されたため、高さは実際の高さよりもsin(30°)=1/2の係数で小さく見えます。パネルAとBは、Morganらの許可を得て転載しています7。この図の拡大版をご覧になるには、ここをクリックしてください。
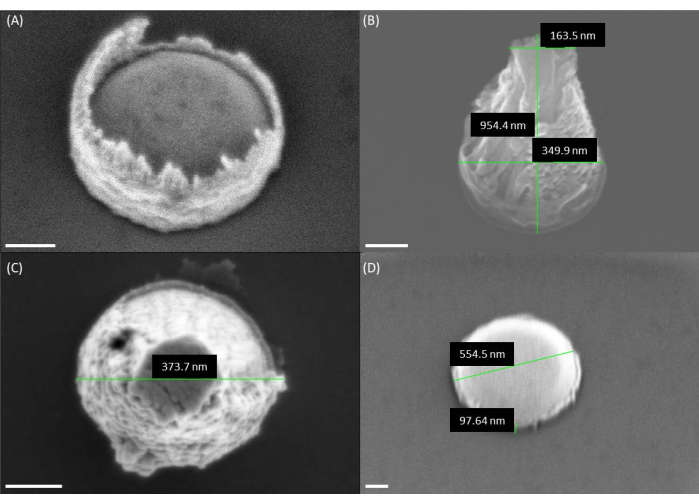
図4:VACNFを成長させる前の触媒形状のSEM画像 。 (A)リフトオフ後の触媒のSEM画像。なお、フォトレジストは触媒の縁の周囲に存在し、火山状を呈する。(B、C)SEM画像は、単層PMMAレジストを使用した後の触媒の火山形状を示しています。(D)PMMAの二重層から作られた望ましいホッケーパック触媒形状。パネルA、B、Dでは繊維が30°の角度で画像化されているため、高さは実際の高さよりもsin(30°) = 1/2の係数で小さく見えます。スケールバーは 100 nm を表します。 この図の拡大版をご覧になるには、ここをクリックしてください。

図5:触媒ドットサイズが繊維成長に及ぼす影響:触媒材料の最適な直径を確立するために、200〜600nmの範囲のドットサイズから繊維を成長させました。400〜600nmの範囲のドットサイズは、触媒の脱湿潤と複数の繊維の成長につながりました。最良の繊維形状は、直径300nmで製造されました。ドットが小さいと、ファイバーの高さが不十分になります。繊維は30°の角度で画像化されたため、高さは実際の高さよりもsin(30°)= 1/2の係数で小さく見えます。画像は走査型電子顕微鏡写真を用いて撮影した。この図の拡大版をご覧になるには、ここをクリックしてください。
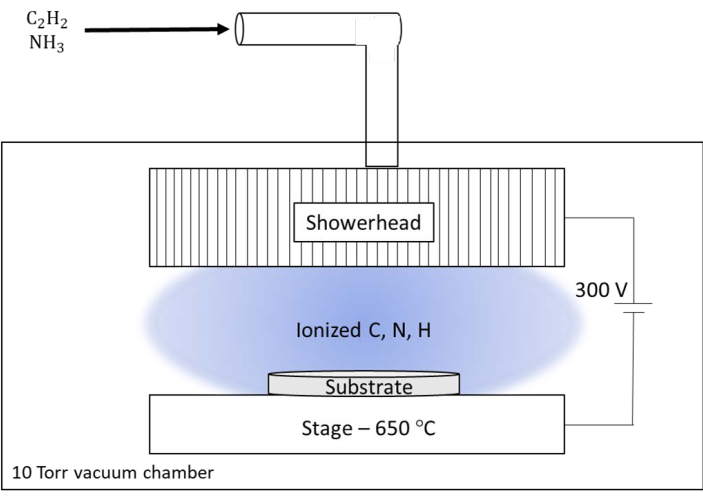
図6:オークリッジ国立研究所(ORNL)で使用されている直流プラズマ化学気相成長(dc-PECVD)システムの概略図。 ORNLのカスタムシステムには、供給ガスの反応器とプラズマの出力として機能する大きなシャワーヘッドがあります。シャワーヘッドは、基板の加熱ステージに対して300VのDC電位に維持された。この図の拡大版をご覧になるには、ここをクリックしてください。
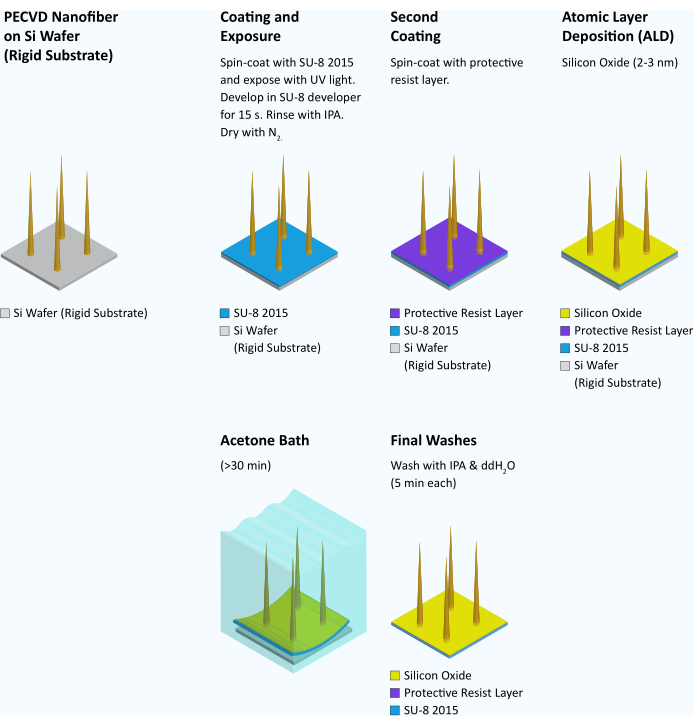
図7:硬質基板からフレキシブル基板に繊維を転写するワークフロー。 ナノファイバーの合成と検査の後、各ウェーハはSU-8 2015で4000rpmで45秒間スピンコーティングされます。その後、ウェーハを95°Cで3分間ソフトベークします。 次に、ウェーハをUV光に曝露し、マスクアライナーで95mJ/cm2でパターニングします。95°Cで6分間ポストベークした後、SU-8現像液中で15秒間現像し、IPAでリンスし、N2 ガスで乾燥させる。SPR 955 CM 0.7の保護レジスト層を3000rpmでウェーハ上にスピンコートし、90°Cで30秒間ソフトベークします。次に、酸化ケイ素層(2〜3nm)を原子層堆積(ALD)(100°Cで22サイクル)してウェーハに添加し、フレキシブル基板を親水性にする15。その後、ウェーハをダイシングソーで3mm×3mm角にダイシングします。使用時には、SU-8がカールし始めて凹状になるまで(>30分)、個々のチップをアセトンに入れます。このとき、ほとんどのチップのSU-8層は、鋭利なピンセットで端をつかみ、下地のシリコン基板から無傷の3mm角のフィルムとして剥がすことができます。その後、フィルムをIPAと水でそれぞれ5分間連続して洗浄し、すぐに使用します。 この図の拡大版をご覧になるには、ここをクリックしてください。

図8:硬質基板から軟質基板への繊維転写のSEM画像。表示されている画像は代表的なものですが、異なるサンプルからのものです。(A)PECVD成長後の長繊維(図2Cと同じ画像)。(B、C)SU-8を塗布した後の繊維。エポキシは繊維の根元に湧き出ます。露出した繊維長は5μmから30μmの範囲であった。 (D)リフトオフ後にSu-8に埋め込まれたファイバーは、その形状を保持しました。繊維は30°の角度で撮影されたため、高さは実際の高さよりもsin(30°)=1/2の係数で小さく見えます。パネルAは、Morganらの許可を得て転載しています7。この図の拡大版をご覧になるには、ここをクリックしてください。
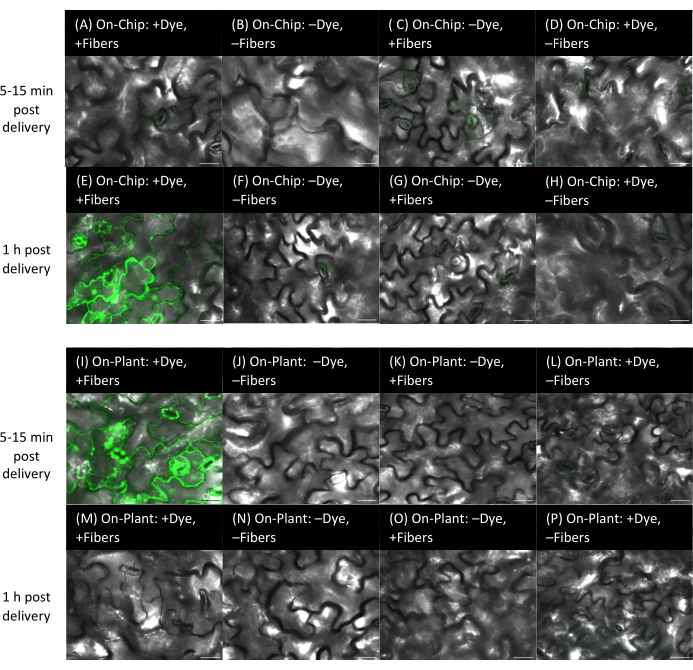
図9:シロイヌナズナの葉への色素の送達(硬質基質上の繊維を用いたオンチップおよびオンプラント法を使用)。 (A-P)画像は共焦点顕微鏡を用いて取得しました。オンチップ法(A-H):10 μMフルオレセイン色素1μLをVACNFチップ上で15分間乾燥させた後、チップをピンセットでシロイヌナズナの葉のアキシャル面に叩き込みました。(A-D)配達後5〜15分以内に画像化されます。(E-H)配達後1時間で画像化。(A、E)+染料、+繊維。コントロール:(B、F)-染料、-繊維;(C、G)-染料、+繊維;(D、H)+染料、-繊維。(I-P)オンプラント法:10μMフルオレセイン色素1μLを植物表面に置き、チップが液滴と接触するように配置し、ピンセットを使用してチップをシロイヌナズナの葉の軸側に叩き込みました。(I-L)は分娩後5〜15分以内に画像化され、(M-P)は分娩後1時間以内に画像化されます。(I、M)+染料、+繊維。コントロール:(J、N)-染料、-繊維;(K、O)-染料、+繊維;(L,P)+染料、-繊維。パネルA-Pは、zスタックからの単一の平面画像です。スケールバーは20μmです。ファイバーのピッチは35μmです。この図の拡大版をご覧になるには、ここをクリックしてください。
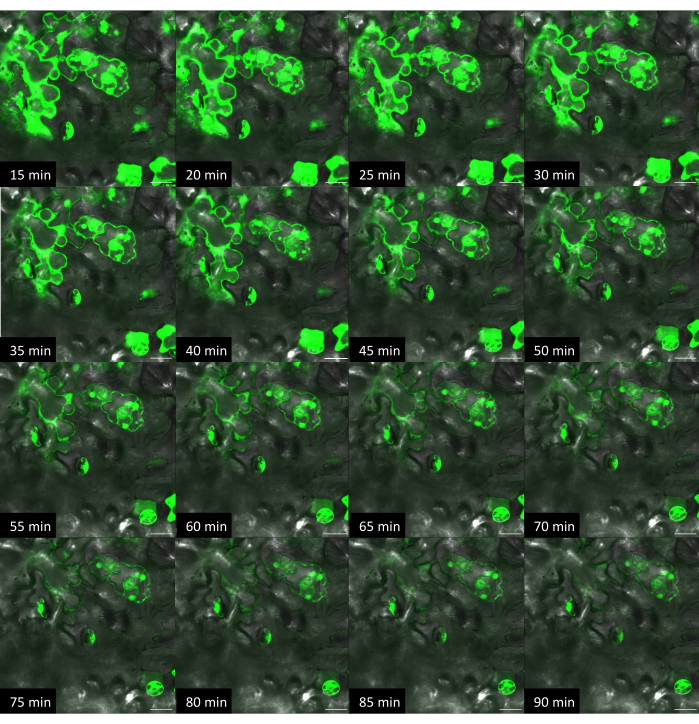
図10:シロイヌナズナにおける硬質基質を用いたオンプラント法による色素送達の経時変化。 画像は共焦点顕微鏡を用いて取得しました。オンプラント法を用いて、フルオレセイン色素溶液(10μM)1μLの液滴を葉の表面に置き、その上にVACNFチップを載置した。ピンセットを使用して、チップを組織にそっと叩き込みました。+染料、+繊維の同一領域の画像を5分ごとに取得しました。スケールバーは20μmです。ファイバーのピッチは35μmです。パネルは、zスタックからの単一の平面画像です。 この図の拡大版をご覧になるには、ここをクリックしてください。
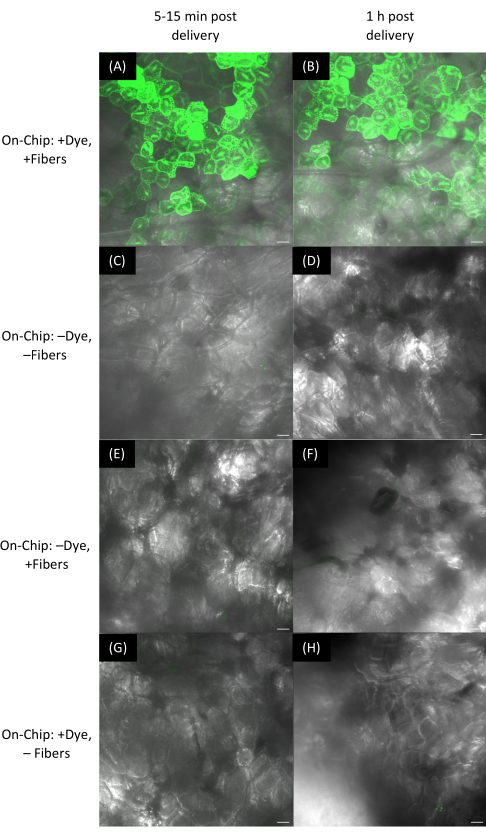
図11:VACNFフィルムを用いたイチゴ果実への色素送達。 (A-H) 画像は共焦点顕微鏡を用いて取得しました。オンチップ法では、VACNFフィルム上で染料の液滴を乾燥させ、メイクアップアプリケーターを用いて果実表面に転がしました。フルオレセイン色素(10μM)をイチゴ細胞に送達し、(A)10分および(B)1時間後にイメージングした。(E、F)-染料、+ファイバーは、それぞれ10分後および1時間後に制御します。(G,H) +染料, -繊維はそれぞれ10分および1時間後に制御する。スケールバーは40μmです。 パネルA-Hは、188μmのzスタックの最大投影です。ファイバーのピッチは35μmです。この図の拡大版をご覧になるには、ここをクリックしてください。

図12:VACNF膜を介したリンゴの色素送達と一過性形質転換。 (A-F)画像は共焦点顕微鏡を用いて生成した。オンチップ法を用いて、フルオレセイン色素1μLの液滴(10μM、BおよびD)またはpUBQ10:YFP(DNA−YFP)(200ng)をコードするプラスミド1μLをVACNFフィルム上で乾燥させ、その後、メイクアップアプリケーターを使用して果実表面に転がしました。フルオレセイン色素をリンゴの表皮に送達し、(B)10分後および(D)2時間後にイメージングした。(F)48時間後のVACNFフィルムを介したDNA-YFPの送達および発現(A、C、E)無処理対照(-染料/DNA-YFP、-繊維)。スケールバーは40μmです。 パネルA-Dは、zスタックからの単一の平面画像です。パネルEとFは、53μmのzスタックの最大投影です。ファイバピッチは35μmです。矢印はフルオレセインまたはYFPシグナルを示す。*はファイバーを示します。この図の拡大版をご覧になるには、ここをクリックしてください。
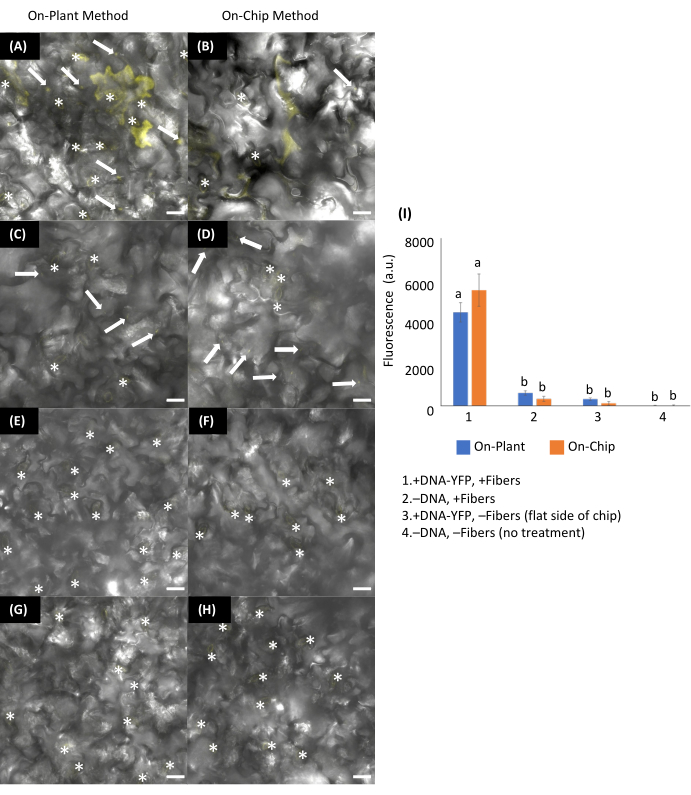
図13:シロイヌナズナの葉のオンプラントまたはオンチップVACNF法を用いた一過性形質転換。(あ-H)画像は、DNA送達の48時間後に共焦点顕微鏡を使用して取得しました。(A、C、E、G)オンプラント法:シロイヌナズナの葉の軸面にpUBQ10:YFP(DNA−YFP)(200 ng)をコードするプラスミド1 μLを配置しました。チップは液滴と接触するように配置され、ピンセットはチップを葉の組織に叩き込むために使用されました。(B,D,F,H)オンチップ法:1μLのDNA-YFP(200ng)をVACNFチップ上で15分間乾燥させた後、チップウェアをピンセットでシロイヌナズナの葉の軸側に叩き込みました。+DNA-YFP、+ファイバー(A)オンプラントおよび(B)オンチップ用。コントロール:(C、D)-DNA-YFP、+ファイバー;(E、F)+ DNA-YFP、-ファイバー;(G,H)-DNA、−繊維。(I)YFPチャンネルからの蛍光を用いた2〜3回の実験で組み合わせた5つの生物学的複製の画像から得られた、25、20×20μm領域の相対平均蛍光シグナル強度のグラフ。気孔(*)を含む領域は自家蛍光のため除外した。-DNA-YFP、-Fibers条件からの平均蛍光強度を各平均から差し引いた。2−有意差検定には2元配置ANOVA(およびテューキー検定)が使用され、エラーバーは平均の標準誤差を表します。異なる文字は、処理間で有意差を示します(P < 0.0001)。示されているすべての画像は、40 μm z-stacksの最大投影です。スケールバーは20μmです。白い矢印は、画像内のファイバーを示します。ファイバピッチは35μmです。この図は、Morgan et al.7の許可を得て転載したものです。この図の拡大版をご覧になるには、ここをクリックしてください。

図14:VACNF膜を用いたタマネギの過渡形質転換。 画像は、DNA送達の48時間後に共焦点顕微鏡を使用して取得しました。オンチップ法を用いて、pUBQ 10:YFP(DNA-YFP)(200 ng)液滴をコードする1 μLのプラスミドDNAをVACNFフィルム上で10分間乾燥させ、その後、植物器官表面に転がしました。(A)DNA-YFPをタマネギ表皮に導入し、YFPを発現させた。(B)治療管理なし。(C)コントロール(+DNA-YFP、-Fibers)および(D)コントロール(-DNA-YFP、+Fibers)。スケールバーは40μmです。ファイバーのピッチは35μmです。画像は、115 μm の z スタックの最大投影です。 この図の拡大版をご覧になるには、ここをクリックしてください。

図15:VACNFフィルムの塗布によるレタスの組織損傷。 (A-D)画像は共焦点顕微鏡を用いて作成しました。(A)オンチップ法を用いて、VACNFフィルムを介してレタスの葉にDNAを送達しました。pUBQ 10:YFP DNA(200 ng)液滴をVACNFフィルム上で10分間乾燥させた後、剥離したレタスの葉の軸面に転がし、加湿室で4日間保存しました。(B)コントロール(-DNA-YFP、+Fibers)。(C)コントロール(+DNA-YFP、-Fibers)、および(D)無処理(-DNA-YFP、-Fibers)。スケールバーは40μm、VACNFは35μmピッチです。矢印は、フレキシブル基板を力を入れすぎたことによるプラントの損傷を示しています。なお、レタスにおけるVACNFを介したDNA送達の成功は、他の実験でも達成されている7。この図の拡大版をご覧になるには、ここをクリックしてください。
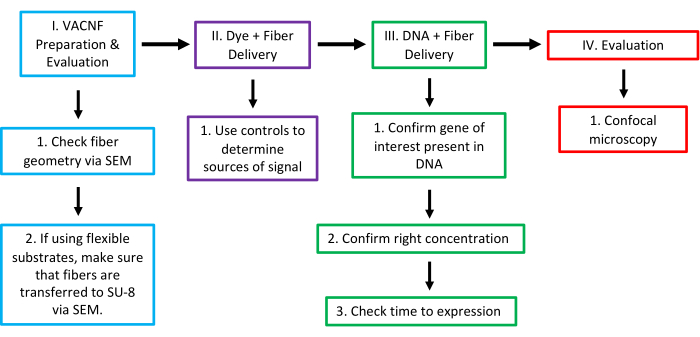
図16:植物におけるVACNF媒介送達のワークフロー。 ステージIでは、SEMを使用して繊維の形状を確認します。適切に送達するためには、ファイバーには直径<200nmのチップが必要です。フレキシブル基板に繊維を使用する場合、次のステップは、繊維がSU-8に転写されていることを確認し、SEMを介して露出した繊維の高さを確認することです。ステージIIでは、硬質または軟質の基質を使用して、選択した植物/器官に色素を送達することを試み、繊維の有用性をテストしました。1 μLの液滴を植物表面に置くか、チップ/フィルム上で短時間乾燥させます。このステップおよび他のすべてのステップでは、適切なコントロール(-Dye,-Fibers;-Dye, +Fibers;+Dye,-Fibers)を使用して、シグナルが 真正な 色素送達によるものであると確信することが不可欠です。ステージIIIでは、目的の遺伝子がプラスミドに存在することを確認し、送達するDNAの濃度を決定し、送達後の最適な時間を検査して発現を確認します。ステージIVでは、共焦点顕微鏡を使用して結果を評価し、送達されたマーカーの発現を確認しました。この図は、Morgan et al.7 の許可を得て変更されています。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
本論文では、カーボンナノファイバーアレイを垂直に配列し、その繊維をフレキシブル基板に転写し、硬質または軟質の基板にファイバーを植物に塗布し、生体分子や色素を植物に送達する方法を紹介しました。導入した材料を堆積させるには、オンチップ法とオンプラント法の2つの一般的なアプローチを説明し、VACNF膜を用いたオンチップ法だけでなく、硬質基板上に繊維を作製することに成功した結果を示しました。これらの繊維の応用は、従来の植物形質転換法(粒子衝撃、PEGまたはエレクトロポレーションによるプロトプラスト形質転換)よりも実践的にも理論的にも単純であり、アグロバクテリウムを介した形質転換に抵抗性のある植物に使用できます。ただし、変換されるセルはごくわずかです。
垂直に配向したカーボンナノファイバーは、オークリッジ国立研究所ナノフェーズ材料科学センターのユーザープログラムを通じて製造されました。利用者は、VACNFの製造のためにこの施設の使用を申請することができます。あるいは、VACNFチップは、炭素源22,23を備えた直流プラズマ強化化学気相成長装置を備えたクリーンルームで製造することができます。説明されている方法では、繊維の製造、繊維の転写、およびVACNFチップ/フィルムの応用に不可欠ないくつかのステップがあります。繊維の塗布が機能するためには、植物細胞への送達を成功させるためには、繊維がまっすぐで先端の先細り直径が<200 nmでなければなりません6,7(図3)。特定のサイズとピッチのカーボンナノファイバーを作成するために、ドットサイズ、横方向のピッチ、触媒の堆積量など、さまざまなパラメータを変更することができます。カーボンナノファイバーの製造に使用する最適なドットサイズを選択するために、さまざまなドットサイズからファイバーを成長させました(図5を参照)。直径300 nmのファイバーが最適であることがわかったため、このドットサイズを選択しました(図5)。適切なパラメータを見つけた後、理想的な形状(ストレート、チップ径<200 nm)のファイバー>50%のチップを使用することを検討しました。ファイバーの形状を確認するために、走査型電子顕微鏡を使用して、VACNFチップ/フィルムのサンプル上のランダムな視野を画像化しました。
さらに、繊維は植物細胞内で送達するために一定の最小長を持っている必要があります。異なる長さの繊維を製造することの重要性は、より長い繊維を使用してより深い組織層に浸透できることです。より長い繊維(長さ>40μm)は、繊維が根元から繊維を切断することによって繊維転写が機能し、繊維の上にSU-8を層状にする必要があるため、柔軟なフィルムに不可欠です。このプロトコルに使用されるSU-8層の作業厚さは20〜35μmです。様々な植物(湾曲または平ら)の表皮内で送達を達成するために必要な最小の高さは10〜15μmである6,7。そのため、VACNF膜には>40μmの長さの繊維が必要となる。カーボンナノファイバーを製造する際には、触媒材料、触媒形状、触媒材料の厚さ、PECVDチャンバー内の条件(ガス比、圧力、温度、電流、シャワーヘッドの高さ、成長時間)など、いくつかの異なるパラメータを考慮する必要があります8,9,24,25。Morganら7とDavernら6が用いた25μm以上の炭素ナノファイバーを製造するために、Ni触媒の量を増やし、アセチレンとアンモニアの比率を変化させ、電流と成長時間を長くしました。さらに、触媒材料の形状にも注意を払いました。背の高い直線繊維を製造するためには、堆積した触媒が火山のような形状ではなく、ホッケーパックの形状である必要がありました(図4)。火山構造は、リフトオフ後のフォトレジストの残骸から発生します。火山の形成を防ぐために、PMMAの二重層が電子ビームリソグラフィー26中にアンダーカットを作成するために使用されました。アンダーカットは、堆積した金属触媒のリフトオフを助けます(図2)。触媒の厚い層は、背の高いVACNFの成長に重要です。VACNFの形態はMerkulova et al.24によって調べられている。VACNFの垂直方向の配向は、Ni触媒チップ型の成長と、基板に垂直な直流電位の配向の両方によるものです(図6)。シャワーヘッドは、PECVD反応器(図6)の形状を記述し、電界27の電位の源として機能する。
電子線リソグラフィーで触媒ドットの配列を確定するために、電子線レジスト(ポリメチルメタクリレート)を塗布し、電子ビームを用いてレジストに特定の形状とウェーハ上の特定の位置に小さな穴を開けました。所望の直径の穴を規定の間隔(ピッチ)で規則的なグリッド上に配置し、所望のパターンを指定したファイルを電子ビームリソグラフィー装置にロードしてから、基板をマシンにロードしました。繊維の高さに加えて、繊維の転写を成功させるためのもう一つの重要なパラメータは、アセトン浴で費やされる時間です。VACNFフィルムは、エッジがカールし始めるまでアセトン浴に長時間放置する必要があります。アセトン浴に放置する時間が短すぎると、チップが浮き上がりにくくなり、破損する可能性があります。チップが古ければ古いほど、アセトン浴に長くとどまらなければなりません。アセトン浴に続いて、フィルム/チップをイソプロパノールと水に入れて、アクセスアセトンを除去し、繊維上の保護フォトレジストを除去しました。
スピンコートを行うには、スピンコーター内の真空チャックにウェーハまたはウェーハ片を配置し、スピンコーターのテスト機能を使用してウェーハの中心位置を確認します。小さな水たまり(直径~2.5cm)のレジストをウェーハの中心に塗布し、紡糸(3000rpm×45秒)するスピンコート前後の繊維の画像は、繊維形状(高さ、配向、ピッチ)の保存を示す図8に示されている。繊維が存在すると、繊維の根元にレジストが湧き上がり、予想以上に厚い層になります。VACNF成長後のスピンコーティングは、他のグループによって研究されています11,18。
このプロセスのもう一つのステップで非常に重要なのは、VACNFチップ/フィルムに適切な量の力が加えられるようにすることです。送達機構は、ピンセットの衝撃力によって細胞壁に小さな穿刺を行う繊維に依存している6,7、または柔軟な基板上でミニメイクアップアプリケーターで転がる。繊維は、結果に影響を与えることなく、植物細胞に分解されて埋め込まれたままになる場合とそうでない場合があります6,7が、適切な圧力を得るためには、色素の取り込みと組織損傷の検査と併せて練習する必要があります。さらに、検出可能な発現までの時間は植物種や送達されるベクターの種類によって異なるため、VACNFチップ/フィルムを用いたDNA導入後の適切なイメージング時点を選択することが重要です7(図16)。
この方法は植物に広く適用できますが、いくつかの制限があります。例えば、VACNF膜に酸化ケイ素の薄層を添加しても、SU-8の上にフォトレジストの保護層が追加されるため、必ずしも完全に親水性になるとは限りません。この問題が現実のものとなった場合、VACNFにはより厚い酸化ケイ素の層を施すことができます。フィルムが疎水性か親水性かをテストするには、フィルムを水に入れることができます。フィルムが沈むと親水性になり、浮くと疎水性になります。さらに、生産される繊維のバッチ間にばらつきがある可能性があります。dc-PECVDマシンで繊維を成長させるときに変更できるいくつかのパラメータがあります。このプロトコルで記述されているものは、2つの異なる量のNi触媒のパラメータのセットです。さらに、Ni触媒の結晶方位は制御できず28 、分岐は必然的に繊維に生じる。
この論文では、硬質基質と軟質基質の両方を使用して、フルオレセイン色素とDNAを植物細胞に送達することを実証しましたが、この方法は、他の生体分子や遺伝子組み換えアプローチ、たとえば、安定したトランスジェニック株を産生するのに何年もかかるリンゴやその他の果物などの植物系のRNAiサイレンシングに広く適用できるはずです。さらに、これらの繊維は、遺伝子編集材料の送達や植物の安定した形質転換にも使用できます。
開示事項
著者は何も開示していません。
謝辞
ナノファイバーアレイは、エネルギー省科学局のユーザー施設であるナノフェーズ材料科学センターで作製されました(提案ID:CNMS2019-103およびCNMS2022-A-1182)。CNMSからの支援は、査読付きプロポーザルシステムを通じて授与され、成果を公表する予定の合格者には無償で提供されます(http://www.cnms.ornl.gov/user/becoming_a_user.shtml)。ナノファイバーアレイの製造に協力してくれたKevin Lester氏とCNMSに感謝します。実験計画法について批判的な議論をしてくれたJohn Caughmen博士、Timothy McKnight博士、Amber Webb博士、Daryl Briggs博士、Travis Bee氏に感謝します。PECVD装置の回路図を提供してくださったAdam Rondinone博士に感謝します。科学的なイラストを描いてくれたレスリー・キャロルに感謝します。この研究は、米国エネルギー省、科学・生物・環境研究局、DE-SC0019104、および米国農務省のバイオイメージング科学プログラム(2021-67013-34835)から資金提供を受けました。JMMは、米国農務省:国立食糧農業研究所:農業および食品研究イニシアチブ博士課程前フェローシップ2021-67034-35167の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 13" x 13" White 1/4-fold heavy duty Brawny industrial shop towel 70Ct | Fastenal | 690535 | |
| 2-Propanol (IPA) | Fischer Scientific | A451-4 | |
| 4" Lid | Entegris | H22-401-0615 | Wafer Carriers |
| 4" tray | Entegris | H22-40-0615 | Wafer Carriers |
| Accretech SS10 dicing saw | Accreteck | SS10 | |
| Acetone | Fischer Scientific | A18-4 | |
| Acetone used in the cleanroom at ORNL | JT Baker | 9005-05 | |
| Apples | Grocery store | No product number | |
| Arabidopsis thaliana | Seeds of accession Columbia from the laboratory of Professor Jean Greenberg at the University of Chicago | No product number | |
| Carbon direct current plasma enhanced chemical vapor deposition machine | Oak Ridge National Laboratory | Custom-built | |
| Cobham Green lettuce | Seeds from the laboratory of Professor Richard Michelmore at the University of California, Davis | No product number | Butterhead lettuce |
| Fluorescein dye | Sigma Aldrich | F2456-2.5G | |
| Gel-box | Gel-Pak | AD-23C-00-X4 | |
| Heidelberg DWL 66 direct-write lithography tool | Heidelberg | DWL 66 | |
| ImageJ | National Institues of Health | No product number | |
| Isoproponal (IPA) used in the cleanroom at ORNL | Doe and Ingalls | CMOS Grade 9079-05 | |
| JEOL 9300FS 100kV electron beam lithography system | JEOL | 8100 | |
| Kimwipes | Kimtech | Kimberly-Clark Professional 34120 | |
| Kord-Valmark disposable polystyrene petri dish | VWR | 11019-554 | |
| Layout Editor | juspertor GmbH | No product number | |
| LSM 710 confocal microscope | Zeiss | No product number | |
| LSM 800 confocal microscope | Zeiss | No product number | |
| Make-up applicator | Amazon | G2PLUS | 500 PCS Disposable Micro Applicators Brush for Makeup and Personal Care (Head Diameter: 1.5 mm)- 5 x 100 PCS |
| Merlin field emission scanning electron microscope | Zeiss | Merlin | |
| MIBK/IPA (methyl isobutyl ketone/isopropanol) (1:3) | Microchem | M089025 | |
| Onions | Grocery store | No product number | |
| Oxford FlexAl atomic layer deposition | Oxford | FlexAl | |
| PMMA 495 A4 | Microchem | M130004 | |
| PMMA 950 A4 | Microchem | M230004 | Can dilute down to A2 |
| Polyethylene terephthalate (PET) | Amazon | KS-6304-21-11 | Type D Clear PET (Polyester) Sheet .0005" Thick x 27" Width x 10 Ft Length 1 pc |
| Precision tweezers | Aven Inc. | 18032TT | |
| pUBQ10:YFP-GW | Arabidopsis Biological Resource Center | CD3-1948 | |
| Silicon etcher (used for descum) | Oxford | Plasmalab | |
| Silicon rubber kit | Smooth-On Inc | Ecoflex 00-20 | |
| Silicon wafers | Pure Wafer | 4N0.001-.005SSP-INV | |
| Spin coater | Brewer Sciences | Model 100CB | |
| SPR 955cm 0.7 | Megaposit | 10018314 | |
| Strawberries | Grocery store | No product number | |
| SU-8 2015 | Microchem | SU-8 2000 Series | Toxic. Handle with care. Wear chemical goggles, chemical gloves and suitable protective clothing when handling SU-8 2000 resists. Do not get into eyes, or onto skin or clothing. |
| SU-8 developer | Microchem | SU-8 2000 Series | Handle with care. Wear chemical goggles, chemical gloves and suitable protective clothing when handling SU-8 2000 resists. Do not get into eyes, or onto skin or clothing. |
| Suss MicroTec contact aligner | Suss MicroTec | MA6/BA6 | |
| Table top microscope | Phenom XL | used for checking Ni catalysts after metal deposition | |
| Thermionics VE-240 e-beam evaporator | Thermionics | VE-240 |
参考文献
- Canto, T. Transient expression systems in plants: potentialities and constraints. Advances in Experimental Medicine and Biology. 896, 287-301 (2016).
- Gou, Y. J., et al. Optimization of the protoplast transient expression system for gene functional studies in strawberry (Fragaria vesca). Plant Cell, Tissue, and Organ Culture. 141, 41-53 (2020).
- Baltes, N. J., Gil-Humanes, J., Voytas, D. F. Genome engineering and agriculture: Opportunities and challenges. Progress in Molecular Biology and Translational Science. 149, 1-26 (2017).
- Ren, R., et al. Highly efficient protoplast isolation and transient expression system for functional characterization of flowering related genes in Cymbidium orchids. International Journal of Molecular Sciences. 21 (7), 2264 (2020).
- Kumar, S., et al. Nanovehicles for plant modifications towards pest-and disease-resistance traits. Trends in Plant Science. 25 (2), 198-212 (2020).
- Davern, S. M., et al. Carbon nanofiber arrays: a novel tool for microdelivery of biomolecules to plants. PLoS One. 11 (4), e0153621 (2016).
- Morgan, J. M., et al. An efficient and broadly applicable method for transient transformation of plants using vertically aligned carbon nanofiber arrays. Frontiers in Plant Science. 13, 1051340 (2022).
- Melechko, A. V., et al. Vertically aligned carbon nanofibers and related structures: Controlled synthesis and directed assembly. Journal of Physics D: Applied Physics. 97, 041301 (2005).
- Melechko, A. V., Desikan, R., McKnight, T. E., Klein, K. L., Rack, P. D. Synthesis of vertically aligned carbon nanofibres for interfacing with live systems. Journal of Physics D: Applied Physics. 42 (19), 193001 (2009).
- Nelson-Fitzpatrick, N. . Novel Materials for the Design of Cantilever Transducers [dissertation]. , (2011).
- Fletcher, B. L., et al. Transfer of flexible arrays of vertically aligned carbon nanofiber electrodes to temperature-sensitive substrates. Advanced Materials. 18 (13), 1689-1694 (2006).
- Keller, S., Blagoi, G., Lillemose, M., Haefliger, D., Boisen, A. Processing of thin SU-8 films. Journal of Micromechanics and Microengineering. 18 (12), 125020 (2008).
- Wouters, K., Puers, R. Diffusing and swelling in SU-8: insight in material properties and processing. Journal of Micromechanics and Microengineering. 20 (9), 095013 (2010).
- Jamal, M., Zarafshar, A. M., Gracias, D. H. Differentially photo-crosslinked polymers enable self-assembling microfluidics. Nature Communications. 2, 527 (2011).
- Williams, R., Goodman, A. M. Wetting of thin layers of SiO2 by water. Applied Physics Letters. 25 (10), 531-532 (1974).
- Kundu, A., Nogueira Campos, M. G., Santra, S., Rajaraman, S. Precision vascular delivery of agrochemicals with micromilled microneedles (µMMNs). Scientific Reports. 9, 14008 (2019).
- Acanda, Y., Welker, S., Orbović, V., Levy, A. A simple and efficient agroinfiltration method for transient gene expression in Citrus. Plant Cell Reports. 40 (7), 1171-1179 (2021).
- Pearce, R., et al. Synthesis and properties of SiNx coatings as stable fluorescent markers on vertically aligned carbon nanofibers. AIMS Materials Science. 1 (2), 87-102 (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Crafts, A. S. Translocation in plants. Plant Physiology. 13 (4), 791 (1938).
- Martens, H. J., Hansen, M., Schulz, A. Caged probes: a novel tool in studying symplasmic transport in plant tissues. Protoplasma. 223, 63-66 (2004).
- Liu, J., Essner, J., Li, J. Hybrid supercapacitor based on coaxially coated manganese oxide on vertically aligned carbon nanofiber arrays. Chemistry of Materials. 22 (17), 5022-5030 (2010).
- Saleem, A. M., et al. Low temperature and cost-effective growth of vertically aligned carbon nanofibers using spin-coated polymer-stabilized palladium nanocatalysts. Science and Technology of Advanced Materials. 16, 015007 (2015).
- Merkulov, V. I., Lowndes, D. H., Wei, Y. Y., Eres, G., Voelkl, E. Patterned growth of individual and multiple vertically aligned carbon nanofibers. Applied Physics Letters. 76 (24), 3555-3557 (2000).
- Retterer, S. T., Melechko, A., Hensley, D. K., Simpson, M. L., Doktycz, M. J. Positional control of catalyst nanoparticles for the synthesis of high density carbon nanofiber arrays. Carbon. 46 (11), 1378-1383 (2008).
- Rooks, M. J., Wind, S., McEuen, P., Prober, D. E. Fabrication of 30-nm-scale structures for electron transport studies using a polymethylmethacrylate bilayer resist. Journal of Vacuum Science & Technology B: Microelectronics Processing and Phenomena. 5 (1), 318-321 (1987).
- Lee, G., Sohn, D. K., Seok, S. H., Ko, H. S. The effect of hole density variation in the PECVD reactor showerhead on the deposition of amorphous carbon layer. Vacuum. 163, 37-44 (2019).
- Fowlkes, J. D., et al. Control of catalyst particle crystallographic orientation in vertically aligned carbon nanofiber synthesis. Carbon. 44 (8), 1503-1510 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved