ラットの正中開腹術による可逆性内臓動脈虚血、静脈うっ血、および複合灌流不良の制御
要約
この記事では、ラットモデルにおける内臓臓器の制御された可逆的な灌流不良の標準化された手順を紹介します。その目的は、技術的な単純さとエラー耐性を維持しながら、高度な方法論的確実性と制御性をもって、これらの誤流状態を誘発することです。
要約
敗血症と悪性腫瘍に加えて、灌流不良は組織劣化の3番目に多い原因であり、さまざまな医学的および外科的状態の主要な病因です。バイパス手術、血管内手術、体外式膜型人工肺、人工代用血液などの大きな進展にもかかわらず、特に内臓の組織灌流は、患者ケアにおいて依然として差し迫った問題となっています。生物医学的プロセスと可能な介入に関するさらなる研究に対する需要は高いです。この種の研究を可能にするためには、有効な生物学的モデルが最も重要です。組織灌流研究には、細胞生物学だけでなく、血管の微小解剖学やレオロジーも含まれる多因子的な側面があるため、適切なモデルには、動物モデルだけが提供できるある程度の生物学的複雑さが必要であり、げっ歯類が選択可能な明白なモデルとなっています。組織灌流不良は、(1)孤立性動脈虚血、(2)孤立性静脈鬱血、(3)複合灌流不良の3つの異なる状態に区別できます。この記事では、ラットの腹部大動脈と大静脈の正中線開腹術とクランプ による これら3種類の内臓灌流障害の制御および可逆的な誘導のための詳細なステップバイステップのプロトコルを提示し、均一で信頼性の高い結果を保証するための正確な外科的方法論の重要性を強調しています。このモデルの可能なアプリケーションの代表的な例としては、消化器、婦人科、泌尿器科の臓器の灌流不良を客観的に視覚化し、区別するためのハイパースペクトルイメージング(HSI)などの革新的な術中イメージングモダリティの開発と検証が含まれます。
概要
局所的または全身的な組織灌流障害の形での組織灌流剥奪の影響は長い間認識されてきましたが、米国とヨーロッパの両方で罹患率と死亡率の主要な原因の1つとして存続しています1。これらの灌流不良状態は、悪性腫瘍と敗血症性炎症に次ぐ組織劣化の3番目に主要な原因ですが、後者の2つと比較してはるかに幅広い起源を持っています2。
このスペクトルは、血栓塞栓性閉塞を伴う心房細動、血管収縮、医原性または外傷性解離などの局所的なメカニズムから、心不全やショック、敗血症、血液量減少、盗み現象などの全身的なメカニズムまで多岐にわたります。これらの多様なメカニズムは、さまざまな医学的および外科的状態の根底にあります。これらの状態に関連する重大な罹患率と死亡率は、壊死を未然に防ぎ、臓器機能を回復させるために、数十年にわたって灌流不良組織への血流を回復させる手順に医学的注意を向けてきました3。
この研究努力は、バイパス手術4、血管内手術5、体外膜型人工肺6,7、移植中の臓器器灌流8、人工血液代替品9の進歩など、生理的臓器灌流を回復するためのさまざまな医薬品、医療、および外科的解決策をもたらしました。
しかし、これらの重要な進展にもかかわらず、特に内臓の灌流不良は、患者ケアにおける差し迫った問題であり、生物医学的プロセスとレスキュー戦略に関するさらなる研究に対する需要は高いです。この種の研究を可能にするためには、有効な生物学的モデルが最も重要です。組織灌流研究には、細胞生物学だけでなく、血管の微小解剖学やレオロジーも含まれる多因子的な側面があるため、適切なモデルには、完全なモデル生物のみが提供できるある程度の生物学的複雑さが必要であり、げっ歯類は当然の選択肢となるモデルです。
組織灌流不良は、孤立性動脈虚血、孤立性静脈鬱血、および複合灌流障害の3つの異なる状態に区別できます10。これらの状態の臨床的に関連するシナリオには、(1) 動脈虚血: 血栓塞栓を伴う心房細動、敗血症性塞栓症、血管収縮、医原性または外傷性血管解離またはクランプ、心不全またはショック、大動脈解離、敗血症および血液量減少、外部狭窄による極端な動脈閉塞、肺動脈塞栓症、慢性動脈血管閉塞性疾患、または盗用現象;(2)静脈うっ血:医原性または外傷性の血管解離または結穹、心不全、肝線維症または肝硬変、外部狭窄による静脈閉塞、静脈血栓症、静脈不全、およびBudd-Chiari症候群;(3)複合灌流不良:虚血性線維症による二次性静脈うっ血や鬱血性貯留による二次性動脈虚血など、上記の状態と前述の状態の進行段階の組み合わせ、および虚血性炎症(虚血性大腸炎など)などの特定の臓器状態11,12。
したがって、この記事では、図 1 に示すように、ラットの正中線開腹術による制御された可逆的な内臓動脈虚血、静脈うっ血、および複合灌流誤を誘発するための段階的なモデルを提供することを目的としています。この実験モデルは、動脈虚血、静脈うっ血、およびそれらの複合的な後遺症の多面的なダイナミクスを研究するための制御された環境を提供し、さまざまな条件で遭遇する臨床的に関連性のあるシナリオをエミュレートします。
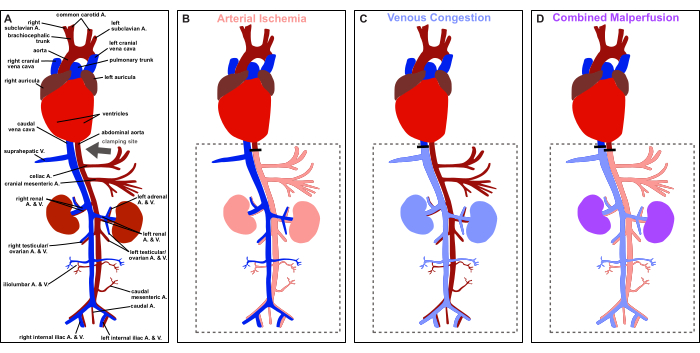
図1:プロトコルの概要。 血管ラットの解剖学的構造の概略図とクランプ部位の描写(灰色の矢印)。(A)生理的灌流。(B)動脈虚血。(C)静脈うっ血。(D)複合灌流不良。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
ここに記載されているすべての動物活動は、認定施設で実施され、ドイツのカールスルーエにあるバーデン・ヴュルテンベルク州地域評議会の動物管理および使用委員会(IACUC)によって承認されました(35-9185.81 / G-62 / 23)。実験動物は、制度上の基準、動物の使用と世話に関するドイツの法律、欧州共同体理事会の指令(2010/63/EU)、およびARRIVEガイドラインに従って管理されました。注文重量400グラムの雄Sprague Dawleyラットを、1週間順応させた後、使用しました。本試験で使用した試薬および装置の詳細は、 材料表に記載されています。
1.麻酔と鎮痛
- 施設のプロトコルに従って、ラットに薬を麻酔します。イソフルランは鎮静の誘導に推奨されます 100 mg / kg体重ケタミンと4 mg / kg体重キシラジンのi.P注射。.追加の鎮痛は、5 mg / kg体重カルプロフェンの皮下注射で達成できます。.詳細については、Studier-Fischer et al.13を参照してください。
- 眼科用軟膏を目に塗布して乾燥を防ぎます。
- 外科用鉗子によるつま先ピンチテストを使用して、適切な鎮痛深さを保証します。
- 手術中の麻酔の深さを定期的に再評価し、調整してください。
2. 手続きの準備
- 取り外し可能な微小血管クランプとアプリケーター(図2A-C)、鈍いオーバーホルトクランプ、細かい準備はさみ、鉗子など、必要なすべての材料と器具を使用してスクラブテーブルを準備します。
- カニューレを先端から1cmの角度で135°の角度で折りたたんで手術準備フックを準備し、ルアーロック を介して プラスチック製の灌流チューブに接続し、外科用蚊クランプを使用して張力を加える準備ができています(図2D、E)。
- Studier-Fischer et al.13で指定されているように、Y字型の固定ロッドと加熱パッドを含むげっ歯類の外科的曝露装置を準備します。
- 新生児用フェイスマスクを使用して100%酸素を吸入 することにより 、適切な酸素化が達成されることを確認します(図2F)。
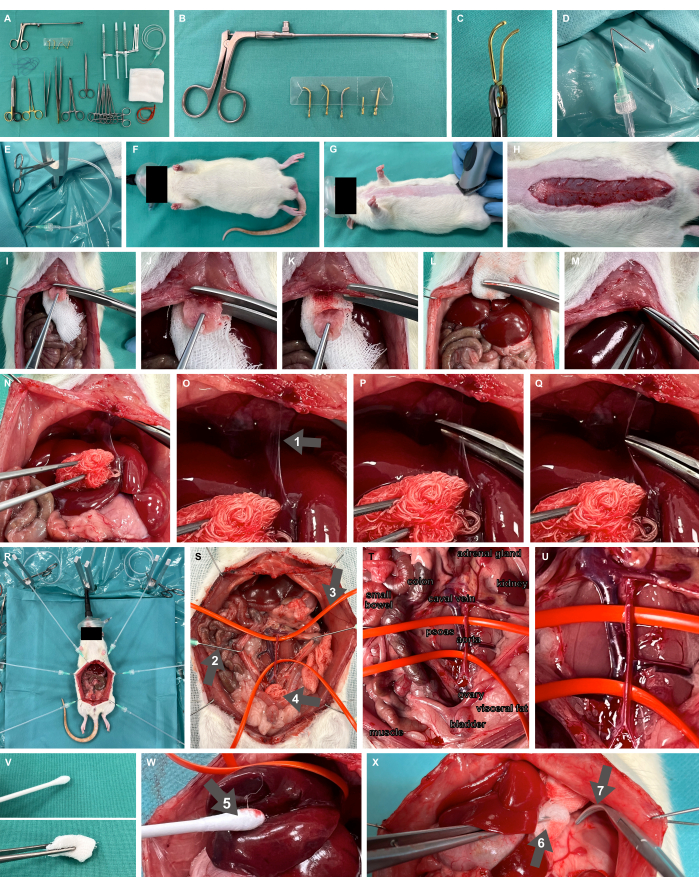
図2:実験装置と動物実験のセットアップ(A)必要な手術器具と材料。(B,C)取り外し可能な微小血管クランプとアプリケーター。(D,E)灌流チューブに接続された折り畳まれたカニューレは、外科的準備フックとして使用されます。(F,G)ネズミモデルにフェイスマスクで酸素を投与し、髭を剃りました。(H)腹部全体の長さにわたる皮膚切開。(I-M)剣状突起の切除と止血。(N-Q)肝動員と鎌状靭帯の解剖(矢印1)。(R)開腹術後の臓器の露出のための準備フックと金属のスタンドの適用。(S)鈍いフック(矢印2)、シリコン血管ループ(矢印3)、および外科的湿布(矢印4)を使用した腹部主要血管の完全な内臓露出。(T,U)腹部大動脈と大静脈。(V)非外傷性調製器具。(W)加湿コットンスワップ(矢印5)。(X)鉗子(矢印6)と鈍いオーバーホルトクランプ(矢印7)の加湿湿布。この図の拡大版を表示するには、ここをクリックしてください。
3. 手術の準備
- 正中線開腹術のために外科的アクセス部位を剃ります(図2G)。目的の腹部の長さ、つまり約7cm(図2H)にわたって皮膚切開を行い、筋膜を解剖して開腹術を進め、付属のプラスチックチューブと外科用蚊クランプで外科用準備フックを皮膚に縫い付けます。手術準備フックを使用して手術現場を露出させ、組織に張力を加えます。
- 腹膜が胸骨の始点から数ミリメートル下までのみ頭蓋で解剖され、腹膜の一部が無傷のままであることを確認してください。外科的湿布の一部を胸骨の下に置き(図2I)、強力な材料ハサミで剣状突起を切除します。外科的湿布を使用して切除領域に圧力をかけ、この十分に灌流された領域の十分な止血を達成します(図2I-M)。
- 肝臓を背尾方向に動員して鎌状靭帯を露出させ(図2N)、靭帯を解剖します(図2O-Q)。
- 止血制御のために、主要な血管のクランプを行う場所に応じて、腹部の主要な血管(図2R)とシリコン血管ループで吊り下げられた血管(図2S-U)の完全な内臓露出を行います。加湿綿スワップ(図2W)、鉗子の加湿湿布、鈍いオーバーホルトクランプ(図2X)など、非外傷性の準備器具のみを使用する必要があります(図2V)。
4. 動脈虚血に対する腹部大動脈の作製と結祥
- 非外傷性調製器具を使用して上腹部臓器の左内側形成を行い、左副腎動脈にアクセスします(図3A-D)。
- 通常、左副腎動脈の頭蓋伸展の内側にある脈動部位を特定し、大動脈の経過を示します(図3E)。腹部大動脈にアクセスするために、鈍的解剖用のオーバーホルトクランプを使用して軟部組織を進行します(図3F、G)。
- 鈍いオーバーホルトクランプ(図3H-L)を使用して腹部大動脈を最も頭蓋端にトンネルし、シリコン血管ループ(図3M-T)を使用して大動脈をスリングします。
- シリコンループを使用して適切な動脈瘤微小血管クランプを適用し、大動脈を腹側にわずかに脱臼させ、動脈瘤微小血管クランプをシリコンループに沿ってガイドして、孤立した大動脈クランプを保証します(図3U)。研究課題によっては、微小血管クランプを再度解放することができます。
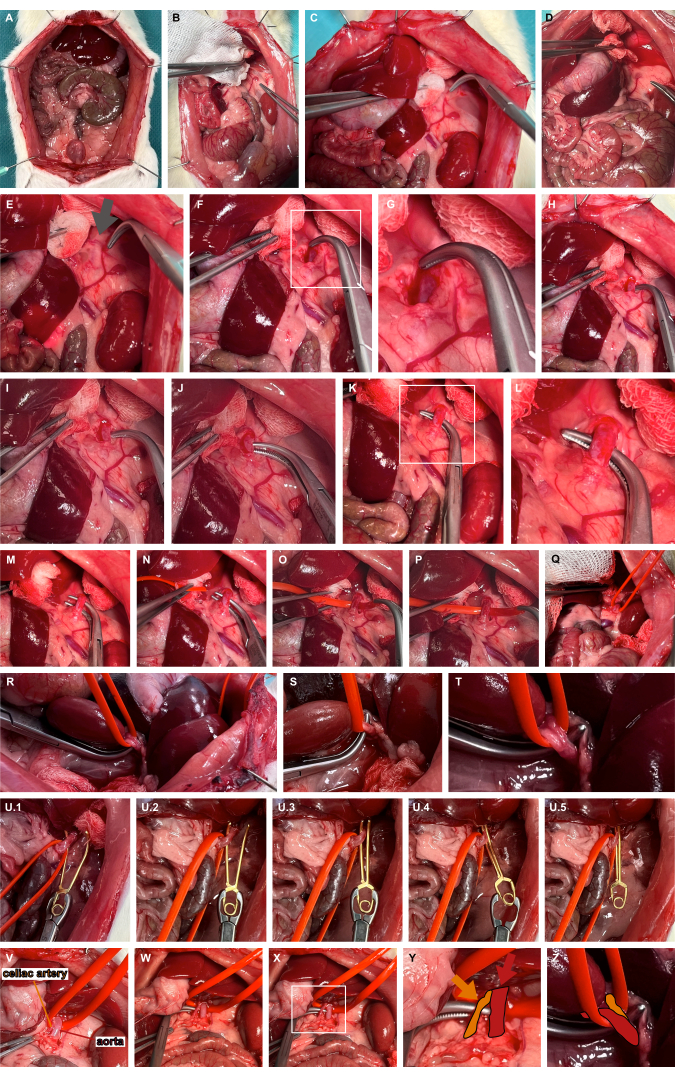
図3:腹部大動脈の準備とクランプ(A)内臓の露出。(B-E)左副腎動脈にアクセスするための非外傷性製剤器具を使用した上腹部臓器の左内側形成。(F,G)腹部大動脈にアクセスするために、脈動部位 (灰色の矢印) で左副腎動脈の内側を鈍く解剖します。(H-L)鈍いオーバーホルトクランプを使用した腹部大動脈のトンネリング。(M-T)シリコン製の血管ループを使用して大動脈を吊り下げます。(U)シリコーンループをガイダンスとして使用した取り外し可能な動脈瘤微小血管クランプの適用。(V-Z)腹腔動脈(オレンジ)を大動脈(赤)とシリコン血管ループを基準にした視覚化。この図の拡大版を表示するには、ここをクリックしてください。
5.静脈うっ血のための肝上腹部腔静脈の準備とクランプ
- 非外傷性調製器具を使用して肝臓を右に動員し、肝靭帯を鋭く解剖し、さらに肝臓を側方化します(図4A-C)。
- 鈍いオーバーホルトクランプを使用して、ダイヤフラムの左心筋で肝後腔を開きます(図4D-G)。
- 鈍いオーバーホルトクランプ(図4H-K)を使用してキャバル静脈をトンネルし、シリコンベッセルループ(図4L-O)を使用してキャバル静脈をスリングします。
- シリコンループを使用して適切な動脈瘤微小血管クランプを適用し、大静脈を腹側にわずかに脱臼させ、動脈瘤微小血管クランプをシリコンループに沿ってガイドして、大静脈の孤立したクランプを保証します(図4R)。
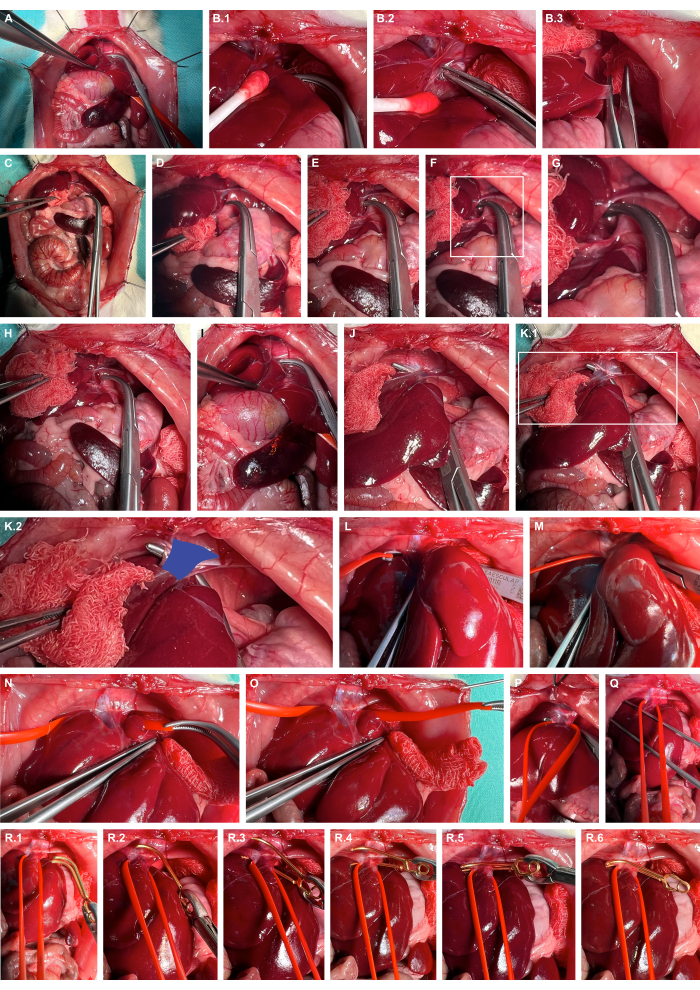
図4:肝上腹部大静脈の準備とクランプ。 (A)頭蓋内臓の露出。(B)肝臓の組織保護動員と非外傷性調製器具を使用した肝臓靭帯の鋭い解剖。(C)肝臓の側方化。(D-G)横隔膜の左腱部での肝後腔の開口部と準備。(H-K)鈍いオーバーホルトクランプを使用したキャバル静脈(青)のトンネリング。(L-O)シリコン製の血管ループを使用してキャバル静脈をスリングします。(P、Q)キャバルの血流を一時的に制限するための緊張の働き。(R)シリコーンループをガイダンスとして使用した取り外し可能な動脈瘤微小血管クランプの適用。この図の拡大版を表示するには、ここをクリックしてください。
6.腹部大動脈と腹部上腹部大静脈のクランプによる複合灌流
- 大動脈と大静脈の両方がシリコン血管ループで吊り下げられるまで、上記の手順を実行します。両方の血管に動脈瘤微小血管クランプを再度適用し、シリコンループをガイダンスとして使用します。最初に大動脈をクランプし、その後のキャバルクランプまでに必要な時間を数秒に抑えることをお勧めします。
注:所望のシナリオと研究目的に応じて、灌流不良は定義された期間を超えて継続または解放することができ、動物は鋭い心臓摘出術(施設が承認したプロトコルに従う)によって安楽死させることができる 非生存アプリケーションの場合、または計画されたフォローアップと生存実験の場合には外科的縫合糸を使用して段階的な腹部閉鎖を受けることができる。本研究では、動物を安楽死させました。
結果
このプロトコルは、非生存環境の10匹の雄ラット(平均体重403g±26g)で実施されました。成功率は、動脈クランプ、静脈クランプ、および5分間の併用クランプと10分間の再灌流の併用クランプの20分後の生存率によって定義され、それぞれが100%でした。皮膚切開から両方の血管がシリコンループで吊り下げられるまでの調製の平均期間は、11分45秒±3分23秒であった。
4つの異なる灌流異常状態を検証するために、5つの内臓にわたるハイパースペクトルイメージング(HSI)を使用して、酸素化(StO2)および灌流(NIR)の指標パラメータを測定しました(図5)。
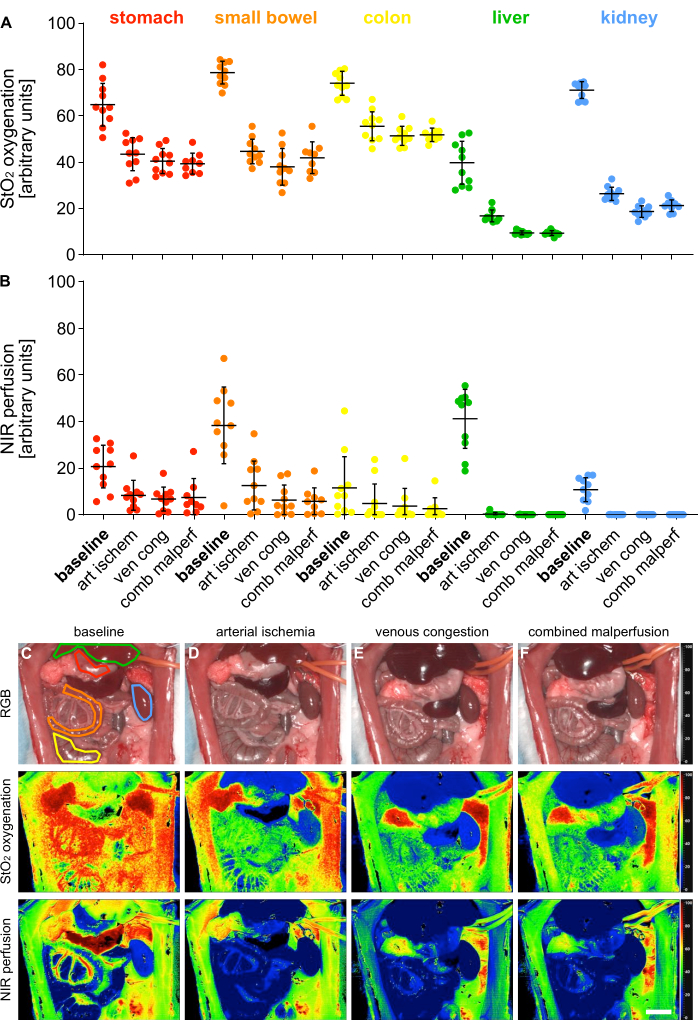
図5:灌流不良モデルの検証 (A,B) n = 10匹の動物を用いた4つの異なる灌流状態と5つの異なる内臓におけるHSIの酸素化と灌流値の定量化。(C-F)4つの異なる灌流状態にわたる内臓を含むHSI記録のRGBおよび色分けされたインデックス画像。エラーバーは標準偏差を示します。スケールバーは5cmを示しています。この図の拡大版を表示するには、ここをクリックしてください。
値は任意の単位で提供され、生理学的臓器の状態と比較して、灌流不良状態の有意な減少が示されました(表1)。ハイパースペクトルの結果は、組織の生存率と灌流を、この研究で見られた値と一致する臓器特異的なHSI StO2カットオフ値を使用して評価できることを示す最近の出版物と一致していました14,15。例えば、胃では、生理的灌流が64.1%(±9.4%)、動脈虚血が43.1%(±7.4%)、静脈うっ血が40.5%(±5.4%)、複合灌流が39.3%(±4.5%)であった。
これらは非生存実験であったため、動物の長期的な結果に関する実験データはありません。しかし、他の研究では、上腸間膜動脈クランプ16,17を30分および60分受けたラットの24時間にわたる100%および57%の生存率が報告されており、それを熱ショックタンパク質70の血清レベルとうまく相関させています。したがって、これは、異なるクランプ時間に従って将来の生存研究の結果を評価するための可能な方法である可能性があります。
| パラメーター | 器官 | ベースライン | 動脈虚血 | 静脈のうっ血 | 複合灌流不良 |
| ストリウム2 | 胃 | 64.1%(±9.4%) | 43.1%(±7.4%) | 40.5%(±5.4%) | 39.3%(±4.5%) |
| 小腸 | 78.4%(±5.1%) | 44.8%(±5.5%) | 38.0%(±7.9%) | 41.9%(±6.9%) | |
| コロン | 74.6%(±5.0%) | 56.0%(±6.3%) | 51.3%(±4.1%) | 51.8%(±2.9%) | |
| 肝臓 | 39.5%(±9.7%) | 16.9%(±2.6%) | 9.5%(±0.8%) | 9.3% (±1.1%) | |
| 腎臓 | 71.0%(±3.8%) | 26.3%(±3.0%) | 18.6%(±2.5%) | 21.2%(±2.6%) | |
| 近赤外 | 胃 | 20.0%(±9.3%) | 8.3% (±6.7%) | 6.8%(±5.1%) | 7.5%(±8.1%) |
| 小腸 | 38.6%(±17.4%) | 12.9%(±11.0%) | 6.3%(±6.5%) | 5.7%(±5.9%) | |
| コロン | 12.6%(±13.7%) | 5.3% (±8.7%) | 3.8%(±7.5%) | 2.6%(±4.7%) | |
| 肝臓 | 40.4%(±13.1%) | 0.3% (±0.7%) | 0.0%(±0.1%) | 0.0%(±0.0%) | |
| 腎臓 | 10.4%(±5.2%) | 0.0%(±0.0%) | 0.0%(±0.1%) | 0.0%(±0.0%) |
表1:組織パラメータ。 HIS StO2 酸素化と NIR 灌流の値は、5 つの内臓と 4 つの異なる灌流状態にわたる任意の単位で得られます。
ディスカッション
末梢動脈閉塞性疾患 (PAOD) だけでも、組織灌流障害の最も顕著な代表として、すでに約 7% の有病率があり、米国だけで推定 850 万人の成人が罹患しています18、一般に、組織灌流障害は、外科的および医学的状態の大部分に関連する病因です。したがって、この分野における新たな研究課題に取り組むためには、適切で再現性のある動物モデルが絶対に必要です。
特徴的な調査が必要な3つの血管動態状況は、動脈虚血、静脈うっ血、および複合灌流不良です。孤立した動脈虚血を誘発することにより、科学者は組織低酸素症の時間的および空間的進行を正確に描写し、虚血再灌流障害、細胞アポトーシス、および炎症反応に関与する分子カスケードを調査できます。血管病理学の見過ごされがちな側面である静脈ドレナージを損なうことで、科学者は動脈流入と静脈流出の不一致の相互作用を調査し、静脈血栓症、うっ血関連組織浮腫、微小循環機能障害の病態生理学に光を当てることができます。これらの病理学的状況の両方を組み合わせると、急性腸間膜虚血や虚血性大腸炎などの臨床症候群で遭遇する複雑な病態生理学を反映して、複合灌流不良の相乗効果不全環境を調査できます。
基本的な病態生理学的メカニズムを解明するだけでなく、ラットの内臓動脈虚血、静脈うっ血、および複合灌流障害を誘発する能力は、薬理学的介入、外科的技術、新しい治療戦略、および特にHSI 14,19,20,21,22などの革新的なイメージングモダリティの有効性を評価するための不可欠なプラットフォームとして機能します.したがって、このモデルは、組織評価と灌流状態の同定においてHSIの可能性を最大限に活用するために必要な生体組織のグラウンドトゥルースを提供する上で重要な要素です。この実験設定を活用することで、研究者は前臨床所見を臨床的に実行可能な戦略に迅速に変換し、最終的には多様な血管障害や灌流障害に関連する罹患率と死亡率を減らすことができます。
例示的に、研究者はこのモデルを使用して、抗酸化物質、抗炎症剤、血管拡張薬などの虚血再灌流障害経路を標的とする薬理学的薬剤の有効性を調査でき、それによって臨床診療におけるそれらの潜在的な有用性を描写できます23,24。さらに、このモデルは、腸間膜血行再建術や静脈減圧術などの新しい外科的アプローチの評価を容易にし、それらの実現可能性、安全性、および長期的な有効性についての貴重な洞察を提供します25,26。
さらに、この実験的枠組みにより、研究者は血管機能障害と糖尿病、高血圧、アテローム性動脈硬化症などの全身性併存疾患との間の複雑な相互作用を探求することができ、それによって血管疾患の進行を指揮する相互接続された病態生理学的経路の複雑な網の目を示すことができる27,28。
ラット32,33では、肝臓29,30,31や腎臓などの単一臓器の選択的灌流に関するいくつかの出版物がありますが、ラットの完全な内臓の灌流不良を扱った科学文献は不足しており、明確な方法論的なプロトコルはありません。したがって、これがこの原稿の主張です。提示された技術の限界は、主に、処置の侵襲性を含み、灌流不良の期間によっては、連続的な臓器血栓症、および機能不全、多臓器不全または腹部コンパートメント症候群34,35,36による術後罹患につながる可能性がある。慎重な計画と設計は、研究課題に応じて、必要な灌流不良の期間とその病態生理学的結果のバランスをとるのに役立ちます。
手順中に遭遇する一般的な問題をトラブルシューティングするときは、次の点と推奨事項に注意を払う必要があります:(1)手順中の中断を最小限に抑えるために、事前に機器と薬の徹底的な準備を確保します。(2)無血管面を入念に準備し、解剖することにより、細心の注意を払って止血制御を行います。可能であれば、電気止血にバイポーラ止血鉗子を使用することを検討してください。(3)肝実質と接触する際に、加湿綿棒や鉗子による加湿外科用湿布などの非外傷性器具を使用して、組織への外傷を最小限に抑えます。(4)動物の約20%が、デリケートな組織条件によるびまん性表在性肝実質出血を経験した。しかし、出血はすべての場合で軽い圧迫と忍耐力で止まりました。これらの推奨事項は、ラットモデルにおける誤灌流の誘導中の手続きの効率を高め、合併症を最小限に抑えることを目的としています。
騎兵脈へのアクセスを改善するために剣状突起を切除するときは、剣状突起と胸骨の間の移行部に対する腹膜背側が数ミリメートルにわたって無傷のままであることを確認してください。剣状突起の切除部位は硬くて鋭く、表在性肝実質に外傷を引き起こす可能性があります。したがって、胸骨後腹膜を鉗子を使用して尾側に動員し、骨の切り株を効果的に巻き付けて骨の切り株を覆い、止血をサポートすることをお勧めします。外科的準備フックは、剣状突起の腹膜被覆が所定の位置に留まるように、頭蓋の張力で頭蓋腹腹壁に縫い付けられるべきです。
鎌状靭帯を解剖するときは、動物にとって致命的となる可能性があるため、誤って肝静脈に医原性損傷を引き起こさないように注意する必要があります。血管の準備中に出血するリスクが高いため、外科的準備の大部分は、鋭利な解剖器具を使用するのではなく、鈍いオーバーホルトクランプで広げることによって行うことをお勧めします。さらに、シリコーン血管ループは、表面の摩擦を減らし、組織の外傷のリスクを最小限に抑えるために、使用前に湿らせる必要があります。
動脈瘤微小血管クランプを適用するときは、正確な血管の解剖学的構造を視覚化することが重要です。たとえば、腹腔動脈は腹部大動脈から非常に頭蓋状に発生します。肝灌流障害の調査など、腹腔閉塞が望ましい場合は、大動脈とシリコーン血管ループを参照して腹腔動脈を視覚化する必要があります。これにより、腹腔動脈がクランプされた血管組織に含まれることが保証されます(図2V-Z)。クランプが最初に腹腔動脈に対して尾側に配置されたのは偶然のケースが1つありました。しかし、StO2肝臓の値の低下が欠落していたため、これはすぐに認識され、適切なリクランプが成功裏に行われました。
最も危険な準備ステップは、キャバル静脈のトンネル掘削です。このステップには穏やかな動きと忍耐が必要であり、オーバーホルトクランプは、キャバル静脈との接触がないことが確実な場合にのみ広げる必要があります。わずかな圧迫が加えられると、大静脈は薄い無血管結合組織として現れ、含まれている血液が両方向に消えるため、これを判断するのは難しい場合があります。また、大静脈を頭蓋骨にトンネルを掘りすぎると、誤って胸膜が開き、気胸が生じるリスクもあります。これは、特に動物が自発的に呼吸しており、侵襲的な呼吸器対策を講じることができないため、深刻で生命を脅かす合併症になる可能性があります。この合併症を避けるために、調製器具をわずかに引っ込めて、より尾側に進むことが役立つことがわかっています。肝臓の横隔膜が膨らんでいる血行力学に関連し、目に見える気胸の場合、30 G の針と小さな注射器を使用して、横隔膜を 1 回穿刺し、閉じ込められた空気を吸引することがレスキュー戦略として推奨されます。この技術は、術中にそれを救うために1匹の動物で成功裏に採用されました。
最後に、微小血管クランプを適用するときは、周囲の結合組織を含めないように特別な注意を払う必要があります。これにより、目的の血管が不十分に閉塞する可能性があります。
このプロトコルは、全体的な内臓灌流障害の段階的なガイドとして意図されていますが、図 1T-V に示されている広範な血管の準備と動員により、特定の研究課題に応じてクランプ部位を調整できます。したがって、臓器群または単一の臓器の選択的灌流不良は、血管系に沿ってさらに遠位にクランプ部位を選択する場合の選択肢でもあります。たとえば、肝虚血のために腹腔幹を選択的にクランプします。このプロトコルは、詳細で再現性のある方法論を提供することにより、ラットモデルにおける制御可能な可逆性動脈虚血、静脈うっ血、および複合灌流不良の標準化されたアプローチを促進し、データの信頼性、堅牢性、研究者の独立性、および将来の動物研究との比較可能性の向上につながります。その結果、これは生物医学研究の武器庫内で不可欠なツールであり、血管の損傷、組織損傷、および治療的介入の間の複雑な相互作用についての洞察を提供します。この実験セットアップの多様性を活用することで、研究者は血管の病態生理学にまつわる謎を調査し、トランスレーショナル医療の新たなフロンティアを切り開き、最終的には血管の健康の領域における患者の転帰を向上させることができます。
開示事項
何一つ。
謝辞
著者らは、バーデン・ヴュルテンベルク州科学研究芸術省(MWK)とドイツ研究財団(DFG)が助成金INST 35/1314-1 FUGGおよびINST 35/1503-1 FUGGを通じて支援しているデータストレージサービスに感謝SDS@hd。さらに、著者らは、NCT(ドイツのハイデルベルクにある国立腫瘍疾患センター)から、構造化されたポスドクプログラムと外科腫瘍学プログラムを通じて支援されていることに感謝しています。また、バーデン・ヴュルテンベルク州議会が承認したイノベーション・キャンパス・ヘルス+ライフサイエンス・アライアンス・ハイデルベルク・マンハイムの支援を、Alexander Studier-Fischer: Artificial Intelligence in Health(AIH)の構造化ポスドク・プログラムから受けたものに感謝します - DKFZ、EMBL、ハイデルベルク大学、ハイデルベルク大学病院、マンハイム大学病院、メンタルヘルス中央研究所の協力 マックスプランク医学研究所。さらに、マンハイム大学医療センターのDKFZヘクターがん研究所を通じた支援に感謝します。出版料については、Deutsche Forschungsgemeinschaftの「Open Access Publikationskosten」およびハイデルベルク大学からの財政的支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| Blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| Cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| Fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| Heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| Preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2,5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
参考文献
- Carden, D. L., Granger, D. N. Pathophysiology of ischemia-reperfusion injury. J Pathol. 190 (3), 255-266 (2000).
- Balkwill, F., Mantovani, A. Inflammation and cancer: Back to Virchow. Lancet. 357 (9255), 539-545 (2001).
- Cruz, R. J., Garrido, A. G., Ribeiro, C. M., Harada, T., Rocha-E-Silva, M. Regional blood flow distribution and oxygen metabolism during mesenteric ischemia and congestion. J Surg Res. 161 (1), 54-61 (2010).
- Leng, G. C., Davis, M., Baker, D. Bypass surgery for chronic lower limb ischemia. Cochrane Database Syst Rev. 3, Cd002000 (2000).
- Droc, I., Calinescu, F. B., Droc, G., Blaj, C., Dammrau, R. Aortic stenting. Minim Invasive Ther Allied Technol. 24 (5), 296-304 (2015).
- Le Gall, A., et al. Veno-arterial-ecmo in the intensive care unit: From technical aspects to clinical practice. Anaesth Crit Care Pain Med. 37 (3), 259-268 (2018).
- Napp, L. C., Kühn, C., Bauersachs, J. ECMO in cardiac arrest and cardiogenic. Herz. 42 (1), 27-44 (2017).
- Sousa Da Silva, R. X., Weber, A., Dutkowski, P., Clavien, P. A. Machine perfusion in liver transplantation. Hepatology. 76 (5), 1531-1549 (2022).
- Sen Gupta, A. Bio-inspired nanomedicine strategies for artificial blood components. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (6), 1464 (2017).
- Lu, D., et al. Intramuscular microvascular flow sensing for flap monitoring in a porcine model of arterial and venous occlusion. J Reconstr Microsurg. 39 (3), 231-237 (2023).
- Nguyen, G. K., et al. Novel biomarkers of arterial and venous ischemia in microvascular flaps. PLoS One. 8 (8), e71628 (2013).
- Redlin, M., et al. How near-infrared spectroscopy differentiates between lower body ischemia due to arterial occlusion versus venous outflow obstruction. Ann Thorac Surg. 91 (4), 1274-1276 (2011).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. (205), e66684 (2024).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. , 106908 (2023).
- Barberio, M., et al. Quantitative fluorescence angiography versus hyperspectral imaging to assess bowel ischemia: A comparative study in enhanced reality. Surgery. 168 (1), 178-184 (2020).
- Doukas, P., et al. Onset of adverse abdominal events due to intestinal ischemia-reperfusion injury after aortic cross-clamping is associated with elevated hsp70 serum levels in the early postoperative phase. Int J Mol Sci. 23 (23), 15063 (2022).
- Mine, Y., et al. Heat shock protein 70 messenger RNA in rat leukocytes elevates after severe intestinal ischemia-reperfusion. J Surg Res. 242, 342-348 (2019).
- Criqui, M. H., et al. Lower extremity peripheral artery disease: Contemporary epidemiology, management gaps, and future directions: A scientific statement from the American Heart Association. Circulation. 144 (9), e171-e191 (2021).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488 (2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Scientific Data. 10 (1), 414 (2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028 (2022).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Malekinejad, Z., et al. Prazosin treatment protects brain and heart by diminishing oxidative stress and apoptotic pathways after renal ischemia-reperfusion. Drug Res (Stuttg). 72 (6), 336-342 (2022).
- Feldman, Z. M., et al. Inferior mesenteric artery revascularization can supplement salvage of mesenteric ischemia. J Vasc Surg Cases Innov Tech. 9 (3), 101041 (2023).
- Munley, J. A., et al. Chronic mesenteric ischemia-induced intestinal dysbiosis resolved after revascularization. J Vasc Surg Cases Innov Tech. 9 (2), 101084 (2023).
- Lejay, A., et al. Ischemia reperfusion injury, ischemic conditioning and diabetes mellitus. J Mol Cell Cardiol. 91, 11-22 (2016).
- Huang, D., et al. Macrovascular complications in patients with diabetes and prediabetes. Biomed Res Int. 2017, 7839101 (2017).
- Liu, A., et al. Hmgb1 in the ischemic and non-ischemic liver after selective warm ischemia/reperfusion in rats. Histochem Cell Biol. 135 (5), 443-452 (2011).
- Koc, S., Dogan, H. O., Karatas, O., Erdogan, M. M., Polat, V. Mitochondrial homeostasis and mast cells in experimental hepatic ischemia-reperfusion injury of rats. Turk J Gastroenterol. 33 (9), 777-784 (2022).
- Chu, M. J., Vather, R., Hickey, A. J., Phillips, A. R., Bartlett, A. S. Impact of ischaemic preconditioning on experimental steatotic livers following hepatic ischemia-reperfusion injury: A systematic review. HPB (Oxford). 17 (1), 1-10 (2015).
- Chang, M. W., et al. Sitagliptin protects rat kidneys from acute ischemia-reperfusion injury via upregulation of GLP-1 and GLP-1 receptors. Acta Pharmacol Sin. 36 (1), 119-130 (2015).
- Boys, J. A., Toledo, A. H., Anaya-Prado, R., Lopez-Neblina, F., Toledo-Pereyra, L. H. Effects of dantrolene on ischemia-reperfusion injury in animal models: A review of outcomes in heart, brain, liver, and kidney. J. Investig Med. 58 (7), 875-882 (2010).
- Orihashi, K. Mesenteric ischemia in acute aortic dissection. Surg Today. 46 (5), 509-516 (2016).
- Byard, R. W. Acute mesenteric ischemia and unexpected death. J Forensic Leg Med. 19 (4), 185-190 (2012).
- Łagosz, P., Sokolski, M., Biegus, J., Tycinska, A., Zymlinski, R. Elevated intra-abdominal pressure: A review of current knowledge. World J Clin Cases. 10 (10), 3005-3013 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved