このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
大槽マウスでの脳脊髄液のシリアル収集のためのテクニック
要約
ADのトランスジェニック(Tg)マウスモデルでは、病気は人間の患者で進行するにつれてどのように、なぜCSFの変化でAβやタウのレベルを調査するために素晴らしい機会を提供しています。ここで、我々は、マウスからシリアルCSFのサンプリングのための洗練された大槽穿刺のテクニックを示しています。
要約
アルツハイマー病(AD)は、病理学的にβ-アミロイドペプチド(Aβ)と過リン酸化タウタンパク質の神経細胞内蓄積の細胞外沈着によって特徴づけられる進行性神経変性疾患である。脳脊髄液(CSF)は脳の細胞外空間と直接接触しているので、それは病理学的プロセスに対応して脳内の生化学的変化を反映しています。これらの変化の原因のメカニズムはまだ完全には理解されていないものの、AD患者のCSFは、42アミノ酸Aβ(Aβ42)の形態、および総タウと過リン酸化タウの増加の減少を示しています。 ADのトランスジェニック(Tg)マウスモデルでは、どのように、なぜAβやタウのレベルCSFの変化で病気の進行状況に応じて調査する絶好の機会を提供しています。ここで、我々は、マウスからの脳脊髄液のサンプリングのための洗練された大槽穿刺のテクニックを示しています。この非常に穏やかなサンプリング手法は、シリアルCSFのサンプルが大幅にそれが可能な時間をかけて微妙な変化を検出すること、Aβまたはタウのレベルでの間に、マウスの変動の交絡影響を最小化する2〜3カ月ごとに同一のマウスから取得することを可能とする。 AβとタウELISAとの組み合わせで、この手法は、ADのマウスモデルにおける脳内のCSFAβ42とタウのレベルとの関係、およびそれらの代謝を調査するために設計された研究に有用となります。 Tgマウスの研究では、監視の病気の進行のための生物学的マーカーとして使用されるCSFのAβやタウのレベルの潜在的なまでに重要な検証を提供することができる、そして治療的介入の効果を監視する。マウスを屠殺することができ、脳の生化学的または組織学的変化を調べることができるように、CSFの変化のメカニズムは良く評価することができる。これらのデータは、ヒトADの脳脊髄液の変化の解釈のために有益であると思われる。
プロトコル
ガラスキャピラリーチューブを引っ張る
- ガラスキャピラリーチューブはサターインストゥルメント社(ホウケイ酸ガラス、B100 - 75 - 10)から購入しています。
- 300で設定された熱指数と330で設定された圧力の指数で、マイクロピペットプラー迸るサターP - 87キャピラリーチューブを引き出します。
- テーパー先端が約0.5 mmの内径を持つように、はさみでガラスキャピラリーチューブの先端を切り取ります。
CSFのための大槽穿刺法
CSF試料は、大槽(図1)1以前に発表されたメソッドを使用してから取得されます。 
図1
1。マウスは、ケタミン(100mg/kg)とキシラジン(10mg/kgより少ない)、腹腔内投与によってanesthesizedされています。麻酔導入の時間の間に、マウスは37℃のインキュベーター内で保持されます。
2。首の皮膚を剃毛され、そしてマウスは、加温パッドの直接接触を持つ定位固定装置に発生しやすく配置されます。加熱パッドから発生する熱が体温の変化に応じて調整されるように直腸温度プローブを直腸に挿入されます。ヘッドは、ヘッドアダプタで固定されています。手術部位は7 0%エタノール(3回繰り返す) に続いて、10%ポビドンヨードでswabbedされ、そして皮膚の矢状切開は、後頭部に劣って行われます。
3。解剖顕微鏡下で、皮下組織や筋肉が(M.二腹のcervicisとmの頭直背大手 )鉗子で鈍的切開で区切られています。 microretractorsのペアは離れて筋肉を保持するために使用されます。
4。マウスは頭部がボディとほぼ135 Oの角度を形成するように定められている。
5。解剖顕微鏡下で、大槽の硬膜は、延髄と主要な血管(動脈背棘)、およびCSF領域が(図2)表示するかを介して輝くと明確な逆三角形として表示されます。 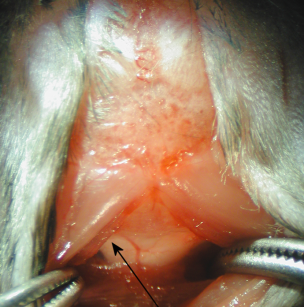
図2
6。硬膜は、滅菌綿棒で乾燥したブロットされています。背動脈の棘(図2)に横方向の硬膜を介してチテルナマグナにキャピラリーチューブを貫通する。キャピラリーチューブの挿入に抵抗の顕著な変化に続いて、CSFは、キャピラリー管に流れる。
7。慎重にキャピラリーチューブを取り外し、および1mm内径を持つポリエチレンチューブを介して3 mlシリンジに接続してください。事前にマーク0.5ミリリットルエッペンドルフチューブにCSFを注入し、直ちにドライアイスでチューブを凍結し、-80℃の冷凍庫にそれを転送する。
8 CSFのサンプリングの後、筋肉が再整列されており、皮膚が(4-0、エチコン、ジョンソン&ジョンソン)縫合されています。 0.9%塩化ナトリウムの約1mlは、デハイドレーションを防止するために皮下注射される。マウスは、それが回復するまで体温を維持するためにインキュベーターに保たれ、マウスの体重は1日、および手術後1週間を監視されます。
結果と考察
我々は、検出可能なプラズマ汚染することなくマウスからのCSFのシリアルサンプリングするための信頼性の高いプロトコルを説明。
1。全体の手順は、通常、マウスあたり10分(麻酔を含む)を取ります。 CSF得られたの体積は、マウス系統に依存しています。 P301L(JNPL3)マウス3が約10μL-15μlの収率を得たながら、我々は2を使用したPS / APPダブルTgマウスでは、平均的な量は、約5μL(3〜7μL)です。シリアルサンプリングの場合は、7-8μlの最大は、安全に2-3ヶ月の間隔でそれぞれの時間を撮影することができます。
2。手術中は、それは大槽の硬膜を十分に露出することができるように定位固定フレーム上で適切にマウスの頭と体を配置することが重要です。アポ4の免疫ブロットによりCSFのサンプルで監視できる血漿タンパク質、からの汚染を防ぐためにキャピラリチューブを硬膜を貫通するときに慎重に血管を避けてください。
3。組織の癒着は、以下のサンプリングのための素因出血によって難易度を増加させることができるように各手術時の組織損傷を最小限に抑えることは、重要です。
4。麻酔によって引き起こされる低体温が大幅に非常に急速に5を 、脳内のリン酸化タウのレベルに影響する可能性があるため、体温がうまく手術中に維持される必要があります。
5。抗体ELISAプロトコルと我々が使用した抗体は、Refoloらに詳細に記載された。6。 1:50-1:60に希釈したときにPS / APPマウスからの脳脊髄液の二液は、満足のいく結果が得られます。タウELISAの場合は、P301L(JNPL3)マウス4から5μlのCSFは十分です総タウの検出、またはタウ 蛍光体は、トレオニンでylated 231(キットはバイオソースから購入されています)。
6。この手法は、脳脊髄液の少量が必要なアッセイには十分となっている神経疾患、の他のマウスモデルに適用することができます。
ディスカッション
我々は、検出可能なプラズマ汚染することなくマウスからのCSFのシリアルサンプリングするための信頼性の高いプロトコルを説明。
1。全体の手順は、通常、マウスあたり10分(麻酔を含む)を取ります。 CSF得られたの体積は、マウス系統に依存しています。 P301L(JNPL3)マウス3が約10μL-15μlの収率を得た一方、PS / APPダブルTgマウスではused2、平均容積は、約5μL(3〜7μL)です。シリアルサンプリング?...
謝辞
私たちの活動は、NIHの助成金NS048447とAG017216to KDによってサポートされています。里六は、オリジナルのプロトコルの開発中に、彼の監督と支援のために博士ヘイッキTanilaを(クオピオ大学、クオピオ、フィンランド)に感謝いたします。
参考文献
- Liu, L., et al. Longitudinal observation on CSF Abeta42 levels in young to middle-aged amyloid precursor protein/presenilin-1 doubly transgenic mice. Neurobiol Dis. 17, 516 (2004).
- Holcomb, L., et al. Accelerated Alzheimer-type phenotype in transgenic mice carrying both mutant amyloid precursor protein and presenilin 1 transgenes. Nat Med. 4, 97 (1998).
- Lewis, J., et al. Neurofibrillary tangles, amyotrophy and progressive motor disturbance in mice expressing mutant (P301L) tau protein. Nat Genet. 25, 402 (2000).
- DeMattos, R. B., et al. Plaque-associated disruption of CSF and plasma amyloid-beta (Abeta) equilibrium in a mouse model of Alzheimer's disease. J Neurochem. 81, 229 (2002).
- Planel, E., et al. Anesthesia leads to tau hyperphosphorylation through inhibition of phosphatase activity by hypothermia. J Neurosci. 27, 3090 (2007).
- Refolo, L. M., et al. A cholesterol-lowering drug reduces beta-amyloid pathology in a transgenic mouse model of Alzheimer's disease. Neurobiol Dis. 8, 890 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved