새로운 펌프리스 유체 시스템을 사용한 눈의 다양한 조직 및 세포 유형 유지 및 평가
요약
살아있는 조직의 실시간 분석은 중요한 기능 및 기계론적 데이터를 제공합니다. 이 백서에서는 광범위한 조직 및 세포 모델을 유지 관리하고 평가하는 새롭고 펌프가 필요 없는 다중 채널 유체 시스템을 통해 정확하고 재현 가능한 데이터 생성을 보장하기 위한 프로토콜과 중요한 변수에 대해 설명합니다.
초록
조직 기능 및 세포 생물학을 조사하는 데 사용되는 많은 시험관 내 모델에는 기능 및 생존력 유지에 필요한 적절한 산소 공급과 최적의 세포 조건을 제공하기 위해 배지 흐름이 필요합니다. 이를 위해 당사는 배양 중인 조직과 세포를 유지하고 인라인 센서 및/또는 유출 분획 수집을 통해 기능과 생존력을 지속적으로 평가하기 위한 다중 채널 유동 배양 시스템을 개발했습니다. 이 시스템은 산소 소비율에 대한 8채널 연속 광학 감지와 내장된 분획 분취기를 결합하여 대사 산물의 생산 속도와 호르몬 분비를 동시에 측정합니다. 섬, 근육 및 시상하부를 포함한 광범위한 조직 및 세포 모델을 유지하고 평가할 수 있지만, 여기서는 분리된 마우스 망막, 마우스 망막 색소 상피(RPE)-맥락막-공막 및 배양된 인간 RPE 세포의 생체 에너지 조절을 조사하는 데 사용한 작동 원리와 실험 준비/프로토콜을 설명합니다. 펌프가 없는 유체 흐름과 같은 시스템 설계의 혁신은 다중 채널 흐름 시스템의 작동을 크게 단순화했습니다. 실험을 위해 기기를 조립하고, 준비하고, 다양한 조직/세포 모델을 융합 주위 챔버에 로드하는 방법을 보여주는 비디오와 이미지가 표시됩니다. 또한 일관되고 안정적인 배양 조건을 얻기 위한 올바른 유속 대 조직 비율 설정과 소비 및 생산 속도의 정확한 결정을 포함하여 프로토콜 및 조직 특이적 실험을 위한 조건 선택 지침을 설명하고 논의합니다. 최적의 조직 유지 관리와 여러 매개변수의 실시간 평가의 조합은 눈의 생리학 연구 및 시력 장애 치료를 위한 약물 발견에 큰 도움이 될 매우 유익한 데이터 세트를 생성합니다.
서문
주위 융합 시스템은 생명 과학 분야에서 오랜 역사를 가지고 있습니다. 특히, 섬에 의한 분비 기능 연구를 위해 분비물에 대한 반응으로 인슐린 분비의 동역학을 규명하는 데 사용되어 왔다1. 호르몬 및 대사 산물의 후속 분석을 위해 유출 분획을 수집하는 것 외에도 주로 산소 소비량감지를 위해 실시간 센서가 통합되었습니다 2,3,4. 눈의 질환을 매개하는 기전을 더 잘 이해하기 위한 광범위한 노력은 망막, 망막 색소 상피(RPE)-맥락막-공막 및 배양된 RPE 세포를 포함한 눈의 다양한 분리된 구성 요소의 대사 조절 및 조절 장애를 평가하기 위한 생리학적으로 관련된 방법의 부족으로 인해 제한되었습니다. 배양된 세포를 위해 설계된 정적 시스템은 조직5에 맞게 조정되었지만, 조직에는 적절한 산소 공급을 위한 흐름이 필요합니다. 유량 시스템은 망막 및 RPE-맥락막-공막에 의한 산소 소비율(OCR)의 실시간 반응을 정확하고 재현성 있게 측정하는 데 성공했으며, 조직은 8시간 이상 대사적으로 안정적으로 유지되어 여러 테스트 화합물을 포함하는 매우 유익한 프로토콜을 가능하게 합니다 4,6,7,8,9 . 그럼에도 불구하고 유체 시스템의 작동에는 역사적으로 맞춤형 장치와 표준화되지 않은 방법론에 대한 훈련된 기술 직원이 필요했습니다. 이러한 시스템은 대부분의 실험실에서 표준 방법론으로 채택되지 않았습니다. BaroFuse는 새로 개발된 유체 시스템으로, 펌프가 아닌 가스 압력에 의존하여 여러 채널과 조직 챔버를 통해 흐름을 유도합니다(그림 1). 각 채널은 OCR을 위해 지속적으로 모니터링되며, 후속 내용물 분석을 위해 플레이트 기반 분획 분취기로 유출을 수집합니다. 중요한 것은 기기의 조직 주위 챔버가 다양한 형상과 크기의 조직을 수용할 수 있도록 설계되었다는 것입니다.
이 기기의 핵심은 유체 시스템으로, 밀폐된 가압 저장소에서 작은 내경(ID) 튜브(유체 회로에서 가장 큰 흐름 저항을 제공함)를 통해 조직을 수용하는 유리 조직 챔버로 흐름이 구동됩니다. 매체 저장소 모듈(MRM)에 대한 압력은 가스 혼합물(일반적으로 21% O2, 5% CO2, 균형N2)을 포함하는 가스 실린더에 연결된 저압 및 고압 조절기에 의해 공급되며, 저장소는 조직 챔버 어셈블리(TCA)를 고정하는 주입 주변 챔버 모듈(PCM)에 의해 상단에서 밀봉됩니다. 유량은 저항 튜브의 길이와 ID 및 저압 조절기의 압력 설정에 의해 제어됩니다. 조직 챔버 상단에 연결된 유출 튜브는 유체를 폐기물 용기(유속의 자동 측정을 위해 지속적으로 계량됨) 또는 분획 분취기에 의해 제어되는 96웰 플레이트의 웰로 전달합니다. O2 검출 시스템은 조직 하류의 각 유리 조직 챔버 내부에 도색된O2 감응성 염료의 수명을 측정합니다. 그런 다음 이 정보를 사용하여 OCR을 지속적으로 계산합니다. 전체 유체 시스템은 온도 제어 인클로저에 상주하며 가스 탱크, 분획 분취기 및 컴퓨터는 기기의 주요 구성 요소입니다(그림 2A). 마지막으로, 기기를 실행하는 소프트웨어는 작동(주입된 테스트 화합물의 준비 및 타이밍, 유량 측정 시스템 및 분획 분취기 타이밍 포함)을 제어하고 OCR 데이터 및 기타 추가 측정을 처리 및 그래프로 표시하는 역할을 합니다.
이 논문에서는 유체 시스템을 사용하여 눈의 다양한 분리 구성 요소에 대한 OCR 및 젖산 생산 속도(LPR)를 주변 및 평가하기 위한 프로토콜을 설명합니다. LPR은 OCR을 매우 보완하는 해당과정(glycolytic rate)을 반영하는 파라미터이며, 여기서 쌍은 세포(10) 내의 탄수화물로부터의 에너지 생성의 두 가지 주요 지점을 설명한다. 조직을 준비하고 조직 챔버에 로드하는 것은 절차를 통해 가장 잘 배울 수 있으므로 비디오는 텍스트만으로는 쉽게 전달할 수 없는 설정 및 작동 중에 수행되는 몇 가지 중요한 단계를 설명하는 데 도움이 됩니다.
프로토콜에 대한 설명은 실험의 여러 단계에 해당하는 8개의 섹션으로 나뉩니다(그림 2B): 1. 실험 전 준비; 2. perifusate의 준비/평형; 3. 기기 설정; 4. 조직 평형; 5. 실험적 프로토콜; 6. 계기 고장; 7. 데이터 처리; 및 8. 유출 분획 분석.
프로토콜
쥐와 생쥐로부터 조직을 채취하기 위한 모든 절차는 워싱턴 대학교 기관 동물 관리 및 사용 위원회(University of Washington Institutional Animal Care and Use Committee)의 승인을 받았습니다.
1. 실험 전 준비
참고: 다음 작업은 실험 최소 하루 전에 완료됩니다.
- 실험 프로토콜 설계
- 채널에 조직 배치 할당: MRM의 양쪽에 있는 4개 채널 중 3개에 배치할 조직 또는 세포 모델을 선택합니다. 각 측면에 하나의 조직 챔버는 기준선 교정에 사용할 조직 없이 실행됩니다.
- 두 가지 일반적인 설계 중 하나를 사용하여 샘플을 배열합니다 - 각 면에 서로 다른 테스트 화합물 프로토콜(예: MRM의 한 쪽에 있는 채널은 테스트 화합물을 수신하고 다른 쪽의 채널은 대조군 역할을 함). MRM의 양쪽에서 동일한 테스트 화합물 주입 프로토콜이지만 MRM의 양쪽에서 다른 조직 또는 조직 모델과 대조군.
- 최적의 OCR 측정을 위한 유량 및 조직량 선택: 수명 비율 곱하기 100의 변화가 약 3이 될 때까지 유량을 조정합니다.
참고: 일반적인 조직 양과 해당 유속은 눈 구성 요소에 대한 표 1 에 나와 있으며, 기기는 6-80μL/min/channel 사이의 유속에서 가장 잘 작동합니다. - 필요한 매체/완충액 부피 계산: 실험 시작 시 각 MRM 삽입물에 추가할 매체의 부피를 다음과 같이 계산합니다.
부피MRM = 30mL + 프로토콜 지속 시간(분) x 유량(mL/분) x 4채널(식 1)
예를 들어, 0.01mL/분에서 60mL 시작 부피 MRM은 12.5시간 프로토콜(30mL가 고갈되고 30mL이 남음)을 허용하는 반면, 0.04mL/분에서 90mL 시작 부피MRM은 6시간 프로토콜(30mL 남음)을 허용합니다. - 테스트 화합물 주입 프로토콜: 평가할 테스트 화합물, 테스트할 농도(일반적으로 최대 반응에 근접하거나 농도 의존성으로 선택됨) 및 노출 기간을 선택합니다. 용해도를 고려하고 물, DMSO 또는 에탄올과 같은 원하는 용매에서 스톡을 구성합니다.
- 후속 에이전트를 추가하기 전에 반응이 정상 상태에 도달하도록 주입 및 후속 주입 타이밍을 선택합니다. 프로토콜을 반복할 때 여러 시간 과정을 평균화할 수 있도록 주입 타이밍을 일치시킵니다.
참고: 여기에 사용된 화합물은 이전 미토콘드리아(Mito) 스트레스 테스트 11 에서 가져온 것이며 올리고마이신 및 카르보닐 시안화물 4-(트리플루오로메톡시)페닐히드라존(FCCP)은 모두 원액과 최종 페리푸세이트 모두에서 DMSO를 필요로 합니다. - 유출 샘플링 시간: 원하는 분획 분취 간격(1-60분/샘플)을 선택하며, 빠른 변화를 위해 더 빠른 샘플링 속도를 선택하고 정상 상태에 접근하면 더 긴 시간 간격을 선택합니다. 샘플링 간격 동안 오버플로를 방지하기 위해 적절한 웰 용량(0.3 - 1.5mL)을 사용하십시오(유속 x 시간 간격보다 큰 부피 선택).
참고: 샘플링 시간은 프로토콜 선택에 따라 다르지만 Mito 스트레스 테스트의 경우 일반적으로 기준선 동안 5분 간격과 주입 중 15분 간격(-15, -10, -5, 0, 15, 30, 45, 60, 75, 90, 105, 각 시간은 샘플링 간격의 시작)을 사용했습니다. - 위에서 설명한 테스트 화합물 및 분획 분취에 대해 선택한 값을 사용자 인터페이스(UI)에 입력하면 이 정보의 그래픽 표현이 생성됩니다. 그룹 평가 및 토론을 위해 파일을 내보내고 배포합니다(보충 그림 1).
- 액세서리 및 소모품 설정
- TCA(8개 팩), 유출 튜브 어셈블리(튜브 8개 팩), 테스트 복합 주입 튜브(2개), 겸자, 튜브 클램프(3), MRM, MRM 인서트(2), 교반 막대(2) 및 퍼지 튜브 어셈블리(생물 안전 작업대에 배치)를 포함하여 제조업체에서 무균으로 제공하고 사전 포장한 공급품을 준비하십시오.
- 액체와 접촉하는 일회용 부품은 실험 실패가 증가할 수 있으므로 재사용하지 마십시오. 겸자와 교반 막대를 재사용하고 실험 사이에 세척하고 고압멸균하여 교반합니다.
2. 페리푸세이트의 준비 및 평형(시간: 배양 시간을 포함하지 않고 30분)
- 방정식 1의 계산에 따라 배지 또는 Krebs-Ringer 중탄산염 완충액(KRB)을 전날 준비(일반적으로 200mL)한 다음 각 플라스크에 90mL 이하로 T225 조직 배양 플라스크의 39°C/5%CO2 인큐베이터에서 밤새 배양합니다.
- 상업적으로 제조된 KRB 또는 배지(실온으로 데우기)를 사용하는 경우 실험 당일 아침에 페리푸세이트를 준비하고 5%CO2 인큐베이터에 최소 1시간 동안 둡니다. 모든 용액을 무균으로 준비하십시오.
알림: 액체와 접촉하는 모든 액체 및 유체 시스템의 부품은 실험 시작 시 멸균 상태입니다. 그러나 시스템의 조립과 조직의 하중은 공기에 개방되어 수행됩니다.
3. 기기 설정을 위한 온도 및 용존 가스 평형(시간: 75분)
- MRM에 튜빙 어셈블리 부착
- MRM과 유체 패키지를 기기 옆 벤치에 놓습니다. 튜빙 cl 확인amps(3), 교반 막대(2) 및 집게가 이미 도구 트레이에 있습니다.
- MRM의 양쪽에 교반 막대가 있는 사용하지 않은 MRM 인서트를 놓습니다( 그림 3 참조).
- MRM의 양쪽 끝에 있는 주입 포트에 TCA를 부착하여 튜빙 끝이 교반 막대 바로 위에 위치하도록 합니다. 두 테스트 화합물 주입 어셈블리 중 더 긴 부분이 MRM 뒷면에 있는지 확인합니다.
- 그런 다음 가스 유입 공급 라인과 퍼지 튜빙 어셈블리를 각각 후면 및 전면 빈 포트에 부착합니다( 그림 4A 참조).
- 엔클로저에 MRM/튜빙 어셈블리 배치
- MRM(튜브 어셈블리가 부착된 상태)을 MRM 히터에 넣습니다(그림 4B).
- 4개의 튜빙 어셈블리를 인클로저 바닥의 벽 홈(양쪽에 2개)에 배치하여 중간 인클로저가 제자리에 놓이면 인클로저 외부로 돌출되도록 합니다.
- cl 사이의 MRM을 고정amp감지기 스탠드의 두 바퀴를 조여 s.
- 인클로저 뒤쪽에서 돌출된 더 긴 테스트 화합물 주입 어셈블리를 인클로저 측면에 있는 두 개의 튜브 가이드를 통해 공급하여 튜브의 개구부가 앞쪽을 향하도록 합니다(그림 4C).
- 각 폐쇄 테스트 화합물 주입 어셈블리를 클램핑합니다.
- 인클로저 조립 및 온도 컨트롤러 활성화
- 인클로저 내의 모든 전기 장치에 전원을 공급하는 멀티탭을 ON 위치로 전환합니다. 감지기 스탠드의 팬이 켜지고 MRM 온도 컨트롤러에 불이 들어와 설정 값 38°C를 표시해야 합니다(그림 5).
- UI를 사용하여 교반기를 70rpm으로 켜서 교반기가 부드럽게 회전하는지 확인합니다. 적절한 교반이 관찰되면 교반기를 끕니다.
- 인클로저의 중간 부분을 베이스 위에 놓습니다.
- 인클로저의 중간 부분에 있는 케이블을 전기 상자의 케이블에 연결하여 주변 온도 컨트롤러 레버 스위치에 전원을 연결하고 주변 온도 히터에 전원을 공급합니다.
- 인클로저에 뚜껑을 덮으면 상단 온도 컨트롤러(주변 온도 컨트롤러)의 디스플레이가 켜지고 36°C를 읽습니다. MRM 히터가 설정점 온도에 도달하는 데 걸리는 시간인 30분 동안 타이머를 시작합니다.
- PCM에 TCA 삽입
- TCA 삽입 도구를 사용하여 조직 챔버를 감싼 튜브 슬리브의 상단이 PCM의 구멍을 둘러싼 표면에 닿을 때까지 삽입 도구의 표면으로 어댑터를 단단히 눌러 8개의 TCA 각각을 PCM 구멍에 삽입합니다.
- 다음 TCA를 삽입하기 전에 하나의 TCA를 완전히 삽입하십시오. 부분적으로 조립된 PCM을 PCM 버팀대와 나사 6개 옆에 따로 보관합니다.
알림: TCA를 불완전하게 삽입하면 헤드 공간이 압력 설정점에 도달하는 것을 방지하고 페리푸세이트가 흐르지 않습니다.
- MRM의 두 인서트를 사전 평형 페리푸세이트로 채우기
- 이를 위해 인클로저가 조립되고 MRM이 온도에 도달한 후 30분 후에 50mL 피펫을 사용하여 액체를 측면 아래로 부드럽게 분주하여 사전 평형화된 페리푸세이트를 예열된 MRM 인서트로 옮깁니다.
알림: 이러한 단계와 섹션 3.6의 단계는 MRM의 페리푸세이트와 대기 사이의 가스 이동을 방지하기 위해 즉시 수행해야 합니다.
- 이를 위해 인클로저가 조립되고 MRM이 온도에 도달한 후 30분 후에 50mL 피펫을 사용하여 액체를 측면 아래로 부드럽게 분주하여 사전 평형화된 페리푸세이트를 예열된 MRM 인서트로 옮깁니다.
- MRM/PCM을 조립하여 기밀 씰을 만들고O2 검출기 위치 지정
- PCM 바닥에서 나오는 TCA의 저항 튜브를 MRM 분배기의 양쪽에 있는 MRM 인서트(4개)에 삽입하여 PCM을 MRM에 놓습니다. PCM이 배치되면 조직 챔버가 O2 검출기에 닿을 수 있도록 PCM의 방향을 지정합니다.
- 전동 드라이버를 사용하여 6개의 나사로 PCM과 PCM 지지 버팀대를 고정합니다.
- 고무 개스킷 수준에서 PCM의 핀 주위를 늘려 제공된 탄성 밴드를 사용하여 PCM 지지 핀 내의 TCA를 고정합니다(그림 6).
- O 2 검출기의 면이 PCM의 핀에 닿도록 검출기 스탠드에 O2 검출기를 배치합니다. LED/광검출기 쌍이 조직 챔버의O2-민감성 염료와 일치하는지 확인합니다. 필요한 경우 O2 감지기 홀더 측면의 고정 나사를 푼 후 O2 감지기 측면 가이드를 조정합니다.
- 인클로저 위에 뚜껑을 놓습니다.
- MRM의 헤드 공간에 있는 가스와 페리푸세이트의 평형
- 고압 밸브를 완전히 고정하고 닫은 상태에서 탱크 상단의 실린더 밸브를 시계 반대 방향으로 돌려 가스 탱크 밸브를 엽니다.
- 레귤레이터의 손잡이를 사용하여 고압 레귤레이터를 10psi의 압력으로 조정합니다.
- 저압 조절기를 1.0psi로 설정하여 MRM에 압력을 가합니다(그림 7A).
- 퍼지 튜브(그림 7B)를 풀어 탱크의 가스가 MRM 헤드스페이스의 공기를 대체할 수 있도록 합니다(테스트 화합물 인젝터는 cl로 유지됨amp15분 동안 ed). 퍼지 튜브의 끝을 물 비커에 담가 기포를 관찰하여 가스 흐름을 확인합니다.
- 흐름이 확인되면 아래 섹션 2에 설명된 대로 O3.8 감지기를 시작합니다.
- 15분 후 70rpm으로 교반기를 켜고 나머지 실험 동안 계속 실행합니다. 추가 15분 후, clamp 퍼지 튜빙 어셈블리(그림 7C).
- 저압 조절기의 압력을 원하는 액체 유량에 도달하는 작동 압력으로 낮춥니다(실험 팩에 지정된 대로 - 일반적으로 약 0.5-0.7psi 사이). 유속이 20μL/min을 초과하는 경우 일시적으로 압력을 0.3psi로 설정하여 챔버가 넘치지 않고 조직을 로드할 수 있는 시간을 허용합니다. 클램프가 놓인 후 15분 이내에 조직이 로드되는 경우에는 필요하지 않습니다.
알림: 유체가 O2 감지를 방해할 수 있으므로 버퍼가 조직 챔버 외부로 흘러내리지 않도록 하십시오.
- O2 감지기 시작
- 산소 감지기라고 표시된 아이콘을 클릭하여 랩톱에서 O2 감지기 소프트웨어를 활성화합니다.
- 프로그램이 열리면(보충 그림 2) 올바른 COM 포트가 선택되었는지 확인합니다. 필요한 경우 포트 번호가 표시되도록 컴퓨터에서 O2 감지기의 플러그를 뽑았다가 꽂아 COM 포트를 식별할 수 있습니다. 응용 프로그램이 실행되는 동안 COM 포트의 플러그를 뽑으면 사용하기 전에 응용 프로그램을 닫았다가 다시 열어야 합니다.
- Start(시작)를 클릭한 다음 Record(기록)를 클릭하고 백업 폴더에 데이터를 저장합니다. 그런 다음 그래프를 클릭합니다.
- 수명 그래프의 왼쪽 하단에 있는 평균값을 5로 변경합니다(프로그램에서 5개의 연속된 포인트가 있는 이동 평균을 계산하도록 지시함). 1분이 지나고 그래프 화면에 첫 번째 데이터 포인트가 표시되면 자동 크기 조정을 클릭합니다.
4. 조직 로딩 및 평형 기간 (시간 : 90 분)
- 조직 챔버에 프릿 배치
- 인클로저의 덮개와 중간 부분을 제거합니다.
- 조직 챔버의 페리푸세이트가 미리 배치된 프릿의 상단 위로 올라간 후 프릿 상단을 가볍게 두드려 프릿 아래 또는 프릿 내부에 형성된 기포를 제거하여 프릿 큐로 프릿을 아래로 누릅니다.
- 프릿을 조직실 바닥에서 약 0.25인치 위에 놓습니다.
- 조직 챔버에 조직 로딩
- 매체 레벨이 상단에서 0.5인치가 되면 조직을 챔버에 로드합니다.
- 망막 또는 RPE-맥락막-공막 로드: 6에 설명된 대로 망막 또는 RPE-맥락막-공막을 채취합니다. 티슈를 로드하려면 미세 포인트 집게를 사용하여 티슈가 접히지 않도록 주의하면서 티슈를 사용하여 티슈 챔버의 액체가 O2 센서에 떨어지지 않도록 합니다. 조직이 프릿 쪽으로 가라앉는 것을 관찰하십시오.
참고: 조직을 채취하고 챔버에 조직을 로드하는 시간 사이에 조직을 중탄산염 기반 완충액/배지에 10분 이상 방치하지 않고 조직이 저산소가 되지 않고 공기에 노출되는 것을 방지하기 위해 조직이 충분한 완충액/배지(최소 1mL/10mg의 조직)에 담그도록 하여 조직에 대한 외상을 방지합니다. - 트랜스웰 멤브레인에 RPE 세포 로딩: 앞서 설명한 대로 RPE 세포를 준비합니다 12 및 보충 파일 1. 폴리에틸렌 테레프탈레이트에 0.25% 트립신-EDTA 및 시드를 사용하는 통로 세포, 최소 2.0 x 105 cells/cm2에서 트랙 에칭 필터(세포 배양 삽입물, 공극 크기 0.4mm). 실험 당일, 멤브레인을 동일한 너비의 세 스트립으로 자르고 겸자를 조직 챔버에 로드합니다( 그림 8A 참조).
- 유출 튜빙 어셈블리를 조직 챔버에 부착
- 포장에서 유출 튜브 어셈블리를 제거하고 유출 튜브 어댑터가 인클로저 내부에 오도록 유출 튜브 분리기를 인클로저 중간 부분의 가장자리에 놓습니다(그림 8B,C).
- TCA를 너무 세게 누르지 않도록 주의하면서(그렇지 않으면 MRM에서 느슨해질 수 있음) 유출 튜브 어댑터를 조직 챔버 TCA 상단에 부착합니다(그림 8D). 인클로저의 중간을 교체하고 주변 온도 제어 케이블을 다시 연결합니다.
- 인클로저의 덮개를 교체하기 전에 O2 검출기, PCM, 조직 챔버, 유출 튜브, MRM 및 히터를 포함한 인클로저 내부의 유체 시스템 구성 요소가 그림 8E와 같이 모두 올바르게 배치되었는지 확인하십시오.
- 인클로저의 덮개를 교체합니다. 분획 분취기 가이드 암을 통해 8개의 유출 튜브를 공급합니다.
- 분획 분취기 활성화
- 분획 분취기가 인클로저와 유출 튜브 홀더의 오른쪽 벽을 기준으로 중앙에 있는지 확인하십시오: 분획 분취기 베이스의 왼쪽 지지대는 인클로저 벽의 가장자리에 닿아야 합니다.
- 노트북에서 UI 바로 가기를 클릭하면 실험 정보 페이지가 열립니다(보충 그림 3 상단).
- 실험 정보 페이지(실험 시작 전에 수행할 수 있음)의 해당 상자에 정보를 입력한 다음 상단의 Flow & Fraction Collector 페이지를 클릭합니다(보충 그림 3 하단).
- 자동 유량 측정을 위한 파라미터 설정
- 상단 중앙의 샘플 획득 시간 드롭다운 메뉴에서 원하는 정확도(통합 시간에 비례)와 시간 분해능의 균형을 맞추는 원하는 통합 시간을 선택합니다.
- 실험에서 유출 분율이 수집되지 않으면 시작을 클릭하고 섹션 4.7로 이동합니다. 유출 분율이 수집되는 경우 섹션 4.6의 단계를 수행하십시오.
- 유출 분획 수집
- UI 소프트웨어에서 분수 수집? 실험 정보 페이지 또는 Flow & Fraction Collector 페이지에 있는 상자. 그런 다음 Compute FC Settings(컴퓨팅 FC 설정 ) 버튼을 클릭합니다.
- 새 창이 열리면 프로토콜의 첫 번째 주입 시간(시간 = 0으로 정의됨)과 채널당 유속, 각 샘플의 시간 간격을 입력합니다. 그런 다음 계산을 클릭합니다.
- 수집 간격이 확인되면 Generate and Start(생성 및 시작)를 클릭합니다.
- 개별 채널에 대한 유량 측정(옵션)
- 개별 채널의 유량을 측정해야 하는 경우(정상 조건에서는 몇 퍼센트만 다름) 8개(또는 그 이하)의 마이크로 원심분리기 튜브의 무게를 측정하고 무게를 기록합니다.
- 플레이트 캐리지에 사전 계량된 마이크로 원심분리기 튜브가 들어 있는 튜브 홀더를 놓습니다. other utilities(다른 유틸리티) 섹션에서 Measure Flow Rate Manually(수동으로 유량 측정 )를 클릭합니다.
- 측정 기간을 선택한 다음 Generate Template(템플릿 생성)을 클릭합니다. 창을 닫고 시작을 클릭합니다. 분획 분취기는 측정 기간 동안 유출 튜브에서 유체를 수집한 다음 암이 홈 위치로 돌아갑니다.
- 채취 후 마이크로분리 튜브의 무게를 측정하고 무게 차이를 측정 기간으로 나눈 값을 사용하여 유속을 계산합니다(여기서 1mg = 1μL).
- 기준선 안정화
- 조직 및/또는 세포가 조직 챔버에 로딩되면, 시스템이 90분 동안 평형을 이루도록 하여O2 소비의 평평한 기준선을 설정하고, 이때 첫 번째 테스트 화합물을 주입할 수 있습니다(시간 = 0으로 간주됨).
- 첫 번째 주입 30분 전에 테스트 화합물 주입을 준비하기 위해 주입 페이지에 채널당 평균 마지막 3FR 값을 입력합니다.
5. 실험 프로토콜(시간: 2-6시간)
참고: 베이스라인 안정화가 진행되면 다음 작업은 테스트 화합물을 주입하고 둘 이상을 사용할 경우 분획 분취기에서 플레이트를 교체하는 것입니다.
- 시험 화합물 주입제 준비
- 화합물의 이름, 원하는 농도(최종 및 원액) 및 테스트 화합물의 주입 시간을 주입 페이지의 UI에 있는 표에 입력합니다. 주입 시 남은 MRM의 부피와 원하는 농도를 달성하기 위해 주입할 원액의 양을 포함하여 프로그램에 표시된 정보를 확인합니다(보충 그림 4).
- 주입에 필요한 페리푸세이트와 스톡의 양을 계산하려면 주입 테이블의 흰색 상자를 채우고 계산을 클릭합니다. 계산된 값을 사용하여 주입된 부피가 주입 후 MRM 부피의 5%가 되도록 주입 전에 테스트 화합물 스톡 용액을 페리푸세이트로 희석합니다.
- 원액과 페리푸세이트를 혼합하여 각 테스트 화합물을 준비합니다. 주입 시간 전에 최소 10분 동안 주사기를 로드하고 주입할 준비가 될 때까지 CO2 인큐베이터(37-40°C 사이의 온도에서 유지)에 보관합니다.
- 시험 화합물 주입
- 테스트 화합물이 포함된 주사기를 주입 라인에 연결합니다(그림 9A). 주입 라인으로 이어지는 부드러운 벽의 pharmed 튜브를 풀고 약 3mL/분의 속도로 테스트 화합물(그림 9B)을 천천히 주입합니다. 주입 라인에서 튜브를 다시 클램핑한 다음 주사기를 제거합니다(그림 9C). MRM의 다른 쪽에 대해 반복합니다.
- 각 시험 화합물을 주입한 후, UI 주입 페이지에 따라 주입할 각 후속 시험 화합물을 준비합니다.
- 채널별 유입O2 신호 판별
- 모든 실험이 끝나면 호흡 억제제 KCN(3mM)을 주입하여 베이스라인 센서 수명 및 비미토콘드리아 산소 소비의 변화를 보정하는 데 사용되는 각 채널의 유입 수명 신호를 결정합니다.
6. 실험 종료 및 시스템 분해 (소요 시간: 30분)
- 산소 데이터 저장
- 산소 감지기 소프트웨어의 그래프 창 왼쪽 상단에 있는 저장 버튼을 클릭합니다. 파일 이름을 지정하고 파일이 보관될 폴더에 저장합니다. 클릭 기록 중지 메인 창에서 버튼을 눌러 백업 파일을 저장합니다.
- UI 실험적 정보 파일 저장
- UI의 일반 페이지 왼쪽 상단에 있는 프로필 저장 버튼을 클릭합니다. 파일 이름을 지정하고 파일을 보관할 폴더에 저장합니다. UI의 fraction & flow 페이지에서 Tools 드롭다운 메뉴를 클릭한 다음 Save를 클릭합니다. 생성된 이름을 유지하거나 다른 이름을 선택하고 원하는 위치에 파일을 저장합니다. 필요한 경우 액세스하고 저장할 수 있는 백업 파일이 있습니다.
- 악기 분해
- KCN은 휘발성이므로 유체 어셈블리를 흄 후드에 폐기하십시오. MRM 및 FC 쓰레기통의 매체를 쓰레기통에 붓고 MRM 인서트를 헹구고 막대를 물로 완전히 저어줍니다. 폐기물 용기(KCN 포함)의 내용물을 라벨이 부착된 화학 폐기물 용기에 부어 화학 안전에 의한 후속 폐기를 수행합니다. 다음 실험 전에 교반 막대와 집게를 철저히 세척하고 고압멸균하십시오.
7. 데이터 처리(시간: 15-45분)
- Mac 또는 PC 컴퓨터에서 데이터 프로세서 응용 프로그램을 엽니다. 실험에서 생성된 .csv 데이터 파일을 선택합니다. 이 실험의 프로토콜이 이전에 분석된 실험과 유사한 경우 해당 설정 파일을 선택하고 다음 단계를 클릭합니다. 그렇지 않으면 다음 단계를 클릭하여 실험 설정 입력을 시작합니다.
- 실험의 다양한 설정을 입력합니다. 참조 시점을 결정할 때 KCN이 적용되고 수명 값이 감소하기 직전의 시점을 선택합니다. 슬라이더를 사용하거나 상자에 시간 값을 입력하여 이 점을 선택합니다.
- 계산(Calculate)을 클릭하여 방정식 2에 따라 OCR 그래프를 생성합니다.
OCR = ([O 2]in- [O 2]out) x FR = (217nmol/mL - [O 2]out) x FR/조직 기준(식 2)
여기서 37°C에서 21% O2와 평형을 이룰 때 KRB의O2 농도는 217nmol/mL이고, FR은 유속(mL/min)이고, 조직 기준은 챔버에 로드된 조직의 양(즉, 망막, RPE-맥락막-공막 또는 RPE 세포의 수)입니다. - 그래프 내보내기 버튼을 눌러 그래프를 .pdf 파일로 저장합니다. OCR을 절대값 또는 정상 상태 값의 분수로 그래프로 표시하여 편집 설정 페이지에서 1로 설정할 테스트 화합물에 해당하는 상자를 선택합니다.
8. 유출 분획 분석
- 실험 직후 샘플을 분석할 수 없는 경우 다음 날 분석한 경우 플레이트를 4°C에 두거나 더 오래 보관하는 경우 냉동합니다. 플레이트가 얼면 샘플을 4°C에서 해동합니다(샘플이 차갑게 유지되도록).
- 선택한 유출 분획에 대해 분석이 수행되면 데이터 열(채널당 하나)이 가장 왼쪽 열에 시간(분)과 오른쪽 열(nmol/mL 또는 ng/mL)과 함께 .csv 파일에 입력됩니다. 데이터 처리 프로그램의 링크를 누르면 템플릿이 업로드됩니다.
- 이 파일을 데이터 프로세서에 업로드하여 데이터를 계산하고 플로팅합니다.
대표적 결과
눈의 분리된 구성 요소로부터 생성된 데이터의 해상도를 설명하기 위해, OCR 및 LPR은 일반적으로 사용되는 프로토콜(미토콘드리아 스트레스 테스트10; 그림 10, 그림 11 및 그림 12). 각 조직에 사용되는 조직의 양은 표 1에 나와 있습니다. 데이터는 유체 시스템용으로 개발된 소프트웨어 패키지를 사용하여 처리되고 그래프로 표시되었습니다. 망막과 RPE-맥락막-공막의 준비는 비교적 간단하며 각 조직 유형에 대해 20분 미만이 소요됩니다. OCR은 테스트 화합물이 주입되는 동안 일정하여 조직의 안정적인 건강과 기능을 나타내고 방법의 타당성을 뒷받침합니다(그림 10). 각 조직 유형에 대해 검증한 후에는 각 실험에 대해 테스트 화합물이 주입되지 않는 대조군을 실행할 필요가 없다는 것을 발견했습니다. 보다 종래의 주융 방법(6,8,13)을 사용하여 얻은 데이터와 일치하며, 올리고마이신에 대한 반응으로 OCR이 감소하고 FCCP에 반응하여 OCR이 증가합니다. LPR의 변화는 OCR에서 관찰된 변화와 반대 방향으로, 올리고마이신은 LPR을 증가시켰고, FCCP에 대한 반응으로 감소했습니다(그러나 약간만). 각 순차 테스트 화합물의 효과에 대한 통계적 유의성을 비교하기 위해 t-검정을 수행했습니다(기기와 함께 제공되는 소프트웨어에 의해 자동으로 계산됨). 논문의 목표가 방법을 수행하는 방법을 설명하는 것이었기 때문에 수행된 반복실험 횟수가 통계적 유의성을 산출할 만큼 항상 높지는 않았습니다. 그러나 일반적으로 반복횟수가 3회 이상인 경우 FCCP와 올리고마이신이 OCR과 LPR 모두에 미치는 영향은 유의했습니다.
RPE 세포는 이전에 유동 시스템으로 분석되지 않았지만 RPE-맥락막-공막과 유사하게 반응했습니다(OCR의 상당 부분이 RPE 세포에 기인한다는 견해와 일치함; 그림 11). 이러한 예시적인 예는 제어 채널에서 OCR의 안정성에 의해 반영된 조직 생존력을 유지하는 시스템의 능력과 올리고마이신 및 FCCP에 의해 유도된 크기의 OCR 변화에 대한 높은 신호 대 잡음비(100:1 이상)를 강조합니다. 또한, 유출 분획 분석은 OCR(이 경우 LPR)을 보완하는 세포외 유체와 교환되는 다양한 화합물의 흡수 또는 생산 속도를 상호 연관시키는 데 사용할 수 있습니다. 기기의 이러한 기능을 통해 병렬로 수행된 조직 유형 간 조직 반응의 특성 차이를 정확하게 정량화할 수 있었습니다. RPE-맥락막-공막 및 RPE 세포에 의한 OCR은 망막보다 올리고마이신에 일관되게 더 민감하지만(그림 11 및 그림 12), RPE-맥락막-공막의 경우 FCCP에 노출되는 기간이 정상 상태에 도달할 만큼 충분히 길지 않았습니다. DMSO를 용매로 사용할 때 고려해야 할 사항이 있습니다. 더 높은 농도에서(0.2%) DMSO는 망막에 의한 OCR에 일시적인 영향을 미쳤습니다(아마도 DMSO가 막 투과성에 미치는 영향으로 인한 삼투압 변화의 영향을 반영함).
KCN이 시토크롬 c 산화효소에 직접 작용하여 호흡을 완전히 억제한다는 가정에 기초하여, KCN 노출이 끝날 때의 OCR은 0으로 설정되고, 모든 OCR 값은 KCN 값에 대한 변화를 기준으로 계산된다. OCR은 호흡 사슬 및 시토크롬 c 산화효소와 무관하게 발생할 수 있습니다. 그러나 전체 OCR에 대한 이러한 기여의 크기는 일반적으로 몇 퍼센트를 넘지 않으며(데이터는 표시되지 않음) 조직이 KCN에 노출되는 시간이 길어지면 전자 수송 사슬의 일부가 아닌 산화효소의 기질이 고갈됩니다.
통계 분석
단일 실험은 그림에 표시된 대로 표시되었지만 평균화된 여러 채널을 사용했습니다. 그런 다음 데이터를 표준 오차(SE, SD/√n으로 계산)± 평균으로 그래프로 표시했습니다.
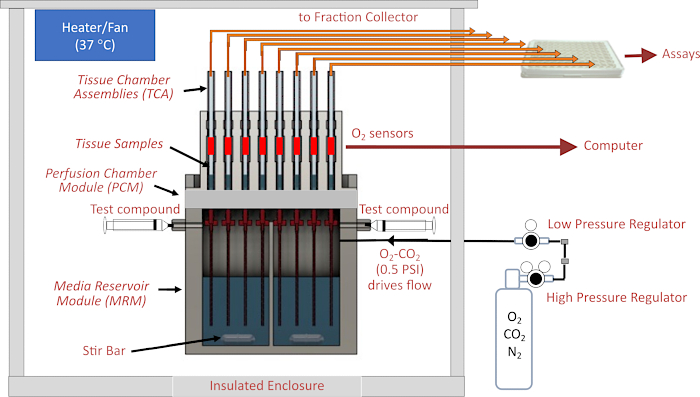
그림 1. 유체/평가 시스템의 개략도. 주요 구성 요소에는 인클로저, 온도 제어 요소, 유체 및 조직 챔버 시스템, 페리푸세이트 위의 헤드 공간에서 가스 압력 조절, 분획 수집기/유량 모니터링 및 O2 검출기가 포함됩니다. 약어: MRM = 미디어 저장소 모듈, PCM = 퓨전 주변 챔버 모듈, TCA= 조직 챔버 어셈블리. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2. (A) 기기의 주요 구성 요소 사진. 주요 구성 요소는 가스 탱크(압력 조절기), 인클로저, 분획 수집기 및 컴퓨터로 구성됩니다. (B) 단계의 주요 범주와 이를 완료하는 데 걸리는 시간을 보여주는 실험 순서도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3. MRM의 보기입니다. MRM 인서트(왼쪽)와 교반 막대(오른쪽)가 MRM 인서트의 하단(MRM 디바이더의 각 측면에 배치됨)에 배치된 MRM의 모습입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4. MRM의 튜빙 어셈블리 및 퍼지 튜빙 어셈블리. (A) MRM의 포트에 부착된 복합 주입 튜빙 어셈블리 및 퍼지 튜빙 어셈블리를 테스트합니다. (비씨) 시험 복합 사출 어셈블리와 퍼지 튜빙 어셈블리(B)는 인클로저(C) 전면의 홈에 배치됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5. MRM 온도 컨트롤러의 전원을 켭니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6. 조직 챔버 및 가스 탱크. 검출기 스탠드(MRM 및 PCM도 지원함)에 O2 검출기를 배치하고 조직 챔버를 제자리에 고정하는 데 도움이 되는 PCM의 핀 주위에 밴드를 배치합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7. (A) 가스 탱크의 고압 및 저압 조절기. (비씨) 퍼지 튜브. 퍼지 튜브를 사용하면 MRM의 헤드스페이스에서 공기가 제거되고 공급 탱크의 가스가 채워집니다. 열린 퍼지 튜브(B)와 닫힌 퍼지 튜브(C)를 보여주는 사진. 테스트 화합물 주입 어셈블리는 퍼지 프로세스를 통해 닫힌 상태로 유지됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8. 조직 챔버 및 유출 설정. (A) Transwell 멤브레인을 동일한 너비의 세 스트립으로 절단한 후의 치수. (B) 유출 다중 튜브 지원. (C) 조직 챔버 근처의 튜빙 어댑터와 함께 인클로저의 가장자리에 위치한 유출 다중 튜브 지지대. (D) 조직실에 부착된 유출 튜브 어셈블리의 사진. (E) 조감도 view 뚜껑이 없는 인클로저의 모습. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 9. MRM에 화합물 주입. 5mL 주사기를 사용하여 주입 포트를 통해 MRM에 테스트 화합물을 주입합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
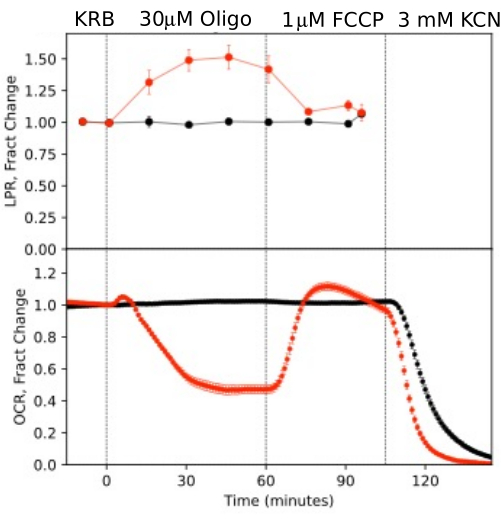
그림 10. 테스트 화합물에 대한 OCR 및 LPR 곡선. 표시된 테스트 화합물의 존재 또는 부재(대조군)에 대한 반응으로 마우스(1개의 망막/채널)에서 분리된 망막에 의한 OCR 및 LPR. 각 곡선은 단일 실험에서 6회 반복실험의 평균입니다(오차 막대는 SE이며, p-값은 각 테스트 에이전트의 정상 상태 값을 이전 테스트 에이전트의 정상 상태 값과 비교하는 쌍체 t-검정을 수행하여 계산됨). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
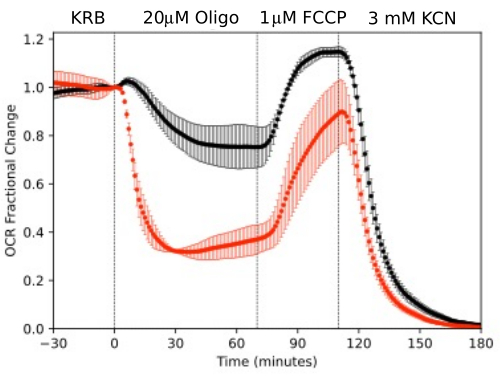
그림 11. OCR 곡선. 표시된 테스트 화합물에 대한 반응으로 병렬로 측정된 마우스(망막 1개 또는 RPE-맥락막-공막/채널)에서 분리된 RPE-맥락막-공막 및 망막에 의한 OCR. 데이터는 단일 실험의 반복실험 평균입니다(RPE-맥락막-공막 및 망막에 대해 각각 n = 2 및 4, p-값은 각 테스트 에이전트의 정상 상태 값을 이전 테스트 에이전트의 정상 상태 값과 비교하는 쌍체 t-검정을 수행하여 계산됨). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
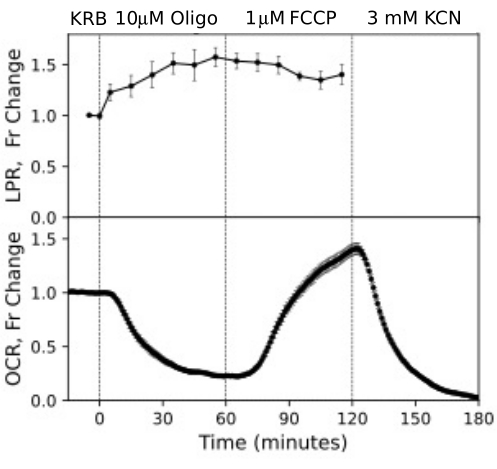
그림 12. RPE 셀의 OCR 및 LPR 곡선. 스트립으로 절단되어 주입 주위 챔버에 로드된 트랜스웰 멤브레인에 부착된 RPE 세포의 OCR 및 LPR. 데이터는 단일 실험의 반복실험 평균입니다(n = 3, 1.5개의 멤브레인/채널(360,000개 셀/채널), p-값은 각 테스트 에이전트의 정상 상태 값을 이전 테스트 에이전트의 정상 상태 값과 비교하는 쌍체 t-검정을 수행하여 계산됨). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 조직/세포 | 금액/채널 | 유량: mL/min |
| 레티나(마우스) | 1 | 0.025 |
| RPE-맥락막-공막(마우스) | 2 | 0.02 |
| 트랜스웰 멤브레인의 RPE 셀 | 360,000셀(4 x 1/3 필터 스트립) | 0.016 |
표 1. 다른 조직에 대한 권장 작동 사양.
보충 그림 1. 실험 설계의 그래픽 표현. 테스트 화합물에 대한 노출 시기 및 구성, 분획 수집 시기. 농도 증가(Conc Inc)는 구현할 농도의 변화입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2. 시작 시 사용자 인터페이스. PCM에 삽입된 조직 챔버에서O2를 모니터링하는O2 검출 소프트웨어의 시작 창 UI. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3. 실험 설정을 위한 사용자 인터페이스. 실험 정보 입력(왼쪽)과 유출 분획 수집 시간 선택(오른쪽)을 위한 UI. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 4. 삽입 페이지의 사용자 인터페이스입니다. 원하는 테스트 화합물 농도와 MRM에 남아 있는 부피를 기준으로 주입 부피를 계산하는 주입 페이지. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 조직 시료 전처리 방법. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
세포 기능과 눈의 다양한 구성 요소 유지의 모든 측면에서 생체 에너지학의 중요성으로 인해 생체 에너지의 조절을 연구하는 방법이 매우 필요합니다. 특히, 신경 망막과 RPE는 에너지 생성뿐만 아니라 세포 내 및 세포 간 신호 전달을 위한 대사에 의존합니다14,15,16,17. 산화 능력이 높기 때문에, 눈의 고립된 조직은 정적인 조건 하에서 잘 유지되지 않으며,18,19 따라서 눈의 고립된 구성 요소에 대한 연구는 대사 과정을 유지하고 평가할 수 있는 흐름 시스템을 필요로 한다. 유체 시스템은 다양한 조직 유형에서 OCR 및 LPR 데이터를 생성하기 위해 개발되었으며, 이 백서에서는 최적의 결과를 생성하는 것으로 밝혀진 자세한 프로토콜을 제시했습니다.
유동 시스템을 사용하여 강력한 데이터를 생성하기 위한 주요 결정 요인에는 39°C에서 CO2 기반 매체/완충액의 사전 평형이 포함됩니다(실험 중에 가스를 제거할 수 있는 용존 가스로 페리푸세이트가 과포화되지 않도록 하기 위해). 특히, 4°C에서 보관된 배지 또는 KRB 완충액은 37°C에 비해 과포화되어 사전 평형 시간이 충분하지 않은 경우 실험 중에 가스가 제거됩니다. 또한, 조직 챔버에 로드된 조직은 조직의 찢어짐 또는 불완전한 분리로 인한 조직의 부적절한 분리로 인해 외상을 입지 않아야 하며, 소량의 중탄산염 기반 완충액에 있는 조직을 대기 공기에 너무 오래 노출시켜서는 안 됩니다. O2 검출의 온도 제어, 유량 안정성 및 신뢰성은 변동성이 거의 없으며 이러한 요인은 고장률에 크게 기여하지 않습니다.
이 기기에는 동시에 작동하는 8개의 유동 채널/조직 챔버가 있으며, 각 저장소마다 4개의 조직 챔버가 있는 2개의 저장소에서 페리푸세이트가 공급됩니다. OCR의 가장 정확한 시간 경과를 얻기 위해 운동 곡선은 조직이 로드되지 않은 챔버에 의해 기준선을 보정합니다. 따라서 일반적인 실험 프로토콜에는 3개의 조직 챔버로 구성된 두 그룹이 포함됩니다. 프로토콜은 일반적으로 두 가지 범주로 나뉩니다: 하나는 양쪽에 있는 서로 다른 테스트 화합물 프로토콜입니다(예: MRM의 한쪽에는 약물/차량, 다른 쪽에는 차량만 있음). 두 번째는 MRM의 양쪽에서 동일한 테스트 화합물 주입 프로토콜이지만 MRM의 양쪽에서 다른 조직 또는 조직 모델입니다. 이 논문에서는 올리고마이신과 FCCP가 망막에 미치는 영향을 시험 화합물에 노출되지 않은 조직별로 OCR과 비교하고, 조직 특이적 거동을 확인하기 위해 동일한 프로토콜과 조건에서 두 조직을 동시에 평가했습니다. 후자는 이 연구에서 동일한 실험에서 망막에 비해 RPE-맥락막-공막에 의한 대사율의 동적 범위가 증가했음을 보여줌으로써 설명되었습니다. 다른 보고서에서는 OCR 및 LPR에 대한 다양한O2 수준의 영향과 연료, 약물 및 독소의 농도 의존성을 측정하는 것을 포함하여 더 넓은 범위의 연구 설계를 설명했습니다20,21. 또한, 유출 분율의 분석은 젖산의 측정과 LPR의 계산에 한정되어 왔지만, 유출 분율 내의 여러 화합물 및 부류의 화합물을 분석하면 세포를 빠져나갈 수 있는 호르몬, 신경전달물질, 세포 신호, 대사 산물등을 분석하면 실험의 정보 내용이 크게 증가하고, 23.
분리된 망막 또는 RPE-맥락막-공막의 하중은 간단하며, 일단 분리되면 이러한 조직은 집게를 사용하여 조직 챔버의 상단에 배치되고 프릿으로 가라앉을 수 있습니다. 필터 삽입물에서 배양된 RPE 세포는 배양 후 4-8주 후에 적절한 분극 및 RPE 성숙 마커를 개발합니다. RPE 성숙도 및 분극이 유지되어야 하는 경우, 트랜스웰 멤브레인에 부착된 살아있는 세포 분석을 위해 RPE를 제거하는 것은 실현 가능하지 않다24. 주위 챔버는 완충액에 잠긴 상태에서 메스로 절단되고 조직 챔버에 빠르게 삽입되는 트랜스웰 멤브레인 스트립을 수용할 수 있습니다. 절단 필터 스트립이 정적 시스템(24)에 배치되었지만, 이러한 중요한 셀 유형을 평가하기 위한 다른 유체 방법은 이용가능하지 않다. RPE 세포의 반응은 망막 또는 RPE-맥락막-공막보다 빠르고 역동적이었는데, 이는 부분적으로 막 삽입부에서 단층으로 구성된 RPE 세포의 정점 및 기저 측면에 즉시 접근했기 때문일 수 있습니다.
데이터가 가장 높은 신호 대 잡음비를 갖도록 하는 또 다른 요소는 유속을 기준으로 융합 주위 챔버에 로드된 조직의 최적 비율을 선택하는 것입니다. 유속에 비해 조직이 너무 적으면 유입과 유출 사이의 용존O2 농도 차이가 매우 작아 안정적으로 측정하기 어렵습니다. 대조적으로, 흐름이 너무 느리면 O2 의 농도가 너무 낮아져 조직이 저산소증의 영향을받습니다. 그럼에도 불구하고 가스 압력 구동 액체 흐름은 정확한 OCR 및 LPR 측정을 위해 소량의 조직만 필요하므로 최저 5mL/분의 유속으로 유지할 수 있습니다. 여기에 표시된 실험에서는 약 20mL/분/채널이 사용되었으며, 이는 하나의 망막, 두 개의 RPE-맥락막-스클레라 또는 360,000개의 RPE 세포에 적합했습니다. 주입된 테스트 화합물에 대한 조직의 노출을 지연시키고 분산시키는 시스템 효과를 최소화하기 위해 여러 크기의 조직 챔버가 제공되어 조직의 양(및 유속)이 챔버의 적절한 크기와 일치합니다.
이 논문에 표시된 분석의 데이터는 속도에 대한 절대 크기 또는 정상 상태 또는 기준선에 대한 부분 변화의 두 가지 방식으로 표현되었습니다. 초점은 테스트 화합물에 대한 반응 측정의 그림이었습니다. 그러나 유체 시스템은 유전자 변형과 같은 주융 분석 전에 조직 처리의 효과를 평가하고 비교하는 데 매우 적합합니다. 치료가 대조군과 다른지 여부를 테스트하는 것은 테스트 화합물의 정규화된 반응에 대한 처리의 효과를 분석하는 경우 가장 강력합니다. 분석에 절대 크기가 필요한 경우, 전처리된 표본 분석의 통계적 검증력은 평가 및 대조가 동일한 융합 주위 실험에서 수행될 경우 극대화됩니다.
교반기를 제외하고 액체와 접촉하는 모든 부품은 제조업체에서 소모품으로 공급하며 멸균 처리되었습니다. 이러한 부품은 불완전한 세척과 오염된 표면으로 인해 실험이 손실되는 경우가 있으므로 재사용해서는 안 됩니다. 설정 초기의 시스템은 멸균 상태입니다. 그러나 배지가 MRM에 추가되고 조직은 비멸균 조건에서 챔버에 로드됩니다. 멸균 부품으로 조립되었지만 실험 자체가 비멸균 조건에서 수행되는 시스템에서 OCR을 측정했습니다. 박테리아가 측정 가능한 OCR(미공개 결과)을 가질 때까지 축적되는 데 약 14시간이 걸립니다. 10시간 미만의 프로토콜을 사용하는 경우 박테리아 축적 및 이로 인한 영향은 무시할 수 있습니다.
많은 연구자들은 상대적으로 높은 처리량을 가진 세포 단층의 정적 배양 하에서 OCR을 측정하도록 설계된 기기를 사용합니다25,26. 대조적으로, 이 논문에서 테스트하고 설명한 유체 기기는 조직 표본에 존재하는 더 큰 확산 거리에 중요한 적절한O2 전달을 보장하여 조직을 유지합니다. 또한 분수를 수집할 수 있어 OCR과 병행하여 여러 매개변수를 평가할 수 있어 매개변수 간의 관계를 연구하는 능력이 크게 향상됩니다. 마지막으로, 용존 가스 농도 (예 : O 2 및 CO 2 )를 제어하여 중탄산염 기반 매체 및 완충액을 사용한 실험 시간을 늘려 사용자가 O2 의 효과를 연구 할 수 있도록합니다. 두 방법론 모두에 대한 한계는 다른 주융 시스템이 4,27,28을 가지고 있는 기능인 테스트 화합물의 세척을 연구할 수 없다는 것입니다. 최적의 분석 방식을 결정할 때 고려해야 할 또 다른 사항은 유체 시스템이 정적 시스템보다 더 많은 매체와 테스트 화합물을 사용한다는 사실입니다. 추가 비용은 현재 유체 시스템을 사용하면 시스템을 사용할 수 있는 낮은 유속으로 인해 최소화됩니다.
전반적으로, 새로운 흐름/평가 기기로 실험을 수행하기 위한 프로토콜에 대한 자세한 설명이 설명되어 있습니다. 망막과 RPE-맥락막-공막으로 생성된 데이터는 사용하기가 훨씬 더 어려운(그리고 쉽게 구할 수 없는) 시스템으로 얻은 이전 결과를 요약했습니다. 또한 이 시스템은 트랜스웰 멤브레인에 부착된 RPE 세포를 유지하고 평가할 수 있으며, 이는 세포의 취약성으로 인해 이전에 유동 시스템으로 분석되지 않은 매우 중요한 세포 모델입니다. 프로토콜의 주요 부분은 75분의 설정 시간, 90분의 평형 기간 및 실험 프로토콜로 구성되어 유체 시스템 작동을 전문으로 하지 않는 실험실에서 일상적으로 사용하기에 적합합니다. 우리는 테스트 화합물에 대한 조직의 급성 반응을 측정하는 데 중점을 두었지만 이 시스템은 유전적으로 변형되었거나 테스트 처리/조건을 거친 동물 모델 또는 세포 모델과 같은 다양한 출처의 조직을 비교하는 데 매우 적합합니다. 또한 유출 분획에 대해 수행할 수 있는 분석의 범위는 광범위하며 대사 산물, 세포 신호 분자 및 분비된 호르몬/신경 전달 물질뿐만 아니라 분획 및 조직에 대한 질량 분석법에 의해 생성된 다성분 분석을 포함합니다.
공개
I.R.S., M.G. 및 K.B.는 이 연구에 설명된 BaroFuse perifusion 시스템의 제조업체/유통업체인 EnTox Sciences, Inc.(Mercer Island, WA)와 재정적 관계를 맺고 있습니다. 다른 모든 저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 미국 국립보건원(National Institutes of Health, R01 GM148741 I.R.S.), U01 EY034591, R01 EY034364, 브라이트포커스 재단(BrightFocus Foundation), 실명 예방 연구(Research to Prevent Blindness, J.R.C.) 및 R01 EY006641, R01 EY017863 및 R21 EY032597(J.B.H.)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| BIOLOGICAL SAMPLES | |||
| C57BL/6J mice | Envigo Harlan (Indianapolis, IN) | N/A | |
| REAGENTS | |||
| FCCP | Sigma-Aldrich | C2920L9795 | |
| Glucose | Sigma-Aldrich | G8270G | |
| KCN | Sigma-Aldrich | 60178 | |
| Lactate | MilliporeSigma | L6661 | |
| Oliigomycin A | Sigma-Aldrich | 75351L9795 | |
| CELL CULTURE AND TISSUE HARVESTING | |||
| Beuthanasia-D | Schering-Plough Animal Health Corp., Union, NJ | N/A | |
| Bovine serum albumin | Sigma-Aldrich | A3059 | |
| Euthasol, 390 mg/ml sodium pentobarbital | Virbac | RXEUTHASOL | |
| Fetal bovine serum | Sigma-Aldrich | 12303C | |
| Hank’s Buffered Salt Solution | GIBCO | 14065056 | |
| Krebs Ringer Bicarbonate (KRB) | Thermo Fisher Scientific | J67795L9795 | |
| Matrigel | ThermoFisher | #CB-40230 | |
| Penicillin-streptomycin | ThermoFisher Scientific | 15140122 | |
| ROCKi | Selleck Chemicals | Y-27632 | |
| Trypsin-EDTA | ThermoFisher | #25-200-072 | |
| SUPPLIES | |||
| Gas Cylinders: 21% O2/5% CO2/balance N2 | Praxair Distribution, Inc | N/A | |
| Transwell filters | MilliporeSigma | 3470 | |
| COMMERCIAL ASSAYS | |||
| Amplex Red Glucose/Glucose Oxidase Assay Kit | ThermoFisher | A22189 | |
| Glucose Oxidase from Aerococcus viridans | Invitrogen (Carlsbad, CA) | A22189L9795 | |
| Lactate Oxidase | Sigma-Aldrich | L9795 | |
| EQUIPMENT | |||
| BaroFuse Multi-Channel Perifusion system | EnTox Sciences, Inc (Mercer Island, WA | Model 001-08 | |
| Synergy 4 Fluorometer | BioTek (Winooski, VT) | S4MLFPTA |
참고문헌
- Lacy, P. E., Walker, M. M., Fink, C. J. Perifusion of isolated rat islets in vitro: Participation of the microtubular system in the biphasic release of insulin. Diabetes. 21 (10), 987-998 (1972).
- Doliba, N. M., et al. Metabolic and ionic coupling factors in amino acid-stimulated insulin release in pancreatic beta-HC9 cells. American Journal of Physiology. Endocrinology and Metabolism. 292 (6), E1507-E1519 (2007).
- Sweet, I. R., et al. Regulation of ATP/ADP in pancreatic islets. Diabetes. 53 (2), 401-409 (2004).
- Chertov, A. O., et al. Roles of glucose in photoreceptor survival. The Journal of Biological Chemistry. 286 (40), 34700-34711 (2011).
- Kooragayala, K., et al. Quantification of Oxygen Consumption in Retina Ex Vivo Demonstrates Limited Reserve Capacity of Photoreceptor Mitochondria. Investigative Ophthalmology & Visual Science. 56 (13), 8428-8436 (2015).
- Bisbach, C. M., et al. Succinate Can Shuttle Reducing Power from the Hypoxic Retina to the O2-Rich Pigment Epithelium. Cell Reports. 31 (5), 107606 (2020).
- Du, J., et al. Inhibition of mitochondrial pyruvate transport by zaprinast causes massive accumulation of aspartate at the expense of glutamate in the retina. The Journal of Biological Chemistry. 288 (50), 36129-36140 (2013).
- Hass, D. T., et al. Succinate metabolism in the retinal pigment epithelium uncouples respiration from ATP synthesis. Cell Reports. 39 (10), 110917 (2022).
- Kamat, V., et al. Fluidics system for resolving concentration-dependent effects of dissolved gases on tissue metabolism. Elife. 10, e66716 (2021).
- Stryer, L. . Biochemistry. , (1995).
- Gu, X., Ma, Y., Liu, Y., Wan, Q. Measurement of mitochondrial respiration in adherent cells by Seahorse XF96 Cell Mito Stress Test. STAR Protocols. 2 (1), 100245 (2021).
- Engel, A. L., et al. Extracellular matrix dysfunction in Sorsby patient-derived retinal pigment epithelium. Experimental Eye Research. 215, 108899 (2022).
- Zhang, R., et al. Inhibition of Mitochondrial Respiration Impairs Nutrient Consumption and Metabolite Transport in Human Retinal Pigment Epithelium. Journal of Proteome Research. 20 (1), 909-922 (2021).
- Hurley, J. B. Retina Metabolism and Metabolism in the Pigmented Epithelium: A Busy Intersection. Annual Review of Vision Science. 7, 665-692 (2021).
- Xiao, J., et al. Autophagy activation and photoreceptor survival in retinal detachment. Experimental Eye Research. 205, 108492 (2021).
- Okawa, H., Sampath, A. P., Laughlin, S. B., Fain, G. L. ATP consumption by mammalian rod photoreceptors in darkness and in light. Current Biology. 18 (24), 1917-1921 (2008).
- Lakkaraju, A., et al. The cell biology of the retinal pigment epithelium. Progress in Retinal and Eye Research. , 100846 (2020).
- Yu, J., et al. Emerging strategies of engineering retinal organoids and organoid-on-a-chip in modeling intraocular drug delivery: Current progress and future perspectives. Advanced Drug Delivery Reviews. 197, 114842 (2023).
- Arjamaa, O., Nikinmaa, M. Oxygen-dependent diseases in the retina: role of hypoxia-inducible factors. Experimental Eye Research. 83 (3), 473-483 (2006).
- Kamat, V., et al. A Versatile Multi-Channel Fluidics System for the Maintenance and Real-Time Metabolic and Functional Assessment of Tissue or Cells. Cell Reports Methods. In Press. , (2023).
- Neal, A., et al. Quantification of Low-Level Drug Effects Using Real-Time, in vitro Measurement of Oxygen Consumption Rate. Toxicological Sciences. 148 (2), 594-602 (2015).
- Jung, S. R., et al. Reduced cytochrome C is an essential regulator of sustained insulin secretion by pancreatic islets. The Journal of Biological Chemistry. 286 (20), 17422-17434 (2011).
- Rountree, A. M., et al. Control of insulin secretion by cytochrome C and calcium signaling in islets with impaired metabolism. The Journal of Biological Chemistry. 289 (27), 19110-19119 (2014).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Molecular Vision. 24, 425-433 (2018).
- Jarrett, S. G., Rohrer, B., Perron, N. R., Beeson, C., Boulton, M. E. Assessment of mitochondrial damage in retinal cells and tissues using quantitative polymerase chain reaction for mitochondrial DNA damage and extracellular flux assay for mitochondrial respiration activity. Methods in Molecular Biology. 935, 227-243 (2013).
- Perron, N. R., Beeson, C., Rohrer, B. Early alterations in mitochondrial reserve capacity; a means to predict subsequent photoreceptor cell death. Journal of Bioenergetics and Biomembranes. 45 (1-2), 101-109 (2013).
- Cabrera, O., et al. high-throughput assays for evaluation of human pancreatic islet function. Cell Transplantation. 16 (10), 1039-1048 (2008).
- Doliba, N. M., Qin, W., Vinogradov, S. A., Wilson, D. F., Matschinsky, F. M. Palmitic acid acutely inhibits acetylcholine- but not GLP-1-stimulated insulin secretion in mouse pancreatic islets. American Journal of Physiology. Endocrinology and Metabolism. 299 (3), E475-E485 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유