4.1 : Estequiometria de Reações
Uma equação química equilibrada fornece uma grande quantidade de informação em um formato muito sucinto. As fórmulas químicas fornecem a identidade dos reagentes e produtos envolvidos na alteração química, permitindo a classificação da reação. Os coeficientes fornecem o número relativo dessas espécies químicas, permitindo uma avaliação quantitativa das relações entre as quantidades de substâncias consumidas e produzidas pela reação. Estas relações quantitativas são conhecidas como estequiometria da reação, um termo derivado das palavras Gregas stoicheion (que significa “elemento”) e metron (que significa “medida”).
A estequiometria de uma reação ajuda a prever quanto do reagente é necessário para produzir a quantidade desejada de produto, ou em alguns casos, quanto produto será formado a partir de uma quantidade específica do reagente.
Coeficientes Estequiométricos
Os coeficientes de uma equação química representam o número de moles de cada substância. Por exemplo, considere a reação entre o gás nitrogénio e o gás hidrogénio para produzir amoníaco. A estequiometria indica que uma mole de nitrogénio e três moles de hidrogénio reagem para produzir duas moles de amoníaco.

Uma vez que uma mole contém o número de moléculas de Avogadro, os números relativos de moléculas são os mesmos que os números relativos de moles. Uma forma alternativa de ler a equação é “uma molécula de nitrogénio e três moléculas de hidrogénio reagem para produzir duas moléculas de amoníaco”.
Factores Estequiométricos
Equações químicas equilibradas são usadas para determinar a quantidade de um reagente necessário para reagir com uma determinada quantidade de outro reagente, ou para produzir uma determinada quantidade de produto, e assim por diante. Os coeficientes na equação equilibrada são usados para derivar factores estequiométricos que permitem o cálculo da quantidade desejada. Na reação de hidrogénio e nitrogénio, as moléculas de amoníaco são produzidas a partir de moléculas de hidrogénio em uma relação de 2:3. Isto significa que três moles de hidrogénio são estequiometricamente equivalentes a duas moles de amoníaco.
Com base nisso, são derivados os seguintes factores estequiométricos:
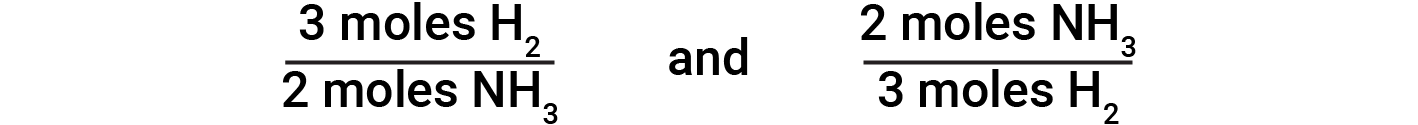
Estes factores estequiométricos podem ser usados para calcular o número de moléculas de amoníaco produzidas a partir de um determinado número de moléculas de hidrogénio, ou o número de moléculas de hidrogénio necessárias para produzir um determinado número de moléculas de amoníaco. Factores semelhantes podem ser derivados para qualquer par de substâncias em qualquer equação química.
Conversões Mole-Mole
Para uma reação química equilibrada para a formação de amoníaco a partir de nitrogénio e hidrogénio, a seguinte relação estequiométrica de moles entre N2 e NH3 é de 1:2. Então, a quantidade molar de amoníaco é derivada multiplicando a quantidade molar de nitrogénio pelo factor de conversão estequiométrico relativo às duas substâncias de interesse.

Conversões Massa-Massa
A conversão entre massas de substâncias baseadas em estequiometria requer o conhecimento das relações de mole e de massas molares. Por exemplo, para encontrar a massa de hidrogénio necessária para produzir 0,170 kg de amoníaco, em primeiro lugar, a massa molar de amoníaco é utilizada para converter a massa de amoníaco na quantidade de amoníaco (em moles). Em seguida, o factor estequiométrico apropriado da equação equilibrada converte a quantidade de amoníaco (em moles) na quantidade de hidrogénio (em moles). Por fim, a massa molar de hidrogénio converte a quantidade de hidrogénio (em moles) em massa de hidrogénio.
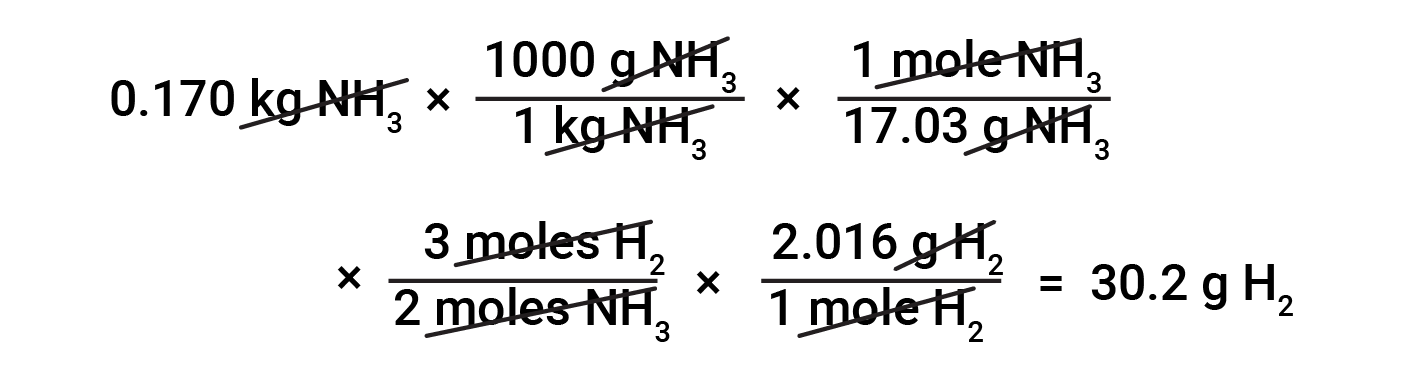
Inúmeras variações nos passos computacionais iniciais e finais são possíveis dependendo das quantidades particulares fornecidas e procuradas (volumes, concentrações de soluções, e assim por diante). Independentemente dos detalhes, todos esses cálculos compartilham um componente essencial comum: o uso de factores estequiométricos derivados de equações químicas equilibradas.
Este texto é adaptado de OpenStax Chemistry 2e, Section 4.3: Reaction Stoichiometry.
Do Capítulo 4:

Now Playing
4.1 : Estequiometria de Reações
Quantidades Químicas e Reações Aquosas
65.6K Visualizações

4.2 : Reagente Limitante
Quantidades Químicas e Reações Aquosas
58.4K Visualizações

4.3 : Rendimento das Reações
Quantidades Químicas e Reações Aquosas
50.9K Visualizações

4.4 : Propriedades Gerais das Soluções
Quantidades Químicas e Reações Aquosas
30.2K Visualizações

4.5 : Concentração e Diluição de Soluções
Quantidades Químicas e Reações Aquosas
83.9K Visualizações

4.6 : Soluções Eletrolíticas e Não Eletrolíticas
Quantidades Químicas e Reações Aquosas
62.2K Visualizações

4.7 : Solubilidade de Compostos Iônicos
Quantidades Químicas e Reações Aquosas
62.4K Visualizações

4.8 : Reações Químicas em Soluções Aquosas
Quantidades Químicas e Reações Aquosas
60.0K Visualizações

4.9 : Reações de Precipitação
Quantidades Químicas e Reações Aquosas
50.0K Visualizações

4.10 : Reações de Oxidação-Redução
Quantidades Químicas e Reações Aquosas
64.2K Visualizações

4.11 : Números de Oxidação
Quantidades Químicas e Reações Aquosas
36.7K Visualizações

4.12 : Reações de Ácidos, Bases e de Neutralização
Quantidades Químicas e Reações Aquosas
54.3K Visualizações

4.13 : Reações de Síntese e Decomposição
Quantidades Químicas e Reações Aquosas
32.3K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados