A não ser que gases individuais reajam quimicamente uns com os outros, os gases individuais em uma mistura de gases não afectam a pressão uns dos outros. Cada gás em uma mistura exerce a mesma pressão que exerceria se estivesse presente sozinho no recipiente. A pressão exercida por cada gás individual em uma mistura é designada por pressão parcial.
Isto significa que em uma mistura contendo três gases diferentes A, B, e C, se PA for a pressão parcial do gás A; PB for a pressão parcial do gás B; PC for a pressão parcial do gás C; então, a pressão total é dada pela equação 1:
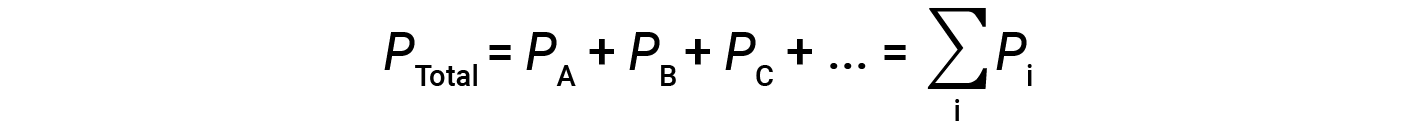
Esta é a lei de Dalton de pressões parciais: A pressão total de uma mistura de gases ideais é igual à soma das pressões parciais dos gases componentes.
Se nA, nB, e nC for o número de moles de cada um dos gases da mistura, se cada gás obedece à equação de gás ideal, a pressão parcial pode ser escrita como:
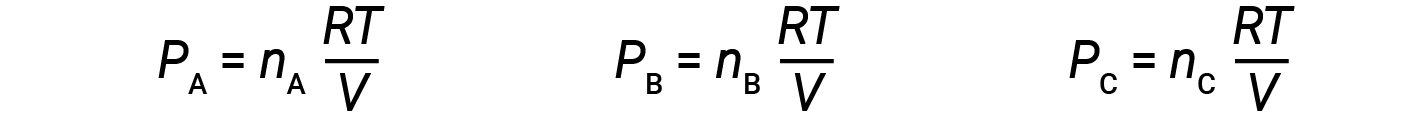
Uma vez que todos os gases estão à mesma temperatura e ocupam o mesmo volume, ao substituir a equação 1 obtemos:
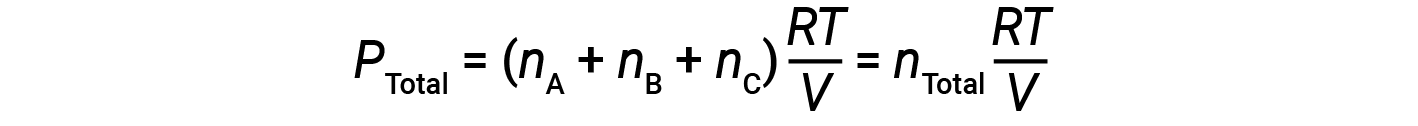
A equação indica que a uma temperatura constante e um volume constante, a pressão total de uma amostra de gás é determinada pelo número total de moles de gás presentes.
Para as misturas de gases, é conveniente introduzir uma quantidade designada por fração molar, χ, que é definida como o número de moles de uma determinada substância em uma mistura dividida pelo número total de moles de todas as substâncias presentes. Matematicamente, a fração molar de uma substância A em uma mistura com B e C é expressa como
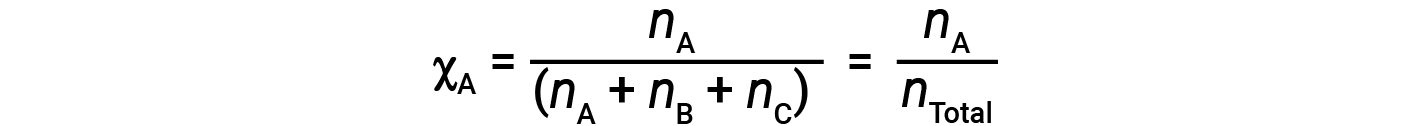
Da mesma forma, as frações molares de B e C são;
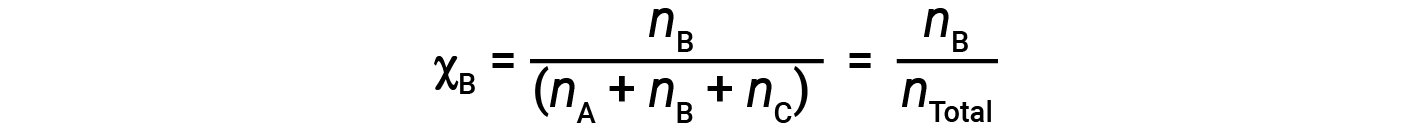
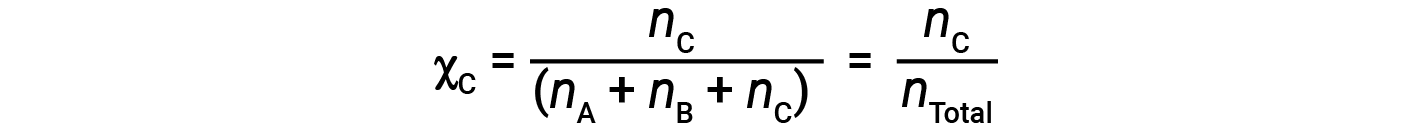
A combinação da equação para a fração molar de A e da equação para a pressão parcial dá:
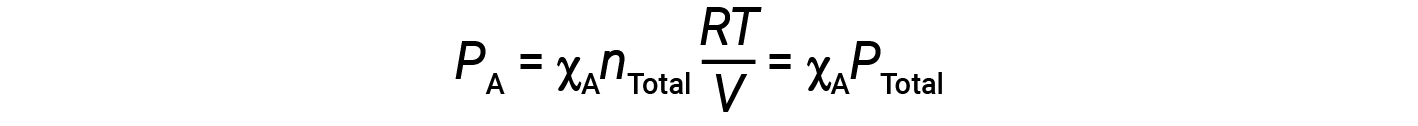
A pressão parcial do gás A está relacionada com a pressão total da mistura de gases através da sua fração molar.
Por outras palavras, a pressão de um gás em uma mistura de gases é o produto da sua fração molar e da pressão total da mistura.
Este texto é adaptado de Openstax, Chemistry 2e, Section 9.3: Stoichiometry of Gaseous Substances, Mixtures, and Reactions.
Tags
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados