Quando sólidos, líquidos, ou gases condensados são suficientemente aquecidos, eles irradiam alguma energia em excesso na forma de luz. Os fotões produzidos desta forma têm uma gama de energias, produzindo assim um espectro contínuo no qual uma série de comprimentos de onda não quebrados está presente.
Ao contrário dos espectros contínuos, a luz também pode ocorrer como espectros discretos ou de linha com larguras de linha muito estreitas intercaladas ao longo das regiões espectrais. Excitar um gás a baixa pressão parcial utilizando uma corrente elétrica, ou o seu aquecimento, irá produzir espectros de linha. As lâmpadas fluorescentes e os sinais de néon funcionam desta forma. Cada elemento apresenta o seu próprio conjunto de linhas característico, tal como as moléculas, embora os seus espectros sejam geralmente muito mais complicados.
Cada linha de emissão consiste em um único comprimento de onda de luz, o que implica que a luz emitida por um gás consiste em um conjunto de energias discretas. Por exemplo, quando uma descarga elétrica passa através de um tubo que contém hidrogénio a baixa pressão, as moléculas H2 são divididas em átomos H separados e é observada uma cor azul-rosa. Passando a luz através de um prisma produz um espectro de linha, indicando que esta luz é composta por fotões de quatro comprimentos de onda visíveis.
A origem dos espectros discretos em átomos e moléculas foi extremamente intrigante para os cientistas no final do século XIX. De acordo com a teoria eletromagnética clássica, apenas espectros contínuos deveriam ser observados. Outras linhas discretas para o átomo de hidrogénio foram encontradas nas regiões UV e IV. Johannes Rydberg generalizou o trabalho de Balmer e desenvolveu uma fórmula empírica que previa todas as linhas de emissão do hidrogénio, não apenas as restritas à gama visível, onde , n1 e n2 são inteiros, n1 < n2
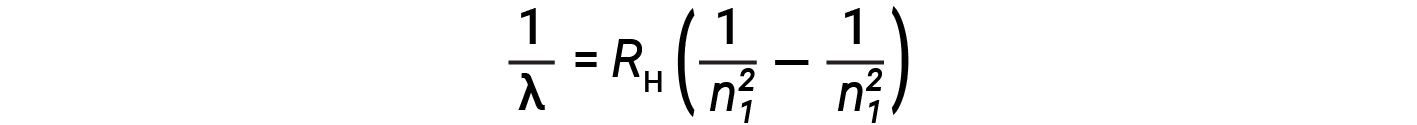
Mesmo no final do século XIX, a espectroscopia era uma ciência muito precisa, pelo que os comprimentos de onda do hidrogénio foram medidos com uma precisão muito elevada, o que implicou que a constante Rydberg pudesse ser também determinada com muita precisão. Que uma fórmula tão simples como a fórmula de Rydberg poderia explicar tais medições precisas parecia surpreendente na altura, mas foi a eventual explicação para os espectros de emissões por Neils Bohr em 1913 que, em última análise, convenceu os cientistas a abandonarem a física clássica e estimulou o desenvolvimento da mecânica quântica moderna.
Este texto foi adaptado de Openstax, Chemistry 2e, Section 3.1: Electromagnetic Energy.
Do Capítulo 7:

Now Playing
7.6 : Espectros de Emissão
Estrutura Eletrônica dos Átomos
48.6K Visualizações

7.1 : A Natureza Ondulatória da Luz
Estrutura Eletrônica dos Átomos
47.8K Visualizações

7.2 : O Espectro Eletromagnético
Estrutura Eletrônica dos Átomos
52.1K Visualizações

7.3 : Interferência e Difração
Estrutura Eletrônica dos Átomos
29.6K Visualizações

7.4 : Efeito Fotoelétrico
Estrutura Eletrônica dos Átomos
29.0K Visualizações

7.5 : O Modelo de Bohr
Estrutura Eletrônica dos Átomos
49.0K Visualizações

7.7 : O Comprimento de Onda de De Broglie
Estrutura Eletrônica dos Átomos
25.1K Visualizações

7.8 : O Princípio da Incerteza
Estrutura Eletrônica dos Átomos
22.7K Visualizações

7.9 : O Modelo Mecânico-Quântico de um Átomo
Estrutura Eletrônica dos Átomos
41.4K Visualizações

7.10 : Números Quânticos
Estrutura Eletrônica dos Átomos
33.9K Visualizações

7.11 : Orbitais Atômicos
Estrutura Eletrônica dos Átomos
32.7K Visualizações

7.12 : O Princípio da Exclusão de Pauli
Estrutura Eletrônica dos Átomos
32.8K Visualizações

7.13 : As Energias das Orbitais Atômicos
Estrutura Eletrônica dos Átomos
23.5K Visualizações

7.14 : O Princípio de Aufbau e a Regra de Hund
Estrutura Eletrônica dos Átomos
41.9K Visualizações

7.15 : Configuração Eletrônica de Átomos com Múltiplos Elétrons
Estrutura Eletrônica dos Átomos
36.8K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados