Para determinar a configuração eletrónica para qualquer átomo específico, podemos construir as estruturas por ordem dos números atómicos. Começando com o hidrogénio, e continuando ao longo dos períodos da tabela periódica, adicionamos um protão de cada vez ao núcleo e um eletrão à subcamada adequada até termos descrito as configurações eletrónicas de todos os elementos. Este procedimento é chamado de princípio de aufbau, da palavra Alemã aufbau (“para construir”). Cada eletrão adicionado ocupa a subcamada de menor energia disponível, sujeito às limitações impostas pelos números quânticos permitidos de acordo com o princípio de exclusão de Pauli. Os eletrões entram em subcamadas de maior energia apenas depois de subcamadas de menor energia terem sido preenchidas até à capacidade. A Figura 1 ilustra a maneira tradicional de lembrar a ordem de preenchimento para orbitais atómicas.
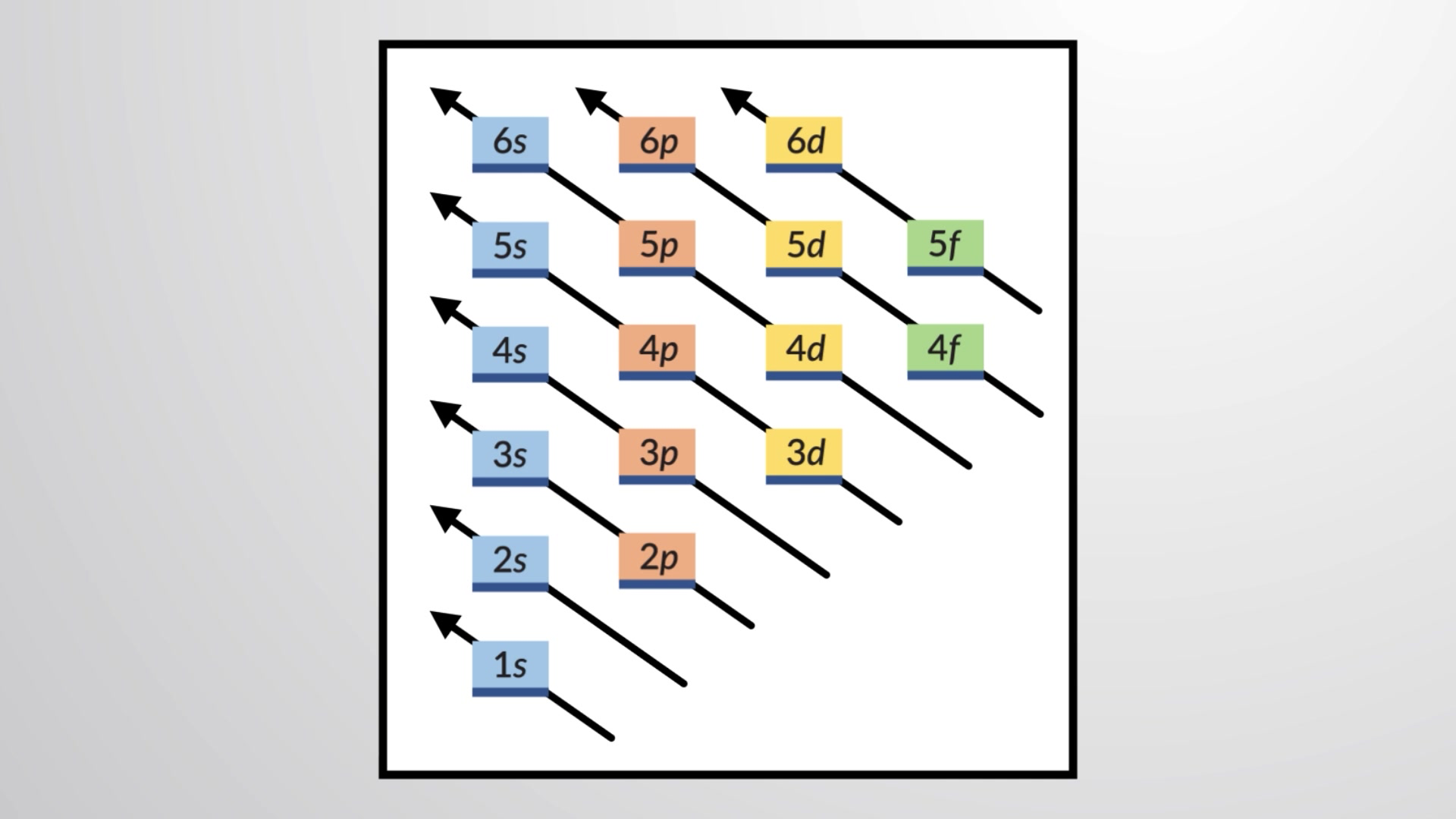
Figura 1 Este diagrama mostra a ordem de energia para orbitais atómicas e é útil para derivar configurações eletrónicas em estado fundamental.
Considere escrever a configuração eletrónica para o carbono—um elemento com número atómico seis. Quatro eletrões preenchem as orbitais 1s e 2s. Os dois eletrões restantes ocupam a subcamada 2p. Agora, temos a opção de preencher uma das orbitais 2p e de emparelhar os eletrões ou de deixar os eletrões desemparelhados em duas orbitais p diferentes, mas degeneradas. As orbitais são preenchidas conforme descrito pela regra de Hund: A configuração de energia mais baixa para um átomo com eletrões dentro de um conjunto de orbitais degeneradas é a que tem o número máximo de eletrões não emparelhados. Assim, os dois eletrões nas orbitais 2p do carbono têm números quânticos n, l, e ms idênticos e diferem no seu número quântico ml (de acordo com o princípio de exclusão de Pauli). O diagrama orbital para carbono, com uma configuração eletrónica de 1s22s21p2 é:

O nitrogénio (número atómico 7) preenche as subcamadas 1s e 2s e tem um eletrão em cada uma das três orbitais 2p, de acordo com a regra de Hund. Estes três eletrões têm spins não emparelhados. O oxigénio (número atómico 8) tem um par de eletrões em qualquer uma das orbitais 2p (os eletrões têm spins opostos) e um único eletrão em cada uma das outras duas. O flúor (número atómico 9) tem apenas uma orbital 2p que contém um eletrão não emparelhado. Todos os eletrões do gás nobre néon (número atómico 10) estão emparelhados e todas as orbitais nas camadas n = 1 e n = 2 estão cheias.
Este texto é adaptado de Openstax, Chemistry 2e, Section 6.4: Electronic Structure of Atoms.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados