Soluções de Gases em Líquidos
Com com qualquer solução, a solubilidade de um gás em um líquido é afectada pelas forças intermoleculares de atração entre as espécies de soluto e solvente. Ao contrário dos solutos sólidos e líquidos, no entanto, não há atração intermolecular soluto-soluto para superar quando um soluto gasoso se dissolve em um solvente líquido, uma vez que os átomos ou moléculas que compõem um gás estão muito separados e experienciam interações negligenciáveis. Consequentemente, as interações soluto-solvente são o único factor energético que afecta a solubilidade. Por exemplo, a solubilidade em água do oxigénio é aproximadamente três vezes maior do que a do hélio (existem maiores forças de dispersão entre a água e as moléculas de oxigénio maiores), mas 100 vezes menor do que a solubilidade do clorometano, CHCl3 (as moléculas polares de clorometano experienciam atração dipolo-dipolo com as moléculas de água polares). Da mesma forma, note que a solubilidade do oxigénio no hexano, C6H14, é aproximadamente 20 vezes maior do que na água, pois existem maiores forças de dispersão entre o oxigénio e as moléculas de hexano maiores.
A temperatura é outro factor que afecta a solubilidade, com a solubilidade dos gases tipicamente diminuindo à medida que a temperatura aumenta. Esta relação inversa entre a temperatura e a concentração de gás dissolvido é responsável por um dos principais impactos da poluição térmica em águas naturais.
A solubilidade de um soluto gasoso também é afectada pela pressão parcial do soluto no gás ao qual a solução é exposta. A solubilidade gasosa aumenta à medida que a pressão do gás aumenta.
Para muitos solutos gasosos, a relação entre solubilidade, Sgas, e pressão parcial, Pgas, é proporcional:
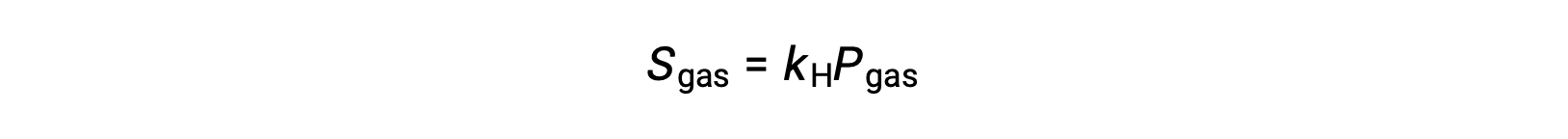
onde kH é uma constante de proporcionalidade que depende das identidades do soluto gasoso e do solvente e da temperatura da solução. Esta é uma declaração matemática da lei de Henry: A quantidade de um gás ideal que se dissolve em um volume definido de líquido é diretamente proporcional à pressão do gás.
Este texto é adaptado de Openstax, Chemistry 2e, Section 11.3: Solubility.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados