A equação de Arrhenius relaciona a energia de ativação e a constante de velocidade, k, para reações químicas. Na equação de Arrhenius, k = Ae−Ea/RT, R é a constante de gás ideal, que tem um valor de 8,314 J/mol·K, T é a temperatura na escala de kelvin, Ea é a energia de ativação em J/mole, e é a constante 2,7183, e A é uma constante chamada de factor de frequência, que está relacionada com a frequência de colisões e com a orientação das moléculas reativas.
A equação de Arrhenius pode ser utilizada para calcular a energia de ativação de uma reação a partir de dados cinéticos experimentais. Uma abordagem conveniente para determinar a Ea para uma reação envolve a medição de k a duas ou mais temperaturas diferentes. Ela utiliza uma versão modificada da equação de Arrhenius que assume a forma de uma equação linear:
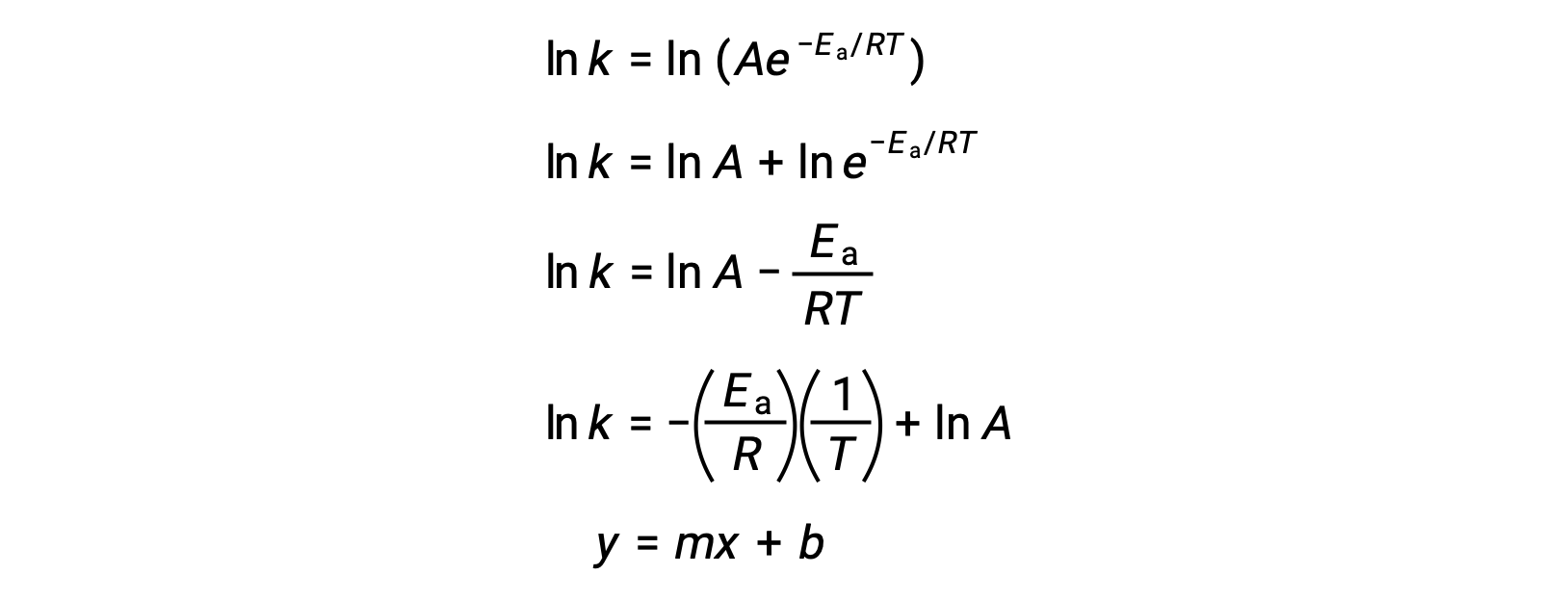
Um gráfico de ln k versus 1/T é linear com um declive igual a −Ea/R e intercepção y igual a ln A.
Considere a seguinte reação:
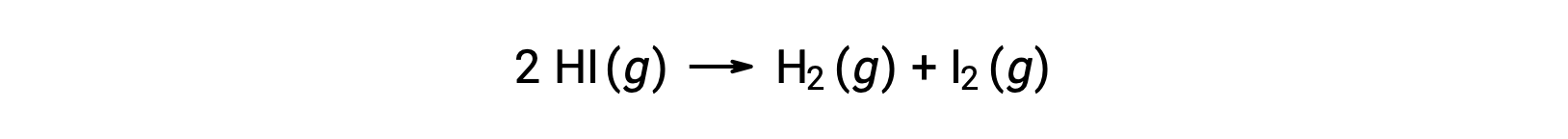
A energia de ativação desta reação pode ser determinada se a variação na constante da velocidade com a temperatura for conhecida a partir dos dados cinéticos da reação, conforme mostrado.
| Temperatura (K) | Constante de velocidade (L/mol/s) |
| 555 | 3,52 × 10–7 |
| 575 | 1,22 × 10–6 |
| 645 | 8,59 × 10–5 |
| 700 | 1,16 × 10–3 |
| 781 | 3,95× 10–2 |
Os dados fornecidos podem ser utilizados para derivar os valores do inverso da temperatura (1/T) e do log natural de k (ln k).
| 1/T (K–1) | ln k |
| 1,80 × 10–3 | –14,860 |
| 1,74 × 10–3 | –13,617 |
| 1,55 × 10–3 | –9,362 |
| 1,43 × 10–3 | –6,759 |
| 1,28 × 10–3 | –3,231 |
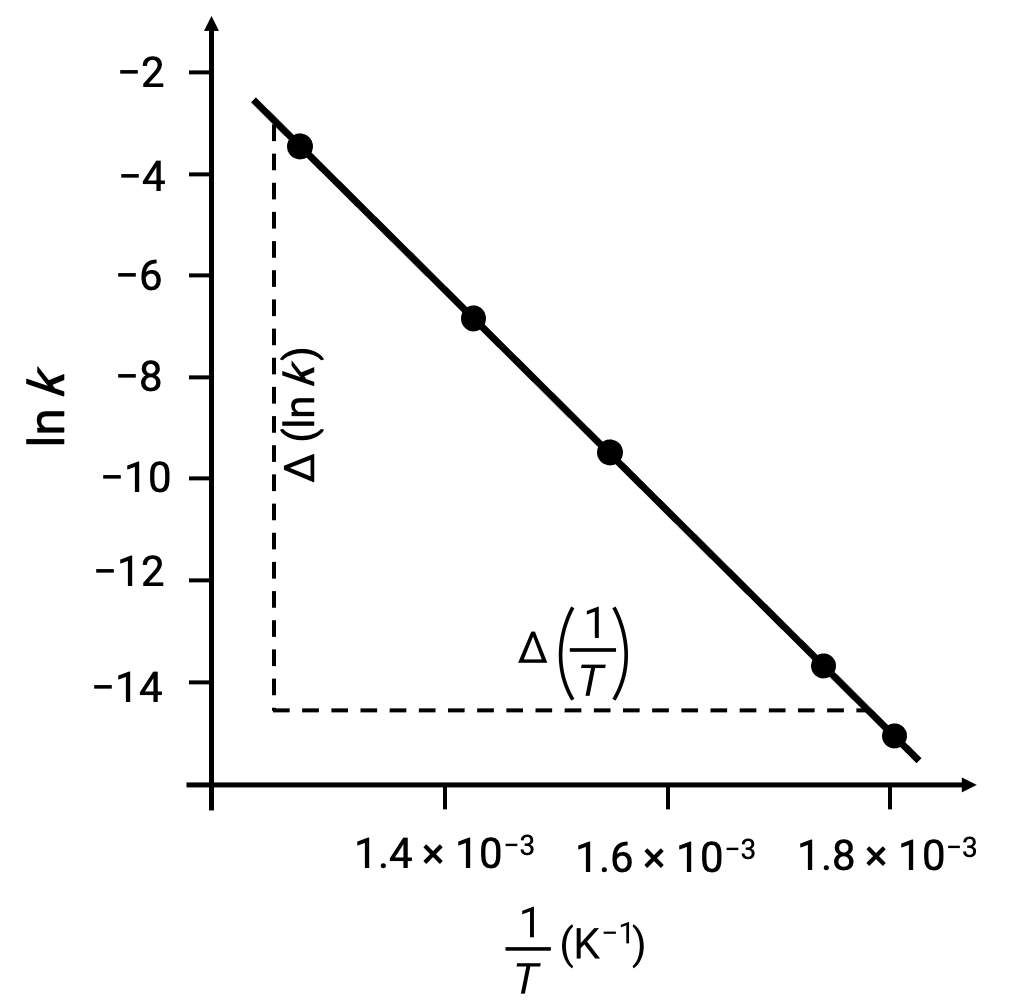
Ao representar graficamente os pontos de dados derivados com ln k versus 1/T, é gerado um gráfico de linha exibindo uma relação linear entre ln k e 1/T, como mostrado.
O declive da linha, que corresponde à energia de ativação, pode ser estimado usando dois pares de dados experimentais.

Uma abordagem alternativa ao derivar energia de ativação envolve a utilização da constante de velocidade a duas temperaturas diferentes. Nesta abordagem, a equação de Arrhenius é reorganizada em um formato conveniente de dois pontos:
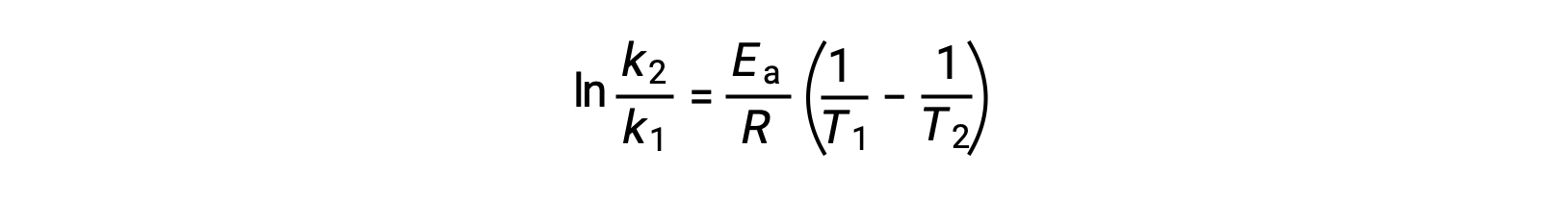
Ao reorganizar a equação, é gerada uma expressão para a energia de ativação.
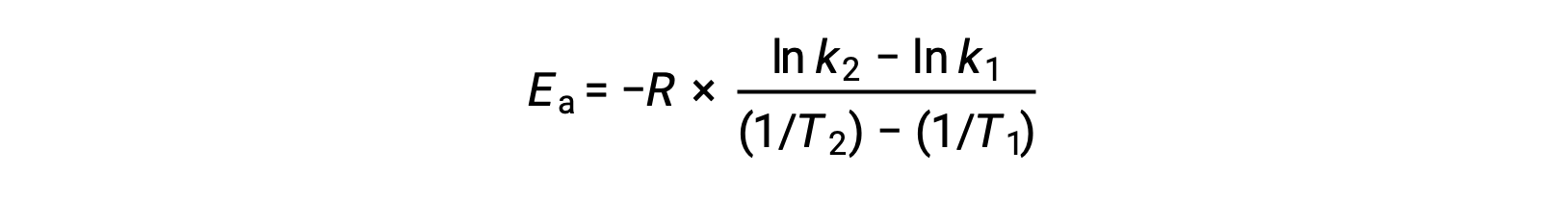
Ao substituir quaisquer dois pares de dados e fazendo outros cálculos, obtém-se o valor da energia de ativação em joules por mole ou quilojoules por mole.
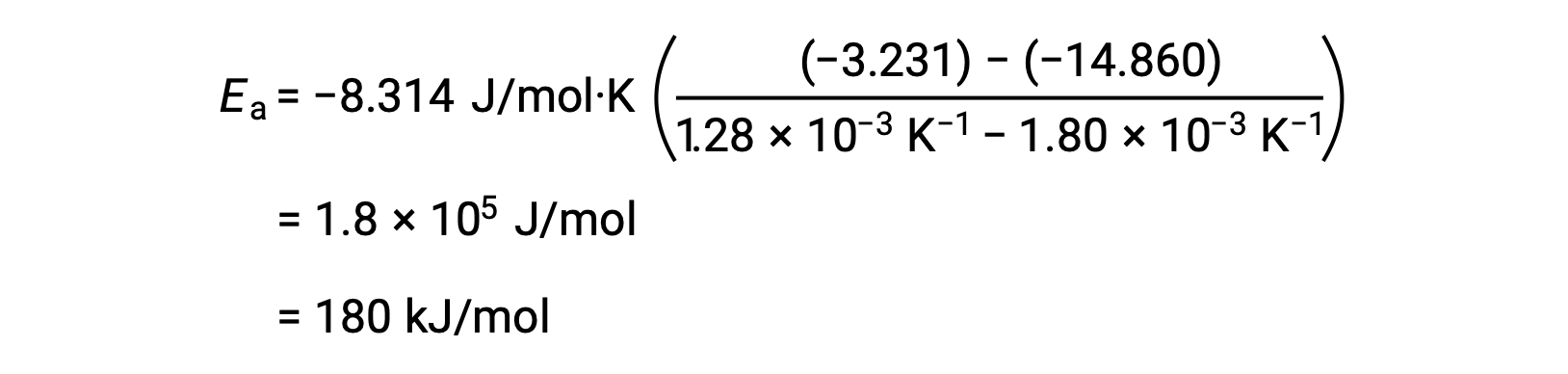
Esta abordagem alternativa de dois pontos produz o mesmo resultado que a abordagem gráfica. No entanto, na prática, a abordagem gráfica normalmente fornece resultados mais fiáveis ao trabalhar com dados experimentais reais.
Este texto é adaptado de Openstax, Chemistry 2e, Section 12.5: Collision Theory.
Tags
Do Capítulo 13:

Now Playing
13.8 : Equação de Arrhenius
Cinética Química
37.1K Visualizações

13.1 : Velocidade de Reação
Cinética Química
49.8K Visualizações

13.2 : Medição das Velociades de Reação
Cinética Química
23.7K Visualizações

13.3 : Concentração e Lei da Velocidade
Cinética Química
29.1K Visualizações

13.4 : Determinação da Ordem de Reação
Cinética Química
54.0K Visualizações

13.5 : A Lei da Velocidade Integrada: A Dependência da Concentração em Relação ao Tempo
Cinética Química
33.5K Visualizações

13.6 : Meia-vida de uma Reação
Cinética Química
33.3K Visualizações

13.7 : Dependência da Temperatura em Relação à Velocidade de Reação
Cinética Química
80.2K Visualizações

13.9 : Mecanismos de Reação
Cinética Química
24.6K Visualizações

13.10 : Passos Determinantes da Velocidade
Cinética Química
30.9K Visualizações

13.11 : Catálise
Cinética Química
26.0K Visualizações

13.12 : Enzimas
Cinética Química
79.8K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados