15.6 : Soluções de Ácidos e Bases Fortes
Um ácido forte é um composto que se dissocia completamente em uma solução aquosa e produz uma concentração de iões hidrónio igual à concentração inicial de ácido. Por exemplo, o ácido hidrobrómico a 0,20 M irá dissociar-se completamente em água e produzir 0,20 M de iões hidrónio e 0,20 M de iões brometo.

Por outro lado, uma base forte é um composto que se dissocia completamente em uma solução aquosa e produz iões hidróxido. Por exemplo, 0,015 M de KOH, hidróxido de metal do grupo 1, irá dissociar-se completamente e produzir 0,015 M de OH- e 0,015 M de K+.
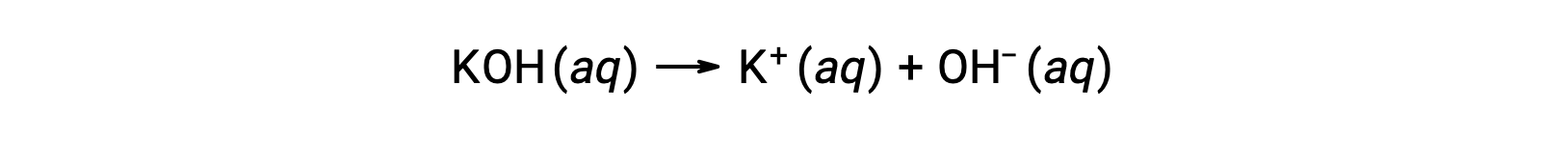
Os hidróxidos metálicos do grupo 2, como o hidróxido de bário [Ba(OH)2] e o hidróxido de estrôncio [Sr(OH)2], são também bases fortes e possuem dois iões hidróxido. Isto faz com que produzam uma solução mais básica comparada com NaOH ou KOH à mesma concentração. Por exemplo, 0,015 M de Ba(OH)2 produzem 0,015 M de Ba+ e 0,030 M hydroxide.
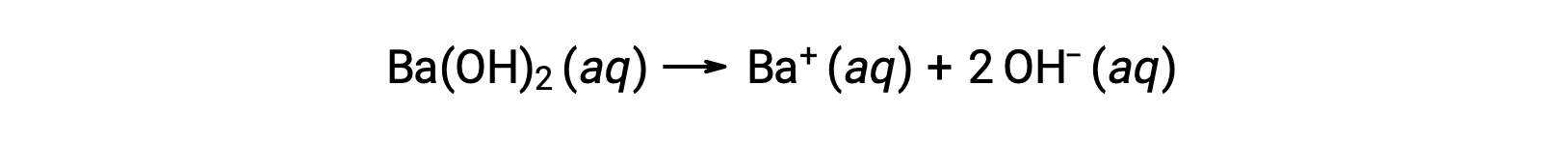
Como os ácidos e bases fortes se dissociam completamente, as razões molares podem ser usadas para determinar as suas concentrações de hidrónio e hidróxido, que por sua vez podem ser usadas para calcular o pH ou pOH de uma solução. Por exemplo, uma solução de HCl a 0,030 M irá produzir 0,03 M de iões hidronónio. Por conseguinte, o pH desta solução será de

O pOH da mesma solução pode ser determinado usando a fórmula
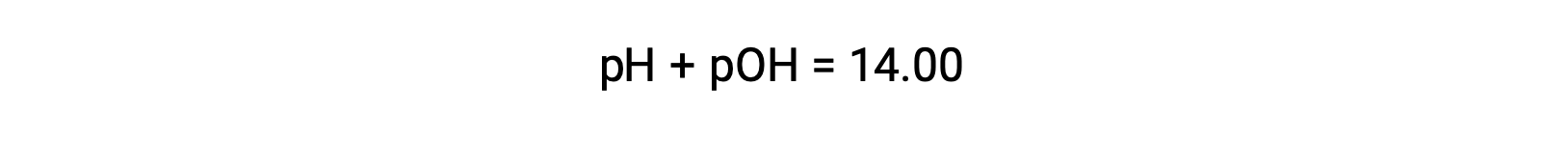
Como o pH da solução é 1,52, o seu pOH pode ser calculado como

Da mesma forma, a concentração de iões hidróxido produzidos por bases fortes pode ser utilizada para determinar o pOH de uma solução utilizando a equação
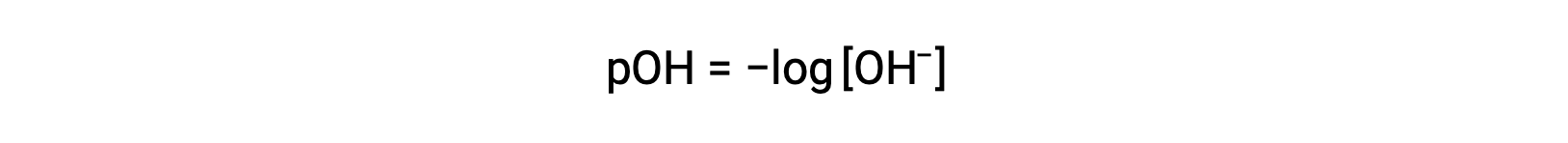
A equação acima também pode ser usada para determinar a concentração de iões hidróxido quando se sabe o pOH. Por exemplo, se o pOH de uma solução for 3,00,
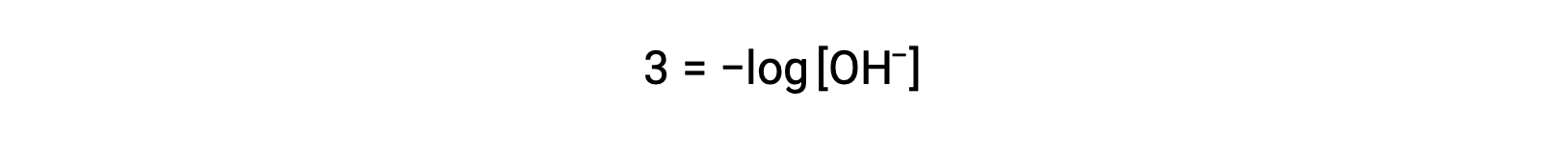
A multiplicação de ambos os lados por −1 dá
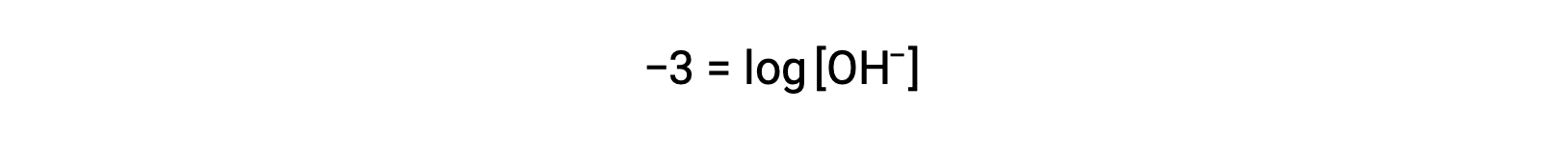
Agora, pegue o antilog de ambos os lados
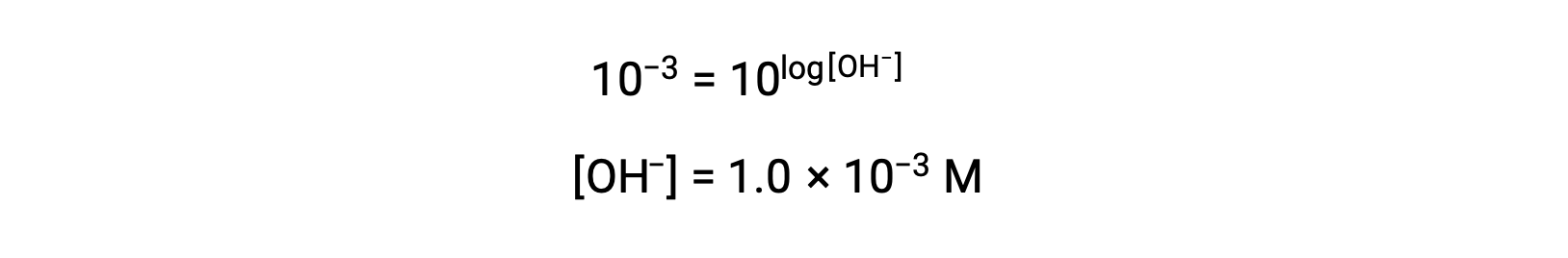
Assim, a concentração de iões hidrónio da solução com pOH 3 é de 1,0 × 10−3 M. Um método semelhante pode ser usado para determinar a concentração de iões hidrónio de uma solução se o seu pH for conhecido.
Do Capítulo 15:

Now Playing
15.6 : Soluções de Ácidos e Bases Fortes
Ácidos e Bases
31.4K Visualizações

15.1 : Ácidos e Bases de Bronsted-Lowry
Ácidos e Bases
90.9K Visualizações

15.2 : Forças de Ácidos/Bases e Constantes de Dissociação
Ácidos e Bases
60.2K Visualizações

15.3 : Água: Um Ácido e Base de Bronsted-Lowry
Ácidos e Bases
50.0K Visualizações

15.4 : Escala de pH
Ácidos e Bases
68.3K Visualizações

15.5 : Forças Relativas de Pares Ácido-Base Conjugados
Ácidos e Bases
45.3K Visualizações

15.7 : Soluções de Ácidos Fracos
Ácidos e Bases
37.6K Visualizações

15.8 : Soluções de Bases Fracas
Ácidos e Bases
22.5K Visualizações

15.9 : Misturas de Ácidos
Ácidos e Bases
19.5K Visualizações

15.10 : Íons como Ácidos e Bases
Ácidos e Bases
23.6K Visualizações

15.11 : Determinação do pH de Soluções Salinas
Ácidos e Bases
43.3K Visualizações

15.12 : Ácidos Polipróticos
Ácidos e Bases
29.0K Visualizações

15.13 : Força e Estrutura Molecular de Ácidos
Ácidos e Bases
30.8K Visualizações

15.14 : Ácidos e Bases de Lewis
Ácidos e Bases
43.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados