15.8 : Soluções de Bases Fracas
Alguns compostos produzem iões hidróxido quando dissolvidos ao reagir quimicamente com moléculas de água. Em todos os casos, estes compostos reagem apenas parcialmente e são então classificados como bases fracas. Estes tipos de compostos também são abundantes na natureza e em utilidades importantes em várias tecnologias. Por exemplo, a produção global da base fraca amoníaco é normalmente superior a 100 toneladas métricas por ano, sendo amplamente utilizada como fertilizante agrícola, matéria-prima para a síntese química de outros compostos, e um ingrediente ativo nos produtos de limpeza domésticos. Quando dissolvido em água, o amoníaco reage parcialmente para produzir iões hidróxido, como se mostra aqui:
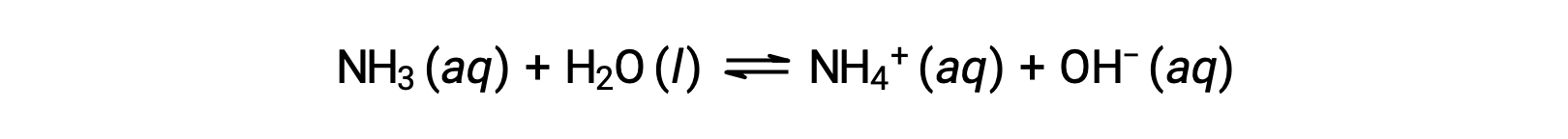
Trata-se, por definição, de uma reação ácido-base, neste caso envolvendo a transferência de iões H+ de moléculas de água para moléculas de amoníaco. Em condições típicas, apenas cerca de 1% do amoníaco dissolvido está presente como iões NH4+.
Cálculo das Concentrações de Iões Hidróxido e de pOH em uma Solução de Base Fraca
Encontrar a concentração de iões hidróxido, o pOH e o pH de uma solução de trimetilamina a 0,25 M, uma base fraca:
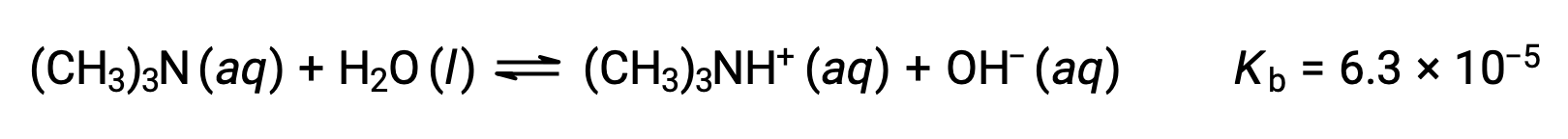
A tabela ICE para este sistema é
| (CH3)3N (aq) | (CH3)3NH+ (aq) | OH− (aq) | |
| Concentração Inicial (M) | 0,25 | 0 | ~0 |
| Alteração (M) | −x | +x | +x |
| Concentração em Equilíbrio (M) | 0,25 − x | 0 + x | ~0 + x |
Substituindo os termos de concentração de equilíbrio na expressão de Kb obtemos
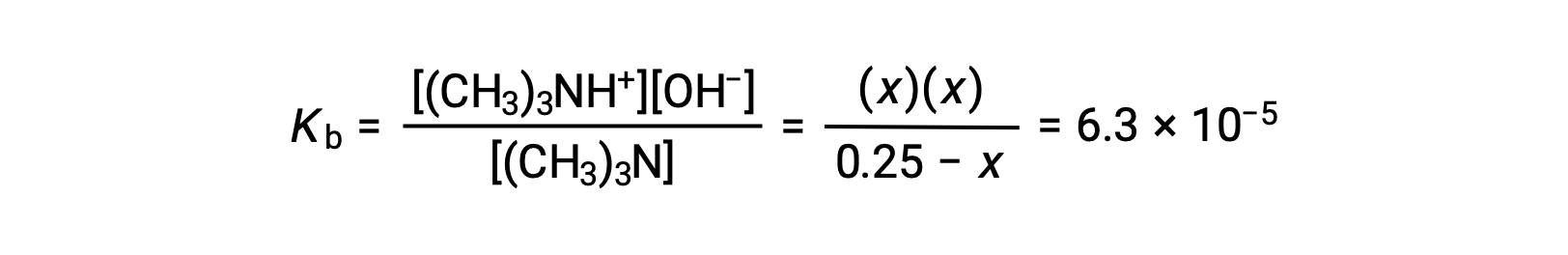
Assumindo que x << 0,25 e resolvendo para x obtemos
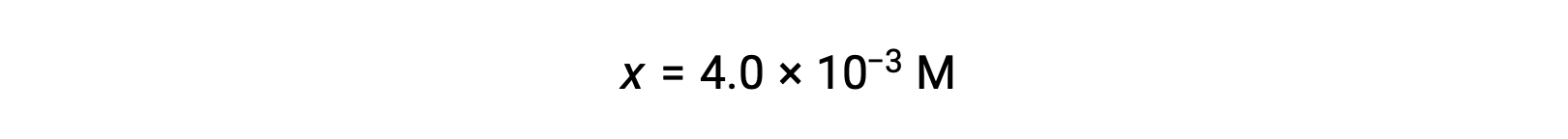
Este valor é inferior a 5% da concentração inicial (0,25), pelo que o pressuposto é justificado.
Como definido na tabela ICE, x é igual à concentração de equilíbrio do ião hidróxido:
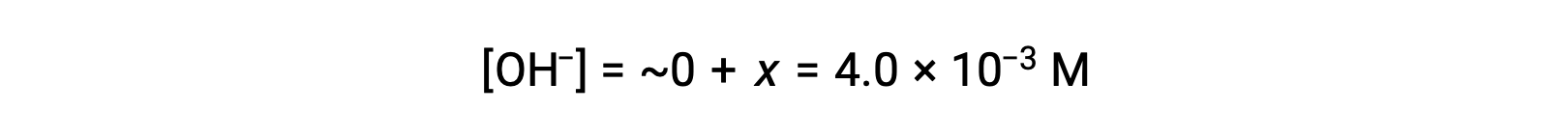
O pOH é calculado para ser
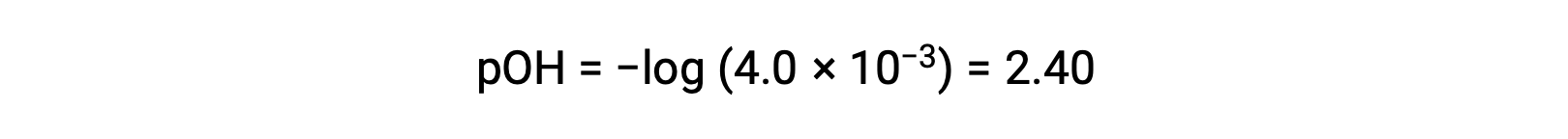
Utilizando a relação;
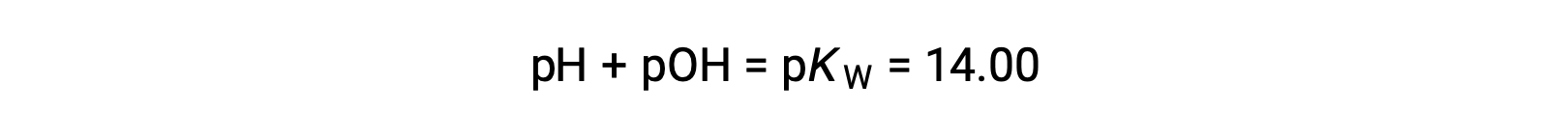
é permitido o cálculo do pH:
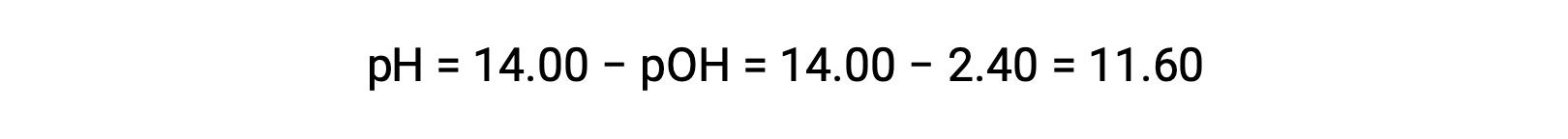
Determinação da Kb a partir do pH
Se o pH de solução de etilamina (C2H5NH2) a 0,28 M for 12,10, qual é a sua Kb?
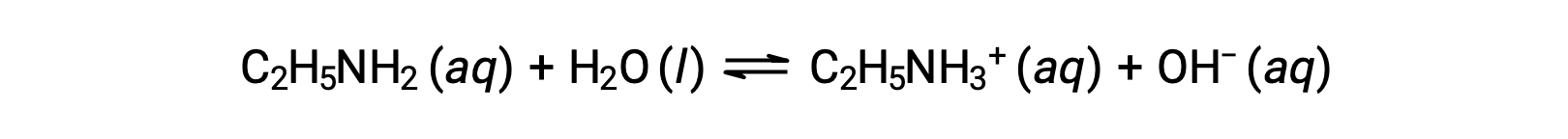
Para calcular a Kb da etilamina, primeiro é necessário determinar o pOH e a concentração de iões hidróxido. Como o pH é 12,10, o pOH pode ser calculado da seguinte forma:
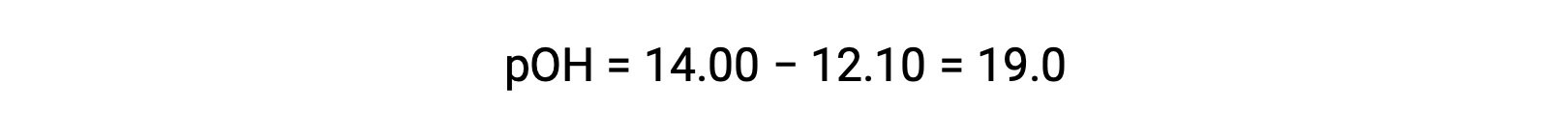
Como o pOH é 1,90, a concentração de iões hidróxido da solução pode ser calculada usando a fórmula
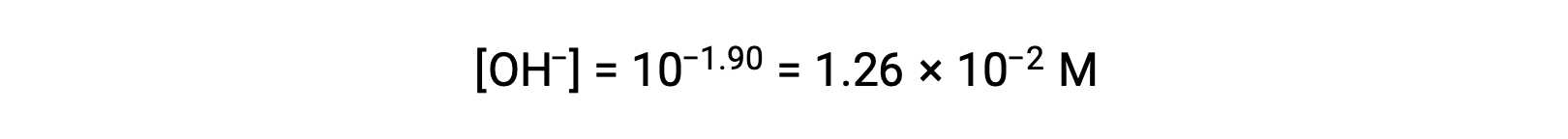
A tabela ICE pode ser construída para este sistema como se segue
| C2H5NH2 (aq) | C2H5NH3+ (aq) | OH− (aq) | |
| Concentração Inicial (M) | 0,28 | 0 | ~0 |
| Alteração (M) | −0,0126 | +0,0126 | +0,0126 |
| Concentração em Equilíbrio (M) | 0,28 − 0,0126 | 0,0126 | 0,0126 |
Uma vez que o valor de 0,0126 M é 4,5% de 0,28 M, 0,28 − 0,0126 pode ser considerado quase igual a 0,28 M pela regra dos 5%.
Após a substituição dos valores acima referidos na expressão para a Kb da etilamina,
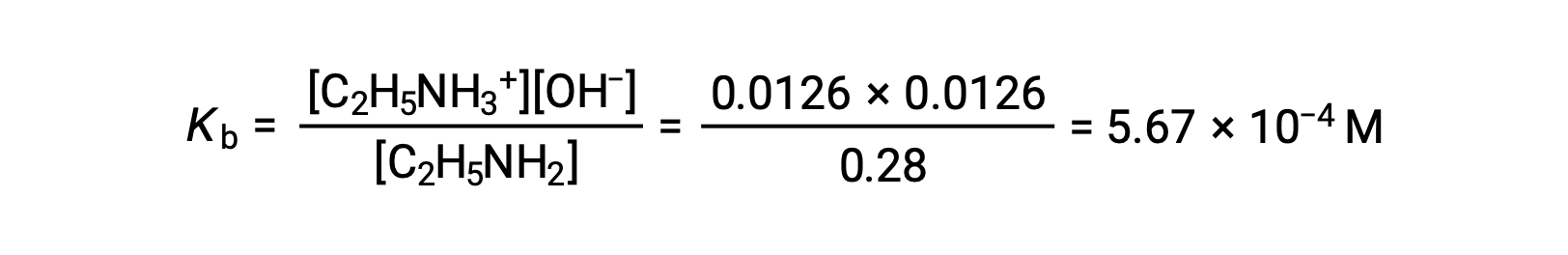
Este texto é adaptado de Openstax, Chemistry 2e Section 4.2: Classifying Chemical Reactions e 14.3 Relative Strengths of Acids and Bases.
Do Capítulo 15:

Now Playing
15.8 : Soluções de Bases Fracas
Ácidos e Bases
22.5K Visualizações

15.1 : Ácidos e Bases de Bronsted-Lowry
Ácidos e Bases
91.0K Visualizações

15.2 : Forças de Ácidos/Bases e Constantes de Dissociação
Ácidos e Bases
60.2K Visualizações

15.3 : Água: Um Ácido e Base de Bronsted-Lowry
Ácidos e Bases
50.0K Visualizações

15.4 : Escala de pH
Ácidos e Bases
68.4K Visualizações

15.5 : Forças Relativas de Pares Ácido-Base Conjugados
Ácidos e Bases
45.3K Visualizações

15.6 : Soluções de Ácidos e Bases Fortes
Ácidos e Bases
31.4K Visualizações

15.7 : Soluções de Ácidos Fracos
Ácidos e Bases
37.6K Visualizações

15.9 : Misturas de Ácidos
Ácidos e Bases
19.6K Visualizações

15.10 : Íons como Ácidos e Bases
Ácidos e Bases
23.6K Visualizações

15.11 : Determinação do pH de Soluções Salinas
Ácidos e Bases
43.3K Visualizações

15.12 : Ácidos Polipróticos
Ácidos e Bases
29.0K Visualizações

15.13 : Força e Estrutura Molecular de Ácidos
Ácidos e Bases
30.8K Visualizações

15.14 : Ácidos e Bases de Lewis
Ácidos e Bases
43.5K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados