A entropia é uma função de estado, de modo que a alteração da entropia padrão para uma reação química (ΔS°rxn) pode ser calculada a partir da diferença na entropia padrão entre os produtos e os reagentes.
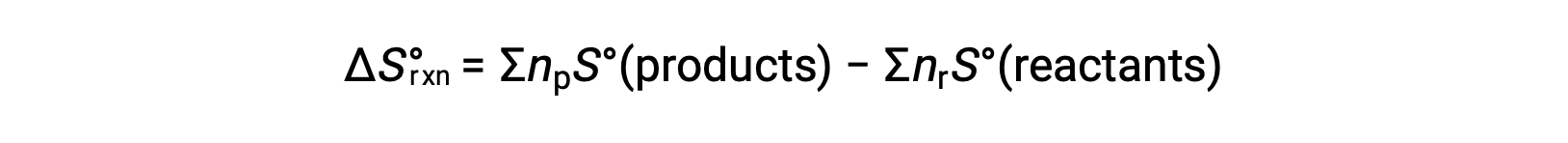
onde np e nr representam os coeficientes estequiométricos na equação equilibrada dos produtos e reagentes, respectivamente.
Por exemplo, ΔS°rxn para a seguinte reação à temperatura ambiente
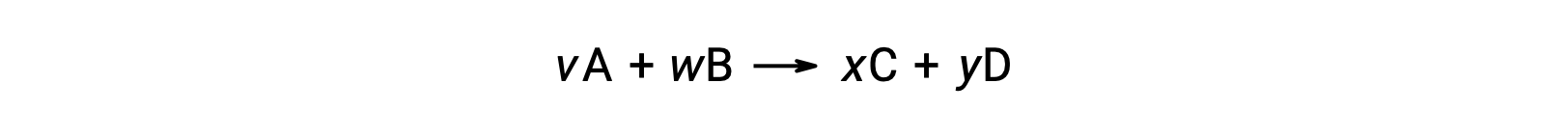
é calculada da seguinte forma:
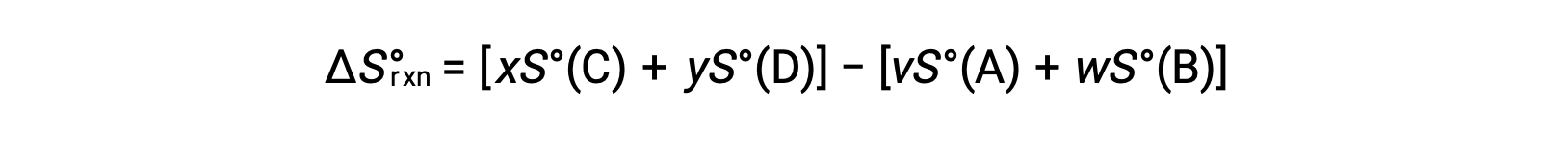
Uma lista parcial de entropias padrão é fornecida na tabela.
| Substância | S° (J/mol·K) |
| C (s, grafite) | 5,740 |
| C (s, diamante) | 2,38 |
| CO (g) | 197,7 |
| CO2 (g) | 213,8 |
| CH4 (g) | 186,3 |
| C2H4 (g) | 219,5 |
| C2H6 (g) | 229,5 |
| CH3OH (l) | 126,8 |
| C2H5OH (l) | 160,7 |
| H2 (g) | 130,57 |
| H (g) | 114,6 |
| H2O (g) | 188,71 |
| H2O (l) | 69,91 |
| HCI (g) | 186,8 |
| H2S (g) | 205,7 |
| O2 (g) | 205,03 |
Determinação da ΔS°
Considere a condensação da água, em que 1 mole de H2O gasosa muda para 1 mole de H2O líquida.
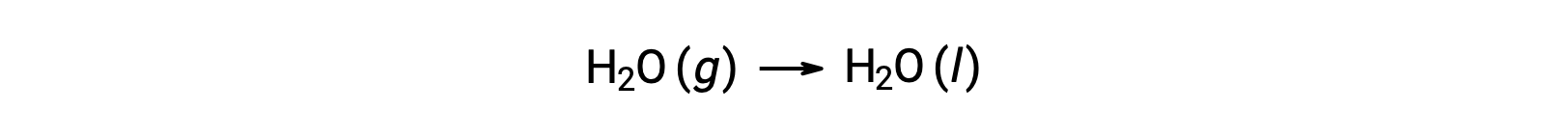
A entropia padrão muda para a reação, ΔS°rxn é calculada utilizando as entropias molares padrão e os coeficientes estequiométricos.
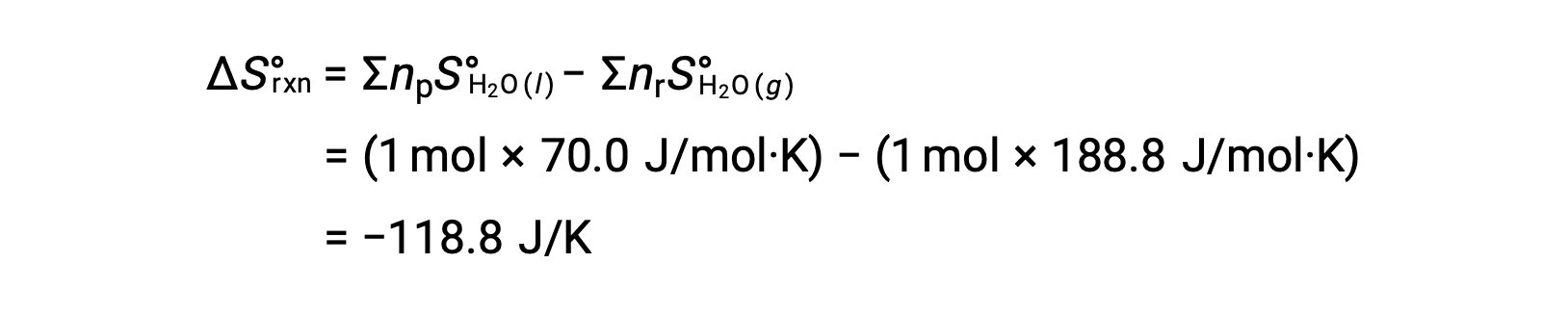
O valor para ΔS°rxn é negativo, como esperado para esta transição de fase (condensação).
Como segundo exemplo, considere a combustão de metanol, CH3OH:
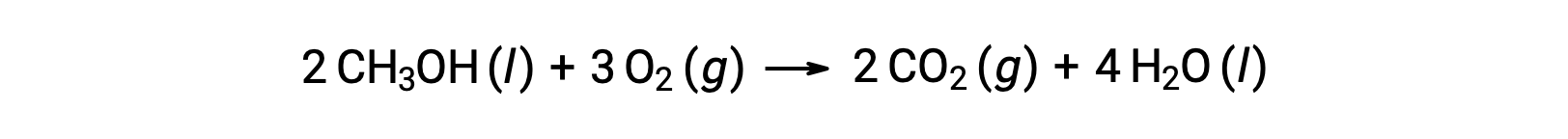
O mesmo procedimento é seguido para calculara alteração da entropia padrão da reação:
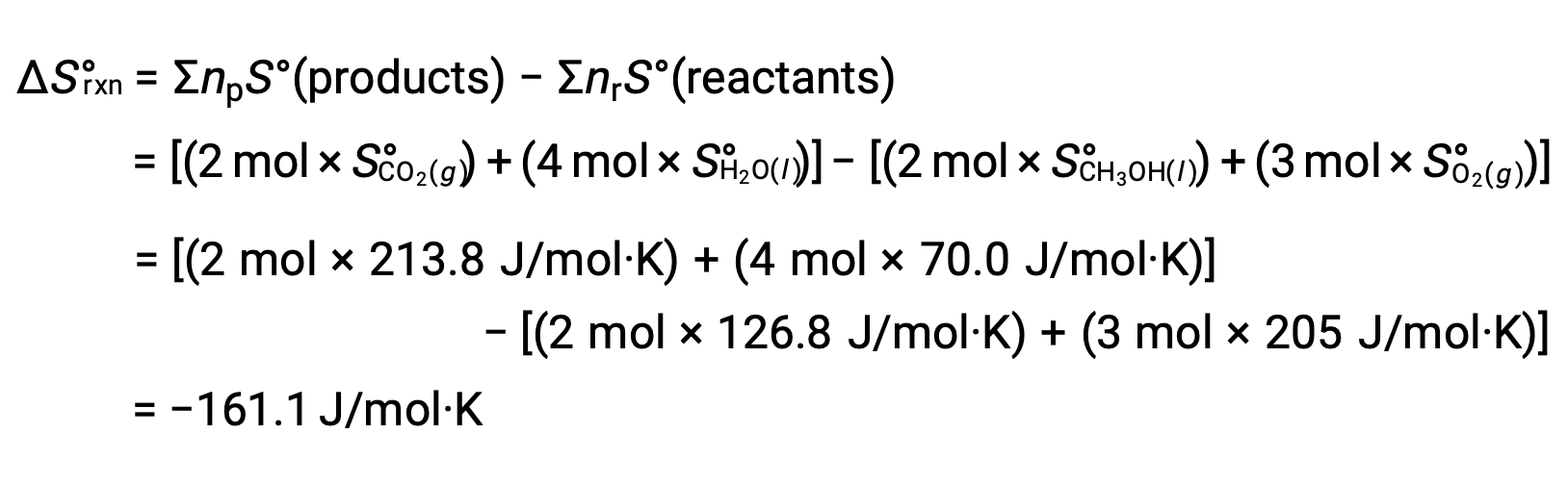
Este texto é adaptado de Openstax, Chemistry 2e, Chapter 16.2: The Second and Third Law of Thermodynamics.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados