Um dos desafios de usar a segunda lei da termodinâmica para determinar se um processo é espontâneo é que requer medições da alteração da entropia para o sistema e a alteração da entropia para as imediações. Uma abordagem alternativa envolvendo uma nova propriedade termodinâmica definida em termos de propriedades do sistema só foi introduzida no final do século XIX pelo matemático Americano Josiah Willard Gibbs. Esta nova propriedade é chamada de energia livre de Gibbs (G) (ou simplesmente a energia livre), e é definida em termos de entalpia e entropia de um sistema como se segue:
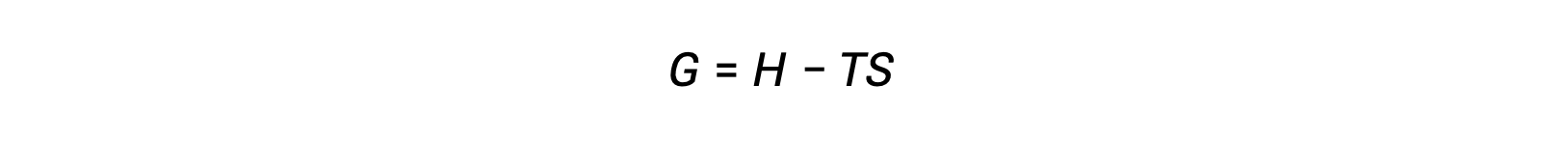
A energia livre é uma função de estado e, a uma temperatura e pressão constantes, a alteração de energia livre (ΔG) pode ser expressa da seguinte forma:
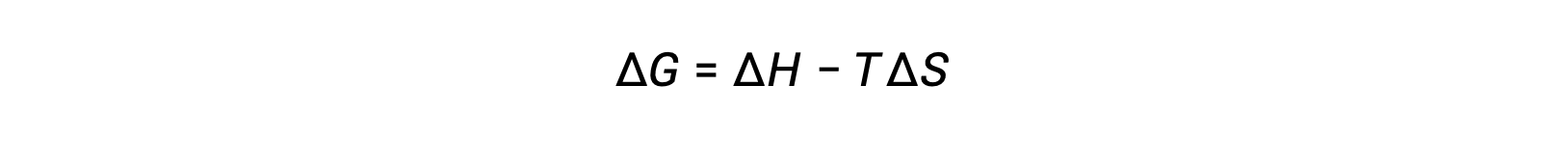
A relação entre esta propriedade do sistema e a espontaneidade de um processo pode ser compreendida recordando a expressão da segunda lei derivada anteriormente:
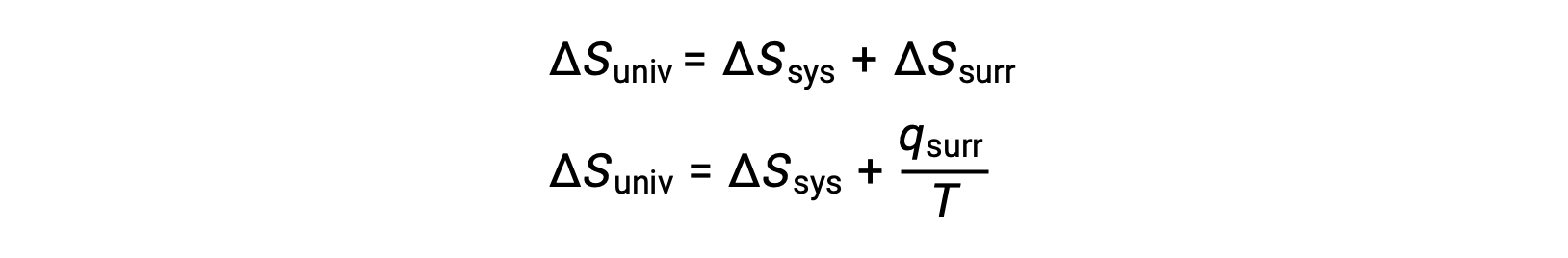
A primeira lei exige qsurr = −qsys, e a pressão constante qsys = ΔH, pelo que esta expressão pode ser reescrita como:
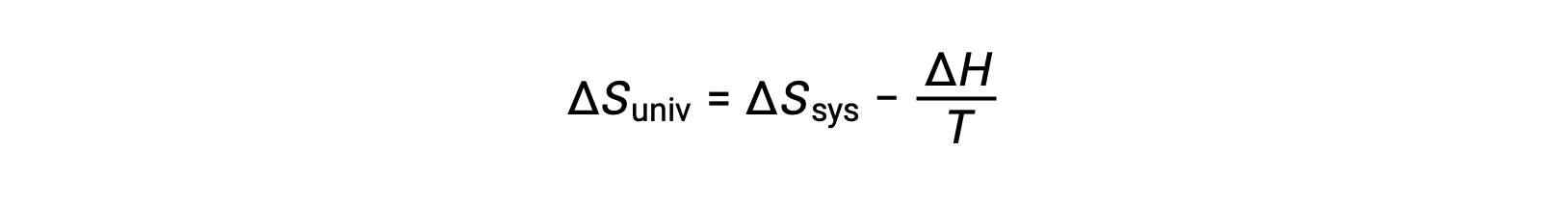
Multiplicando ambos os lados desta equação por −T e reorganizando obtemos o seguinte:
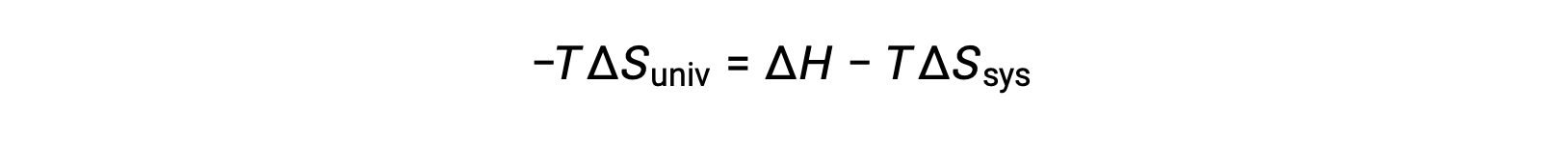
Por questões de simplicidade, o subscrito “sys” pode ser omitido e a expressão torna-se
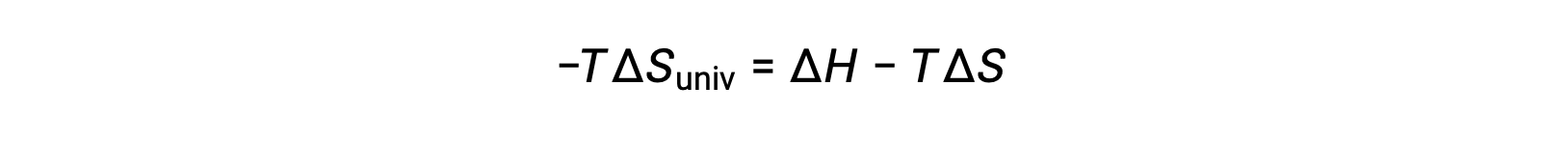
A comparação desta equação com a anterior para a alteração da energia livre mostra a seguinte relação:
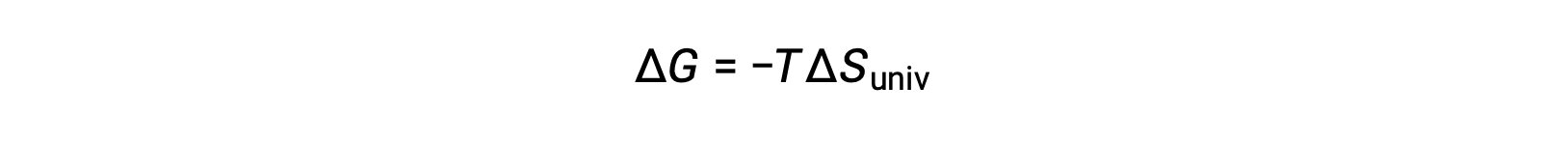
A alteração da energia livre é, portanto, um indicador confiável da espontaneidade de um processo, pois está diretamente relacionada com o indicador de espontaneidade previamente identificado, ΔSuniv.
Se ΔSuniv > 0, ΔG < 0 e a reação é espontânea.
Se ΔSuniv < 0, ΔG > 0 e a reação não é espontânea.
Se ΔSuniv = 0, ΔG = 0 e a reação está em equilíbrio.
Este texto é adaptado de Openstax, Chemistry 2e, Chapter 16.4: Free Energy.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados