A eletroquímica é a ciência envolvida na interconversão de reações elétricas e químicas. Tais reações são chamadas de oxidação-redução, ou reações redox. Estas importantes reações são definidas por mudanças nos estados de oxidação para um ou mais elementos de reagentes e incluem um subconjunto de reações envolvendo a transferência de eletrões entre espécies de reagentes. A eletroquímica como campo evoluiu de forma a fornecer conhecimentos suficientes sobre os princípios fundamentais da química redox e de várias tecnologias, desde processos metalúrgicos à escala industrial até baterias robustas e recarregáveis para veículos elétricos. Como as reações que envolvem a transferência de eletrões são essenciais para o estudo da eletroquímica, uma breve revisão da química redox inclui o seguinte.
Números de Oxidação
Por definição, uma reação redox envolve uma alteração no número de oxidação ou no estado de oxidação de um ou vários reagentes. O número de oxidação de um elemento é uma avaliação de como o ambiente eletrónico dos seus átomos difere em relação aos átomos do elemento puro. Por esta definição, um átomo de um elemento carrega um número de oxidação de zero. Para um átomo, o número de oxidação é igual à carga do átomo no composto se o composto fosse iónico. Assim, a soma dos números de oxidação de todos os átomos em uma molécula é igual à carga da molécula.
Compostos Iónicos
Os compostos iónicos simples são os exemplos mais simples deste formalismo, uma vez que os elementos têm números de oxidação iguais às suas cargas iónicas. O cloreto de sódio, NaCl, é composto por catiões Na+ e aniões Cl−, sendo os números de oxidação para sódio e cloro +1 e −1, respectivamente. O fluoreto de cálcio, CaF2, é composto por catiões Ca2+ e aniões F−, com números de oxidação para cálcio e flúor, +2 e −1.
Compostos Covalentes
Os compostos covalentes são mais desafiantes no uso do formalismo. A água é um composto covalente constituído por dois átomos H ligados a um átomo O através de ligações O−H covalentes polares. Os eletrões partilhados que fazem uma ligação O−H são mais fortemente atraídos pelo átomo O mais eletronegativo. Assim o oxigénio adquire uma carga negativa parcial, em comparação com um átomo de O em oxigénio elementar. Como resultado, os átomos de H em uma molécula de água apresentam carga positiva parcial em comparação com os átomos de hidrogénio em hidrogénio gasoso. A soma das cargas parciais negativas e positivas para cada molécula de água é zero, tornando a molécula de água neutra.
Se a polarização de eletrões partilhados dentro das ligações O−H da água estivesse completa, o resultado seria a transferência completa de eletrões de H para O e a água seria um composto iónico composto por aniões O2− e catiões H+. E assim, os números de oxidação para oxigénio e hidrogénio na água são de −2 and +1, respectivamente. Aplicando esta mesma lógica ao tetracloreto de carbono, CCl4, temos números de oxidação de +4 para carbono e −1 para cloro. No ião nitrato, NO3−, o número de oxidação para o azoto é +5 e para o oxigénio é −2, somando-se para igualar a carga de −1 na molécula:
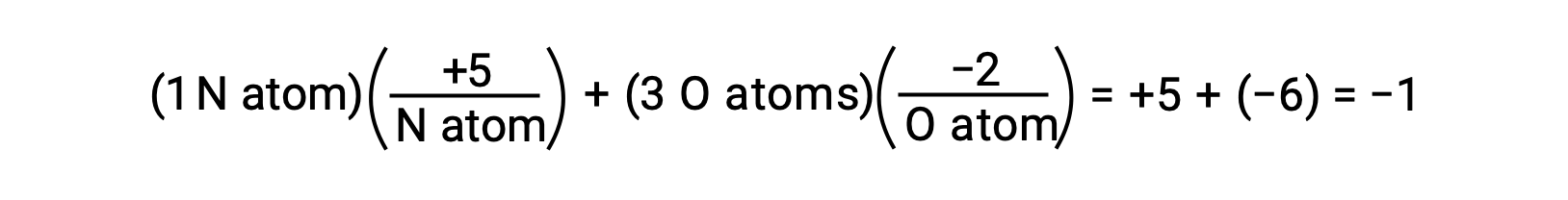
Equilíbrio de Equações Redox
A equação desequilibrada apresentada abaixo descreve a decomposição do cloreto de sódio:
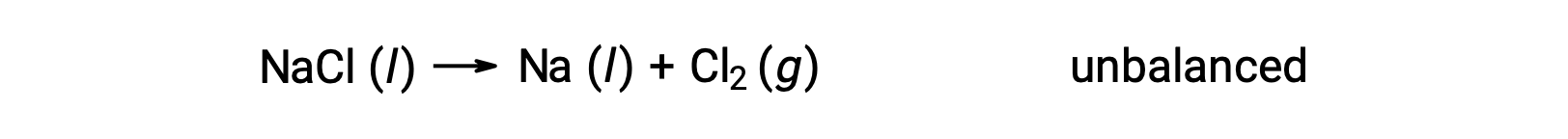
Esta reação corresponde ao critério para uma reação redox, uma vez que o número de oxidação para Na diminui de +1 para 0 (passando por redução) e para Cl aumenta de −1 para 0 (passando por oxidação). O caso da equação é facilmente equilibrado pela adição do coeficiente estequiométrico de 2 para NaCl e Na:
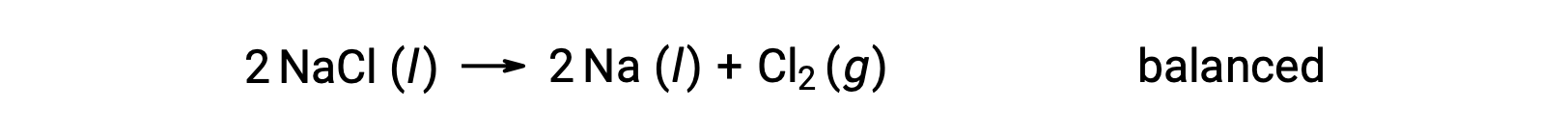
Reações redox que ocorrem em soluções aquosas são comumente encontradas em eletroquímica e muitas envolvem água ou os iões, H+ (aq) e OH− (aq), quer como reagentes ou como produtos.
Nesses casos, equações que representam reações redox podem ser muito desafiantes para equilibrar apenas por inspecção, e o uso de uma abordagem sistemática conhecida como método de semi-reação é útil. Esta abordagem envolve os seguintes passos:
- Dividir a equação nos esqueletos das suas semi-reações de oxidação e redução componentes.
- Equilibrar cada semi-reação para todos os elementos que não O e H.
- Equilibrar cada semi-reação para os átomos de O adicionando moléculas de água na equação conforme necessário.
- Equilibrar cada semi-reação para átomos de H adicionando protões na equação conforme necessário.
- Finalmente, equilibrar as cargas nos elementos adicionando eletrões conforme necessário.
- Multiplicar as semi-reações por qualquer número inteiro necessário para igualar o número de eletrões perdidos na semi-reação de oxidação ao número de eletrões ganhos na semi-reação de redução.
- Adicionar ambas as semi-reações e simplificá-las ainda mais, cancelando espécies comuns em ambos os lados da equação.
- Se a reação ocorrer em meio alcalino, adicionar iões OH− à equação obtida no passo 7 para neutralizar os protões (adicionados em números iguais a ambos os lados da equação) e simplificar.
- Verificar a equação para garantir que as cargas nos átomos estão equilibradas.
Este texto é adaptado de Openstax, Chemistry 2e, Chapter 17: Introduction, e Openstax, Chemistry 2e, Section17.2: Review of Redox Chemistry.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
