Uma célula de concentração é um tipo de célula voltaica construída através da ligação de duas semi-células quase idênticas, ambas baseadas na mesma semi-reacção e utilizando o mesmo elétrodo, diferindo apenas na concentração de uma espécie redox. Por conseguinte, o potencial de uma célula de concentração é determinado apenas pela diferença de concentração da espécie redox específica.
Considere a seguinte célula voltaica:
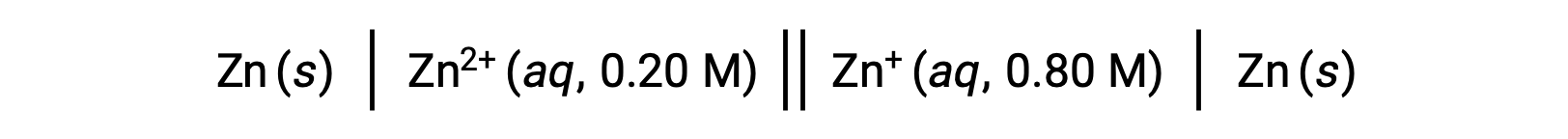
A partir das informações fornecidas, o potencial celular desta célula de concentração pode ser calculado utilizando a equação de Nernst:

Substituindo na equação de Nernst,
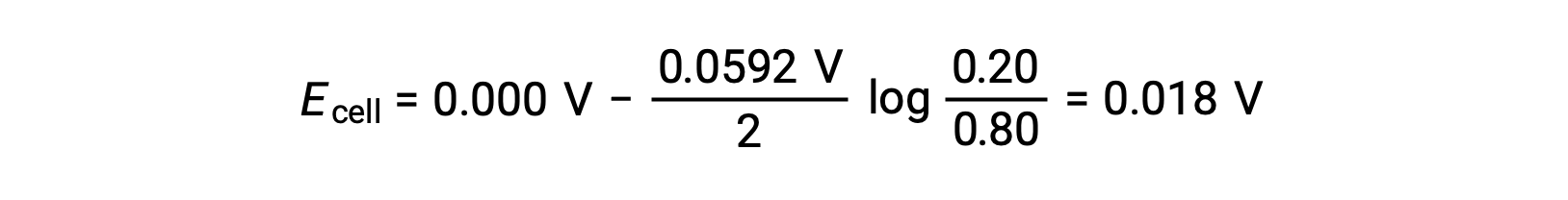
O valor positivo do potencial celular indica que a reação geral da célula é espontânea. Esta reação espontânea ocorre quando a concentração de iões de zinco no cátodo cai (por redução ao zinco elementar) enquanto que no ânodo aumenta (por oxidação do ânodo de zinco aos iões de zinco). Uma maior força motriz para a redução do zinco está presente no cátodo, onde a concentração de iões Zn2+ é maior (Ecátodo > Eânodo).
Medidores de pH no laboratório, canais de iões nas membranas das células nervosas, e células musculares cardíacas no corpo humano trabalham no princípio das células de concentração.
Este texto é adaptado de Openstax,Chemistry 2e,Chapter 17.4: Potential, Free Energy, and Equilibrium.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
