É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Visualizando o Live Drosophila Junção neuromuscular-Glial com corantes fluorescentes
Neste Artigo
Resumo
Descrevemos as características estruturais das sinapses Glia-neuromuscular em um romance de preparação dos tecidos dentro para fora-de larvas de moscas ao vivo usando corantes fluorescentes com microscopia confocal. Nós rotulados terminais de neurônios fluorescentes viver com anticorpos primários para HRP, e também visualizar o espaço perisynaptic com Dextranos fluorescente.
Resumo
Nosso projeto identificou GFP rotulados estruturas glial no desenvolvimento larval sinapse neuromuscular voar. Olhar para o desenvolvimento de viver glial-nervo-músculo sinapses, desenvolvemos uma preparação do tecido larval que tinham características de larvas intactas ao vivo, mas também teve boas propriedades ópticas. Esta nova preparação também permitiu o acesso de perfusato para a sinapse. Usamos larvas de moscas, imersa-los em hemolinfa artificial, e relaxaram seus normais contrações rítmicas do corpo de arrefecimento-los. Em seguida, dissecados fora os segmentos posterior de cada animal e com um alfinete de inseto blunt empurrou a partes da boca para trás através da cavidade do corpo. Este evertido da parede do corpo larval, como transformar uma meia dentro para fora. Concluímos a dissecção com tesoura ultra-fina dissecação e, portanto, expostos ao lado visceral dos músculos da parede do corpo. As estruturas glial no MNJ expressa GFP membrana alvo sob o controle de promotores glial específico. A membrana pós-sináptica, a SSR (Reticula subsináptico) no músculo expressa sinapticamente alvo dsRed. Precisávamos aguda rótulo os terminais do neurônio motor, a terceira parte da sinapse. Para fazer isso, aplicamos anticorpos primários para HRP, conjugado a um flurophore emitindo far-vermelho. Para testar as propriedades de difusão de corante no espaço perisynaptic entre os terminais do neurônio motor e da SSR, aplicou-se uma solução de moléculas grandes Dextran conjugado com muito vermelho flurophore emissora e imagens recolhidas.
Protocolo
Parte 1: Preparação do tecido
- Nosso objetivo é uma preparação de tecidos de larvas de moscas, onde o sistema nervoso está intacta, mas a superfície interior do músculo parede do corpo é exposto a uma hemolinfa artificial, e pode ser posicionada perto de uma lamínula de microscópio de ótica bom. Em outras palavras, uma de dentro para fora preparação larval.
Desde preparações de tecido convencional envolvem corte, prendendo e alongamento do músculo parede do corpo e, por vezes retirando parte do sistema nervoso, precisávamos de uma abordagem diferente.
Queríamos que os animais de dentro para fora, porque queríamos dar uma boa olhada em características estruturais e as mudanças estruturais ao longo do tempo na sinapse, e queríamos manter o sistema nervoso intacto. Nós também queríamos evitar esticar o tecido e ativando os receptores de estiramento, o que tornaria os músculos se contorcer e arruinar as nossas imagens. - Para começar, estágio os animais. Alimentando larvas terceiro e Wandering larvas terceiro são grandes e fáceis de dissecar isso vamos demonstrar na W3 larvas. Este animal é tem o fenótipo Tubby, e é grande, por isso é fácil de Evert.
Nós só usamos larvas que vimos ativamente rastejando, incluindo W3 larvas. - Limpe a superfície de um verme com um pincel muito macio em uma placa de Petri de bidestilada H2O. Larvas limpas têm melhor óptica e limpeza reduz bactérias.
- Transferir o animal para uma pequena placa de Petri de cerca de 3 ml de gelo frio HL-6, e hemolinfa artificial. Coloque o prato sobre o gelo até que o animal pára de se mover, e relaxa (cerca de 5 minutos).
- Segure uma pinça ponta muito fina em uma mão e uma tesoura de primavera no outro. Eu uso a tesoura com a mão dominante. Faça um pequeno buraco na parede do corpo com a tesoura para equlibrate a pressão do outro lado da parede do corpo.
- Mantenha o animal gentilmente com a pinça para baixo no fundo do prato e cortar o posterior dois segmentos. Dissecar fora as vísceras e gordura corporal provavelmente vai sair da cavidade do corpo. Cortar esse tecido também.
- Segure as larvas contra o fundo prato com uma pinça fina. Segure um alfinete # 0 inseto em (com uma ponta romba) e empurrá-lo contra a partes da boca das larvas. Empurre a partes da boca através da cavidade do corpo como se estivesse virando uma meia do avesso.
- Dentro para fora do tecido será semelhante a figura: abaixo. Com ultra-fina ferramenta de dissecação, dissecar afastado a gordura corporal e trachioles da parede do corpo. Tente REALMENTE difícil não puxar o trachioles, ou desligar o sistema nervoso. Rasgando o trachioles vai rasgar buracos na parede muscular do corpo.
Remover o corpo tanto quanto a gordura como você pode. Ambas as estruturas perturbar a qualidade óptica do seu tecido. Você pode querer pular o café antes de fazer essa preparação. - Quando você terminar o músculo irá ser translúcido, não opaca ou branco. Se você colocar o tecido em prep HL-6 sem glutamato, à temperatura ambiente, ele provavelmente vai contrair ritmicamente, porque os geradores de padrão motor no SNC estão funcionando.
Evitar o uso de preps com o músculo contraído obviamente, ou irregularmente contratados corpo parede.
O interior intacto parede do corpo para fora prontamente tende a dobrar ao meio ao longo da linha média dorsal e ventral, de modo a preparação dá uma para a esquerda ou direita "hemi-animal" para visualizar. - 1,9 Monte do tecido em qualquer câmara de um pequeno volume comercial, tais como a câmara Warner, ou uma lâmina de microscópio com um arranjo de ponte tampa de deslizamento. Ver a parte 3 para sugestões sobre o tecido de montagem.
Parte 2: Rotulagem Bouton Neuronal fluorescente etiquetado com anticorpo primário contra a HRP.
- Colocar 50 litros de micro fluorescente etiquetado primário anti-corpo contra a HRP em HL-6 em uma queda em uma placa de Petri. Mergulhe dentro para fora prep parede do corpo no banho de corante. Você pode ver neurônio rotulagem terminal após cerca de 5 minutos, mas incubar por 10-20 minutos, por uma etiqueta completa e brilhante.
- Enxaguar o corante por 10-30 segundos na HL-6 em temperatura ambiente. Não-vinculados corante lavagens rapidamente, de modo que o ciclo de lavagem não precisa ser agressivo.
- Variar a concentração de corante e tempo de incubação, conforme necessário.
Parte 3: Rotulagem espaço Perisynaptic com dextran flurophore conjugado
- Diluir fluorescente conjugados dextran corante diluído em HL-6. Uma concentração que funcionou bem para os nossos propósitos foi:
- Se você não está preocupado com o tempo de acesso ao corante em seu espaço extracelular, coloque uma gota 20 micro litro de corante em uma lamela "ponte" (ver parte 4) e depositar a preparação do banho de tintura.
Parte 4: Montagem do tecido para visualização (com microscopia confocal).
Se você não precisa perfundir sua preparação (observações curtas) ou você quer manter o volume de banho HL-6 pequenos, use o método de lâmina dupla em ponte
Se você quiser perfundir sua preparação, tente usar uma câmara de perfusão. Usamos um moCâmara dified de Instrumentos Warner.
Detalhes para os dois seguintes.
Montagem de preparação em um slide duplo ponte.
- Use uma lâmina de microscópio muito limpo. Supercola dois quadrados, 18mm (# 1.5) lamínulas para o slide. Deixe um intervalo de 2 mm entre as bordas das lamínulas.
- Deixe a cola secar completamente, ou ele vai formar uma película estranha sobre o meio aquoso em torno de sua preparação.
- Posição dentro para fora larvas entre as bordas das lamínulas. Você pode precisar a posição da preparação em uma diagonal, se as larvas é grande e seu sistema de aquisição de imagem tem uma matriz de pixels limitada.
- Cubra o tecido com uma lamela # 1.5, 18mm (muito limpo). Aderem a lamela "top" no slide afixada desliza tecido de acompanhamento, com vaselina mínimo.
- Coloque uma gota de óleo Cargill objetivo personalizado com um índice de refração de 1,3379 (se você usa HL-6) sobre a lamela superior e virar esta assembléia acabou.
- Posicione o conjunto de tecidos ao seu lado petróleo microscópio, em direção ao objetivo, e focar seu objetivo.
Montagem do tecido em uma câmara de perfusão modificado. - Cola lamínula de 1,5 para formar um piso nos 20 RC câmara. Posicione o tecido na câmara como por RC-20 instruções. Use um pedaço de malha NYTEX em vez de uma lamela para formar um teto para a câmara.
Parte 5: Resultados Representante:
- De dentro para fora do tecido seqüência dissecção preparação:
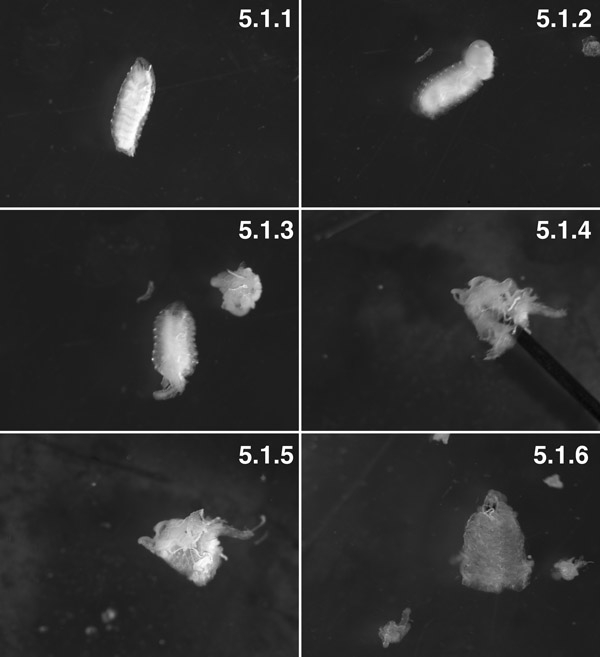
W3 larvas, lavados (fenótipo "Tubby") (5.1.1). W3 larvas, posterior 2 segmentos dissecados. Você pode ver de gordura corporal empurrado para fora da cavidade do corpo pelo corpo trans-tensão de parede (seta). Tentar minimizar "erupção" visceral, fazendo um pequeno buraco na parede do corpo um minuto antes da dissecação (5.1.2). A preparação com as vísceras, dissecados antes de virar a preparação de dentro para fora (5.1.3). A preparação, a maioria evertido, com o pino (seta) no interior do lúmen do prep (5.1.4). O músculo está agora do lado de fora ea cutícula é no interior, com alguns de gordura corporal e trachioles anexado (5.1.5). A preparação dos tecidos dissecados totalmente com quase todo o corpo de gordura e trachioles dissecados (5.1.6).
- Viver rotulagem usando anti-HRP no MNJ larval. Um representante W3 sinapse nervo-músculo larval com uma extensão de glial (de dentro para fora prep). O motor terminais neurônio bouton são rotulados com um primário anti-corpo contra a HRP (magenta), que é conjugado com Cy5. Os processos gliais são rotulados com GFP (verde).
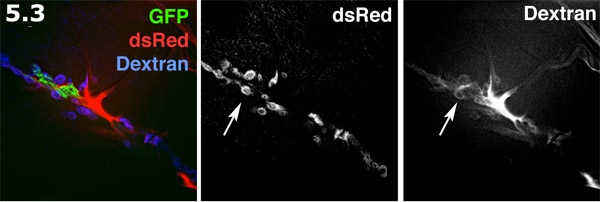
- Espaço Perisynaptic fluorescente visualizado com Alexa 680 dextran em uma de dentro para fora prep. O processo glial (verde) é rotulado com GFP membrana alvo. O SSR pós-sinápticos na superfície muscular (azul) é rotulado com dsRed. O Alexa dextran (vermelho) formas concentra em áreas extracelular. O corante dextran formas piscinas em forma de anel nos espaços perisynaptic. A rotulagem dextran e dsRed SSR marcados são mostrados em escala de cinza. Observe a várias piscinas donut em forma de corante destacando os espaços perisynaptic (seta).
Access restricted. Please log in or start a trial to view this content.
Discussão
Este procedimento permite a longo prazo de imagens ao vivo de proteínas etiquetadas e processos celulares. O tecido em prep situ descrevemos tem um SNC intacto e em funcionamento, PNS e circuitos reflexos. Esta preparação do tecido tem vantagens sobre protocolos padrão voar larval muscular, onde o músculo da parede do corpo larval é esticada (quando ele é preso para fora). Alongamento pode distorcer a morfologia sináptica e desencadear reflexo contrações based. Nossa preparação foi dentro p...
Access restricted. Please log in or start a trial to view this content.
Agradecimentos
Este projeto foi financiado pelo CIHR e NSERC. Gostaríamos de agradecer Jusiak Barb para contribuir para a criação das cepas voar expressar dsRed SSR marcados (linha BJ), eo UBC Facility Bio-imagem.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments | |
| HL-6: Artifical Drosophila hemolymph, with 5 mM L-glutamate added, and 2 mM Calcium. | Reagent | N/A | NA | 5 mM L-glutamate blocked muscle contractions. We used Molecular grade L-Glutamate (Sigma).2 mM Calcium is close to physiological Calcium levels in natural larval hemolymph.References: Macleod et al 2002 and Macleod 2004 |
| Dextran, Alex Fluor 680; 10,000 MW, anionic, fixable | Reagent | Molecular Probes, Life Technologies | D34680 | Use a small volume perfusion chamber to keep the total volume of dye low |
| Anti-HRP-CY5 conjugate (goat) | Reagent | Jackson ImmunoResearch | 123-175-021 | Dilute 2.0 mg into 1 ml ddH2O; aliquot into 4 microliter aliquots. Freeze at –20C. Dilute one aliquot into 100 microliters of HL-6 |
| Alexa 647 antibody labeling kit | Reagent | Molecular Probes, Life Technologies | A10475 | We prepared a total of 80 micro liters of conjugated primary antibody, and stored as 2 microliter aliquots. We diluted each aliquot into 100 microliter of HL-6 for labeling. |
| Custom Formulated Objective Oil, refractive index 1.3379 | Reagent | Cargill Labs | Custom Formulated | |
| Ultra Fine Forceps | Tool | Fine Science Tools | 11252-23 or 11295-20 | |
| Spring scissors | Tool | Fine Science Tools | 91500-09 | |
| Ultra fine clipper scissors | Tool | Fine Science Tools | 15200-00 | |
| Perfusion Chamber RC 20 Series | Tool | Warner Instruments | 64-02222 | |
| Spinning Disc confocal | Microscope | Quorum Technologies | Quorum Wave FX | Mounted on a Leica DMI6000 Inverted Microscope |
Referências
- Macleod, G. T., Marin, L., Charlton, M., Atwood, H. L. Synaptic Vesicles: Test for a role in presynaptic Calcium regulation. J. Neurosci. 24, 2496-2505 (2004).
- Macleod, G. T., Hegstro, M., Wojtowicz, M., Charlton, M. P., Atwood, H. L. Fast Calcium signals in Drosophila motor neuron terminals. J. Neurophysiology. 88, 2659-2663 (2002).
- Morales, M., Ferrus, A., Martinez-Padron, M. Presynaptic calcium-channel currents in normal and csp mutant Drosophila peptidergic terminals. Eur J Neurosci. 11, 1818-1826 (1999).
- Stork, T., Engelen, D., Krudewig, A., Silies, M., Bainton, R. J., Kla¨mbt, C. Organization and Function of the Blood–Brain Barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados