É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Dissecando o cérebro do primata não-humano no espaço estereotáxico
Neste Artigo
Resumo
O primata não-humano é uma importante espécie de translação para a nossa compreensão do processamento normal do cérebro. A organização anatômica do cérebro dos primatas podem fornecer importantes insights sobre condições normais e patológicas nos seres humanos.
Resumo
O uso de primatas não-humanos fornece um excelente modelo de translação para a nossa compreensão dos processos de desenvolvimento e envelhecimento em seres humanos
Protocolo
Parte 1: Pré-processamento de tecido
- Tecido deve ser bem perfundidos com paraformaldeído, glutaraldeído ou formalina. Isto pode ser conseguido através de perfusão transcardial padrão normalmente utilizado para a colheita de outros órgãos. No presente estudo o assunto estava profundamente sedado com cloridrato de cetamina (10 mg / kg, im), sacrificados com uma overdose de pentobarbital sódico (25 mg / kg, iv) e perfundidos transcardially com 0,1 M PBS até que esteja completamente exsanguinated.This é seguido por uma solução de paraformaldeído 4% em PBS por 5 min (~ 1 litro).
Parte 2: estereotáxica bloqueio
- Antes de colocar a cabeça na moldura estereotáxica as coordenadas do zero avião Horsley-Clarke/interaural precisa ser tomada. Este é o ponto médio teórico entre as orelhas. Para medir este plano, as barras de ouvido precisa ser igualmente montado no aparelho, em seguida, coloque uma lâmina de bisturi no braço manipulador estereotáxica e medir o ponto médio entre as barras de ouvido. Isso é importante para determinar onde a bloquear o tecido com base nas necessidades de pesquisa. Quando isso for concluído o crânio deve ser preparado para fixação no aparelho estereotáxico.
- A fim de colocar a cabeça na moldura estereotáxica o maxilar inferior terá que ser removida com fórceps osso e um bisturi. Além disso, a pele, músculo e tecido conjuntivo devem ser removidos, a fim de expor o crânio. Uma vez que o tecido conjuntivo é removido do crânio, expor o cérebro por desbastando a calvária (a parte de tabela do osso occipital, bem como o parietal, ossos ad frontal). Na parte do presente experimento calvária tem tudo pronto foram removidas. Tenha cuidado para não remover completamente os ossos temporais, pois o canal auditivo terá de estar intacto para colocar a cabeça na moldura estereotáxica. A matéria dura restante deve ser removido do cérebro exposto. O crânio está agora pronto para ser colocado na armação estereotáxica.
- Da mesma forma em que se iria realizar uma cirurgia estereotáxica, ajustar o olho, boca, ouvidos e bares de tal forma que a cabeça está bem fixo no aparelho estereotáxico. Coloque o manipulador estereotáxica nas coordenadas predeterminado anterior / posterior (A / P) e mover o manipulador para o aspecto lateral do cérebro. Lentamente abaixe a lâmina para o cérebro, completamente levantar a lâmina do cérebro, então se movem medialmente e inferior a lâmina novamente. Repita essas duas etapas até que a lâmina atingiu o aspecto lateral do hemisfério oposto. Isto completa o primeiro bloco coronal. Para posterior blocos coronal mover o manipulador de um centímetro na A / eixo P e repetir até que todo o cérebro foi bloqueada.
Parte 3: Remover o cérebro do crânio
- Remova a cabeça da armação estereotáxica e mantenha o cérebro exposto na palma da sua mão. Tentar garantir o cérebro levemente colocando coddling o cérebro na palma da sua mão e coloque o dedo mindinho entre os lobos frontais, esse movimento minimiza do cérebro no crânio. A fim de evitar o ressecamento da superfície pial do cérebro, coloque um pedaço de gaze umedecida PBS em todo o cérebro. Segure a cabeça com firmeza pelo crânio e desbastar os ossos restantes occipital e temporal, juntamente com a coluna vertebral. Isso expõe os aspectos básicos e lateral do cérebro. Por fim remover qualquer osso frontal restantes eo osso nasal, o que permitirá o acesso ao bulbos olfatórios. É importante remover o osso frontal último porque como você remover a base do crânio o cérebro se move ligeiramente e os lobos frontais podem ser danificados nas bordas irregulares do osso fontal. Cortar e remover restantes dura-máter. Levante cuidadosamente a parte frontal do cérebro, deslize o bisturi sob o cérebro eo cérebro livre do crânio.
Parte 4: Medições
- Há uma série de medidas úteis que podem ser feitas antes do congelamento. Por exemplo, o A / P eixo do cérebro com um paquímetro. Além disso, a densidade específica pode ser medida pelo peso do cérebro, de medição do volume pelo deslocamento de água em um cilindro graduado, em seguida, dividindo o peso pelo deslocamento de volume (Tabela 1).
Parte 5: Concluir o bloqueio do cérebro.
- Normalmente, quando a lâmina de bisturi é introduzido no cérebro, não é tempo suficiente para atravessar completamente a extensão dorsal-ventral completa do cérebro. Uma vez que o cérebro é removido e medições brutas são obtidas, leve um lenço de papel-slicing blade e terminar o bloqueio do cérebro até o lado ventral do cérebro (Figura 2).
- Antes de congelar os blocos, é necessário cryoprotect o tecido em soluções classificados PBS-buffered sacarose (10, 20 e 30%) mantida a 4 ˚ C até os dissipadores cérebro. Ele normalmente leva uma incubação overnight em 10%, 2-3 dias em 20% e adicional de 3-5 dias em 30% para os blocos para desviar para o fundo do recipiente. A mudança diária de the solução de sacarose 30% é recomendado.
Parte 6: Resultados Representante
Há uma série de graves medições morfológicas que podem ser feitas uma vez que o cérebro foi removido do crânio. Estes incluem um comprimento / P, o peso ea densidade específica (Tabela 1). Nós geralmente bloqueiam o cérebro em 6-7 blocos medindo 1cm (Figura 1). Cada peça é então fotografada (Figura 2) e pode ser ainda mais dissecados, dependendo das necessidades de pesquisa ou preparados para o congelamento em soluções de sacarose classificados.
Assunto | A Comprimento / P (Mm) | Peso (Gramas) | Deslocamento de água (Ml) | Densidade específica (G / ml) |
| O2303-2-1-1 | 64,3 | 28,1 | 24 | 1,171 |
| O5180-1 | 71,3 | 38,7 | 34 | 1,138 |
| O2708-3-1 | 62,8 | 28,7 | 26 | 1,104 |
| O9184-4-2 | 65,3 | 29,5 | 24 | 1,229 |
| N459-1-14-2 | 68,2 | 31,6 | 26 | 1,215 |
| MÉDIA | 66,38 | 31,32 | 26,8 | 1,171 |
| STD DEV | 3,38 | 4,33 | 4,17 | 0,052 |
Tabela 1. Gross Medidas morfológicas do hemisfério direito de 5 Mês vervet Velho
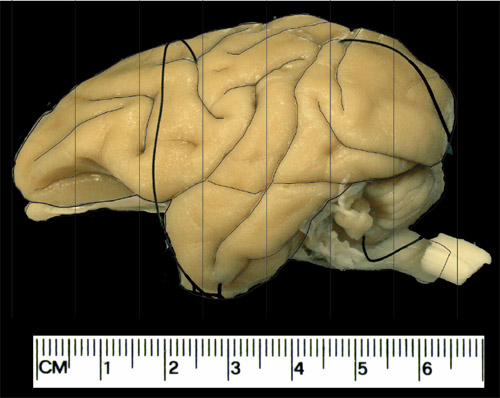
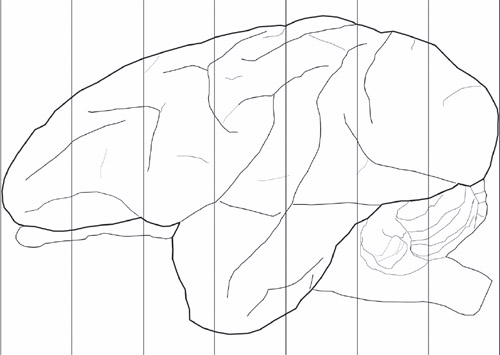
Figura 1. Esquemas para os planos coronal usado para bloquear o cérebro. Este é um exemplo de um cérebro adulto vervet externalizados. Exemplo do procedimento de bloqueio. As linhas verticais aqui são espaçados em 1cm, geralmente produzindo 7 blocos coronal de cada hemisfério.
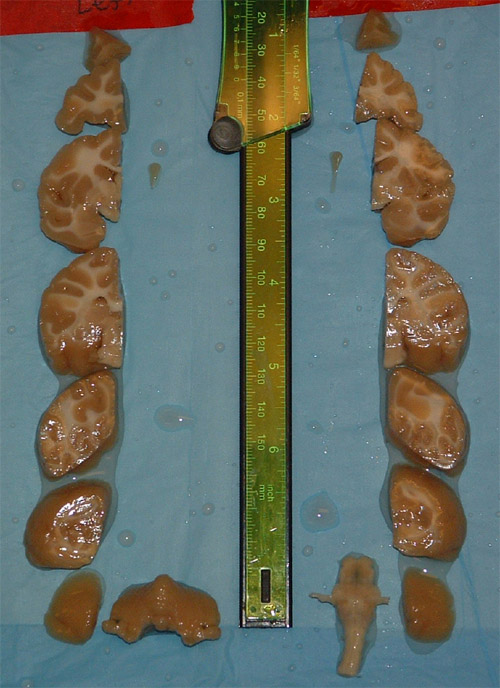
Figura 2. Blocos de tecido cerebral no espaço estereotáxico. Cada bloco vai render cerca de 200 seções tomada em 50 ìm. Com este esquema de amostragem mais de 1200 pontos através do córtex serão tomadas e um 400-500 adicional do cerebelo quando cortado no plano coronal.
Access restricted. Please log in or start a trial to view this content.
Discussão
O St. Kitts vervet (Chlorocebus aethiops sabeus) é um primata do Velho Mundo com padrões semelhantes e taxas de desenvolvimento do cérebro corticais e subcorticais ao dos humanos. Esta espécie tem sido utilizada para modelar humano complexo distúrbios comportamentais como comportamento ansioso, hipertensão 8, 9 hemisferectomia, doença de Parkinson 10, doença Alzhemier de 11, e abuso de álcool 12. Mais recentemente, esta espécie tem sido usado para estudar os...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors have nothing to disclose.
Agradecimentos
Os autores gostariam de agradecer Ikiel Ptito por seu contínuo apoio técnico. NSERC conceder ao MP.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Scalpel | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10011-00 | |
| Scissors | Fine Science Tools | 14090-11 | Any surgical scissors are sufficient |
| Rongeurs | Fine Science Tools | 16121-14 | |
| Forceps | Fine Science Tools | 11027-12 | |
| Filter paper | Fisher Scientific | 09-924-150 | |
| Stereotaxic Frame | Kopf Instruments | ||
| Tissue slicing blade | Thomas Scientific |
Referências
- Gallagher, M., Rapp, P. R. The use of animal models to study the effects of aging on cognition. Annu Rev Psychol 48. , 339-370 (1997).
- Clancy, B., Darlington, R., Finlay, B. Translating developmental time across mammalian species. Neuroscience. 105, 7-17 (2001).
- Nowakowski, R. S., Rakic, P. The site of origin and route and rate of migration of neurons to the hippocampal region of the rhesus monkey. J Comp Neurol. 196, 129-154 (1981).
- Rakic, P., Bourgeois, J. P., Eckenhoff, M. F., Zecevic, N., Goldman-Rakic, P. S. Concurrent overproduction of synapses in diverse regions of the primate cerebral cortex. Science. 232, 232-235 (1986).
- Granger, B., Tekaia, F., Le Sourd, A. M., Rakic, P., Bourgeois, J. P. Tempo of neurogenesis and synaptogenesis in the primate cingulate mesocortex: comparison with the neocortex. J Comp Neurol. 360, 363-376 (1995).
- Zecevic, N., Rakic, P. Development of layer I neurons in the primate cerebral cortex. J Neurosci. 21, 5607-5619 (2001).
- Ervin, F. R., Palmour, R. M., Young, S. N., Guzman-Flores, C., Juarez, J. Voluntary consumption of beverage alcohol by vervet monkeys: population screening, descriptive behavior and biochemical measures. Pharmacol Biochem Behav. 36, 367-373 (1990).
- Palmour, R. M., Mulligan, J., Howbert, J. J., Ervin, F. Of monkeys and men: vervets and the genetics of human-like behaviors. Am J Hum Genet. 61, 481-488 (1997).
- Boire, D., Théoret, H., Ptito, M. Stereological evaluation of neurons and glia in the monkey dorsal lateral geniculate nucleus following an early cerebral hemispherectomy. Exp Brain Res. 142, 208-220 (2002).
- Bjugstad, K. B., Teng, Y. D., Redmond, D. E. J. r, Elsworth, J. D., Roth, R. H., Cornelius, S. K., Snyder, E. Y., Sladek, J. R. Jr Human neural stem cells migrate along the nigrostriatal pathway in a primate model of Parkinson's disease. Exp Neurol. 211, 362-369 (2008).
- Lemere, C. A., Beierschmitt, A., Iglesias, M., Spooner, E. T., Bloom, J. K., Leverone, J. F., Zheng, J. B., Seabrook, T. J., Louard, D., Li, D., Selkoe, D. J., Palmour, R. M., Ervin, F. R. Alzheimer's disease abeta vaccine reduces central nervous system abeta levels in a non-human primate, the Caribbean vervet. Am J Pathol. 165, 283-297 (2004).
- Mash, D. C., Staley, J. K., Doepel, F. M., Young, S. N., Ervin, F. R., Palmour, R. M. Altered dopamine transporter densities in alcohol-preferring vervet monkeys. Neuroreport. 7, 457-462 (1996).
- Burke, M. W., Palmour, R. M., Ervin, F. R., Ptito, M. Neuronal reduction in frontal cortex of primates after prenatal alcohol exposure. Neuroreport. 20, 13-17 (2009).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados