É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação das Culturas cérebro de um rato Aggregate para Neuron Glia e Estudos de Desenvolvimento
Resumo
A protocolos para um sistema cerebral de ratos embrionários cultura agregada é descrita. Progenitores multipotentes nos agregados podem se desenvolver e se diferenciar em neurônios, astrócitos e oligodendrócitos.
Resumo
Um sistema in vitro que recapitula o desenvolvimento e diferenciação de progenitores em neurônios maduros e células gliais no sistema nervoso central (SNC) proporcionaria uma plataforma poderosa para os neurocientistas para investigar axo-glial interações, propriedades e diferenciação de células progenitoras multipotentes, ea progressão da oligodendroglial células da linhagem no nível celular e molecular. Descrevemos aqui um sistema de cultura CNS agregado de prosencéfalo embrionárias de ratos, que podem ser mantidos em um meio isento de soro até 3-4 semanas e é usado em nosso laboratório como modelo para estudar a interação neurônio glia e mielinização do SNC. Este vídeo vai demonstrar como isolar e cultivar essas culturas CNS agregado de E16 cérebro de rato. Além disso, a partir da dissecção mesmo cérebro, altamente enriquecido regulares dissociada culturas neuronais podem ser facilmente obtidos e utilizados para vários estudos sobre os neurônios do SNC ou utilizados para co-culturas com outras células.
Protocolo
Preparação antes da dissecação
Instrumentos cirúrgicos: esterilizar todas as tesouras e pinças de dissecção por autoclave
Lamela de limpeza:
- Mergulhe todos lamínulas (15mm de diâmetro por 24 bem-placa) em 1L copo de grama em 33% HCl durante pelo menos 24 h
- Lavar com água corrente durante 10 min com agitação ocasional para remover todos os HCl residual
- Enxágüe com água Millipore
- Drenar a água fora
- Mergulhe lamínulas em etanol 95-98%
- Lamínulas transferência para um tecido limpo em uma placa plana e ar seco as lamelas
- Transferência de lamínulas para um copo de vidro, cubra com papel alumínio e autoclave
Nota: Lamelas podem ser armazenados nesta fase - Lugar lamela individual em placas de cultura. Pronto para revestimento
Lamela revestimento:
- Diluir 100 x estoque de poli-D-lisina (PDL, 10 mg / ml em 0,5% de soro albumina bovina em PBS, armazenado como alíquotas a -20 ° C) com PBS e filtro-esterilize (0,22 mm)
- Lamínulas revestimento com uma solução PDL x (~ 0,15 ml / cm 2) por 2 horas a 37 ° C em uma incubadora
- Remoção da solução PDL e lavar 3 vezes com estéril DDH 2 O e lamínulas secar completamente
Nota: Brasão suficiente lamínulas / placas para cada dissecção. PDL revestido lamelas podem ser armazenadas por algumas semanas a 4 ° C.
Mídia e soluções
Dissecção médio (DM): Use soro fisiológico gelado de Hank salina balanceada (w / o Ca 2 +, Mg 2 +) (HBSS, Invitrogen 14175) suplementado com 10 mM HEPES (Invitrogen 15.630).
Agregada meios de cultura: O meio DMEM/NBB27 contém DMEM / Neurobasal (1:1 vol: vol), 2% B27, 1 x Sato, 0,5 mM piruvato de sódio, 0,75 mm Glutamax, 60μg/ml N-acetilcisteína, 5 mg / ml insulina, 10nM d-Biotina e 1% de penicilina / estreptomicina. Para fazer 100 ml do meio de cultura agregada, misture 50 ml DMEM (w / o piruvato / glutamina, Invitrogen 11.960), 50 ml de meio de Neurobasal (Invitrogen 211.034), 375 Glutamax mL (100 x, Invitrogen 35.050), 5,5 mg de sódio piruvato (Sigma P2256), 2 ml B27 (17504 Invitrogen), 6,3 mg N-acetilcisteína (Sigma A8199), 1 ml de Sato ações (stock x 100, veja abaixo), 25 mL de d-Biotina estoque (4000 x estoque, 40 M em PBS armazenados como alíquotas a -20 ° C. Sigma B4639), 100 ml de insulina (1000 x estoque, 5 mg / ml em HCl 0.01N armazenados como alíquotas a -20 ° C, Sigma 16.634), e 1 ml de penicilina / estreptomicina (100 x estoque, Invitrogen 15140), filtro de esterilizar e armazenar a 4 ° C.
Sato 100 x solução estoque: Para fazer 40 ml do estoque: misturar 40 ml Neurobasal com 400 mg apo-transferrina (Sigma T2252), 400 mg BSA (Sigma A9647), 10 ml de progesterona (25 mg de etanol / ml, armazenado como alíquotas a -20 ° C. Sigma P8783), 64 mg putrescina (Sigma P7505), e 40 mL de selenito de sódio (30 mM em PBS, armazenado como alíquotas a -20 ° C, Sigma S5261). Filtro de esterilizar a solução estoque Sato, e armazenar como alíquotas a -20 ° C.
Neurônio médio chapeamento (PM): Médio Neurobasal, 2% B27, 2mM de glutamina (stock 100x, alíquotas armazenadas a -20 ° C, Invitrogen 25030), 25μM de ácido glutâmico (100 ações, alíquotas armazenadas a -20 ° C) e 1% penicilina estreptomicina /.
Neurônio meio de cultura (CM): Médio Neurobasal, 2% B27, 2mM de glutamina (stock 100x, alíquotas armazenadas a -20 ° C) e 1% de penicilina / estreptomicina.
5 FDU estoque: estoque 100x, 1mM 5-fluoro-2'-deoxiuridina (Sigma F0503) and1mM uridina (Sigma U3003) em meio Neurobasal. Esterilizado por filtração e armazenado como alíquotas a -20 ° C.
Papaína solução digestão (fazer logo antes do dissecção):
- Dissolver 3,2 mg L-Cisteína (Sigma C-7352) em 4ml DM
- Ajustar o pH a cerca de 7,4 com NaOH 1N (teste em tiras de teste pH) e coloque em banho-maria a 37 ° C
Nota: Execute o próximo passo direito, antes da digestão dos tecidos (veja abaixo). - Adicionar papaína para uma concentração final de 20 unidades / ml
- Filtro de esterilizar (0,22 milímetros), e colocar em banho-maria a 37 ° C
Tripsina solução inibidora (fazer logo antes do dissecção):
- Dissolver 0,2 g inibidor de tripsina (Sigma T7295) no DM 20ml
- Verificar o pH e ajustar o pH a 7,4 com 1 ~ N NaOH
- Filtro de esterilizar e colocar em banho-maria a 37 ° C
Dissecação cérebro
Configuração:
- Pinça esterilizada e tesoura
- Etanol 70%
- Lenço de papel limpo e DIAPer almofada no banco
- Placas de Petri com 10 centímetros gelada DM para o útero eo feto no banco
- Plataforma de gelo em microscópio de dissecção
- 2-3 pratos seis centímetros com DM no gelo
- PM quente no banho-maria a 37 ° C
- Euthanize uma grávida de ratos Sprague-Dawley (E16) de acordo com o procedimento aprovado pelo Institutional Animal Care and Us Committee (IACUC)
- Coloque o rato sobre o bloco de fralda e álcool spay na região abdominal
- Use uma pinça para segurar a pele abdominal e um par de tesouras para fazer uma incisão forma de V cortando apenas a pele
- Afastados da pele e usar um outro pinças esterilizadas e tesouras para cortar a camada muscular
- Extrato da cadeia dos sacos embrião e transferi-los para um prato contendo 10 centímetros gelada DM
- Usando uma tesoura de microdissecção, remova cuidadosamente cada embrião a partir do saco eo cérebro de cada embrião, e colocar o cérebro livre em um prato limpo, com 10 centímetros DM em uma plataforma de gelo
- Em uma capa Laminar e sob um microscópio de dissecção, remova mesencéfalo / rombencéfalo seções, e utilize uma pinça fina para remover meninges, e transferir os córtices limpos / hipocampo para um novo prato com seis centímetros DM em um bloco de gelo
Nota: nesta fase, o tecido está pronto para a digestão enzimática. - Faça papaína e tripsina solução inibidora e filtro de esterilizar
- Remover o excesso de córtices DM / hipocampos
- Adicionar 4ml da solução preparada papaína digestão
- Transferência de todo o conteúdo para um tubo de 50ml e colocar o tubo Falcon em banho-maria a 37 ° C por exatamente 5 minutos
- Remoção da solução de papaína com pipeta
- Adicionar solução inibidora de tripsina 5ml, redemoinho do tubo, e coloque em banho-maria a 37 ° C por 2-3 min
- Remover solução inibidora de tripsina
- Repita o passo 13 e 14 três vezes
- Adicionar PM morna 20ml
- Triturar até que todos os grumos desapareceram (~ 20-30 vezes)
- Centrifugar a 100xg para 7min
- Ressuspender o sedimento em 10ml PM e lavar duas vezes por centrifugação
- Ressuspender o sedimento em 10ml PM para as culturas de neurônios regular ou em NBB27/DMEM para culturas agregadas
- Passe as células através de uma peneira 70μm celular
- Contagem de células vivas
- Proceder às culturas agregadas, como descrito abaixo ou a placa de células para as culturas de neurônios regulares
Nota: Nesta etapa, as culturas de neurônios altamente enriquecido pode ser alcançado por plaqueamento das células dissociadas em PDL revestimento de placas a densidade de 200-640 células / mm 2, dependendo da finalidade de experimentos. Depois que as células tenham aderido (~ 2-4h), substituir média com PM quente. Se cultivo por longos períodos de tempo, no dia 4, substitua a metade da média com CM quente. Para culturas altamente purificada neuronal, inibidor mitótico 5 FDU (concentração final 10 mM) podem ser adicionados a div2 para inibir a não-proliferação de células neuronais (ie, durante div2-3). Após a recuperação no CM por 2 dias, as células são tratadas de pulso novamente com 5-FDU por mais 2 dias (DIV 6-7) seguido por uma mudança médio completo. Depois, substituir metade do meio com frescos, CM morna a cada 3-4 dias. Neurônios são viáveis por até quatro semanas.
Agregados preparação e revestimento
- Suspender células dissociadas em meio NBB27/DMEM contendo 1x Sato, 10ng/ml CNTF e 10μM forskolin a uma densidade de 2x10 6 células / ml
- Transferência de 2 ml de suspensão de células em cada poço de uma placa não revestidos 6-bem
- Cultura para 3 noites. Cada dia, gentilmente ressuspender as células, uma vez usando um Pipetman P1000
Nota: As células começam a formar agregados (Figura 1). - No dia antes do plaqueamento agregado, casaco placa / lamínulas com Matrigel:
- Diluir estoque Matrigel (fator de crescimento reduzido, BD Biosciences 354230) 1:20 com DMEM frio no gelo
Nota: alíquotas Matrigel deve ser preparado por protocolo fabricante. Todas as dicas, os tubos de Eppendorf e soluções para a tomada de alíquotas do estoque deve ser frio para evitar a polimerização Matrigel. Alíquotas de Matrigel são mantidos a -80 ° C e descongeladas a 4 ° C. - Brasão anteriormente PDL revestido com lamínulas 300μl/well da solução diluída Matrigel durante a noite em uma incubadora de 37 ° C
- Lavar com PBS quente, em seguida, lave com água morna estéril placa DDH 2 O e deixar as placas na incubadora.
- Diluir estoque Matrigel (fator de crescimento reduzido, BD Biosciences 354230) 1:20 com DMEM frio no gelo
- 3 dias após a formação de agregados, delicadamente ressuspender as células novamente e peneirar a suspensão através de uma malha 200μm em um tubo Falcon de 50ml. Permitir agregados para resolver para o fundo do tubo por gravidade (~ 3-5min)
- Remova cuidadosamente o sobrenadante
- Adicionar médio, delicadamente ressuspender os agregados e deixá-los resolver novamente. Repita este procedimento várias vezes para remover as células mortas, as células individuais e detritos. Uso de microscópio para verificar se o sobrenadante ainda conter não agregados células e debris
- Delicadamente ressuspender os agregados no meio NBB27/DMEM mesmos (Figura 1) e contagem de agregados
- Ajustar a densidade de agregados para cerca de 25-30 aggreggats/50ul
- Alíquotas de transferência (500-1000μl) da suspensão total para tubos Eppendorf de 2 ml para revestimento
Nota: Como agregados tendem a estabelecer-se no fundo dos tubos, é crucial para fazer tubos múltiplos da suspensão agregado para revestimento. Delicadamente ressuspender os agregados muitas vezes antes da semeadura-los em lamínulas revestidos ou placas de cultura para garantir número similar de agregados banhado em cada lamela. - Retire a placa de cultura contendo Matrigel revestido lamínulas de incubadora. Remoção da solução de cada bem, lavar as lamelas com PBS quente e 2 DDH O, e, em seguida, uma breve e seco. Eles estão agora prontos para a semeadura agregado
- Inverter um tubo contendo a suspensão total, que lhes permitam ser distribuídos uniformemente antes da semeadura. 50μl de suspensão de carga agregada no centro de cada lamela, e gentilmente colocou a placa de volta à incubadora, sem qualquer perturbação adicional para permitir agregados para anexar uniformemente para a lamela
Nota: A densidade dos agregados é crucial. Se agregados são semeadas muito próximos uns dos outros ou se a densidade de semeadura é alta, eles tendem a se fundem à medida que crescem. - Adicionar DMEM/NBB27medium adicionais (500 mL) a cada 4-6 h bem mais tarde ou cedo na manhã seguinte
- Para manter a cultura agregado, metade mudança do meio a cada 3-4 dias. Quando a mudança médio, ter cuidado para não perturbar os agregados e isso é feito por meio suavemente adicionando ao longo da parede lateral do poço.
Nota: Poucas horas depois de agregados ligados à placa, crescimento de neuritos dos agregados pode ser observada. Axônios crescem rapidamente nas primeiras duas semanas e formar conexões abundantes entre os agregados (Figura 2). Progenitores gliais migram radialmente para fora dos agregados e diferenciar ao longo do tempo em astrócitos e oligodendrócitos maduros.
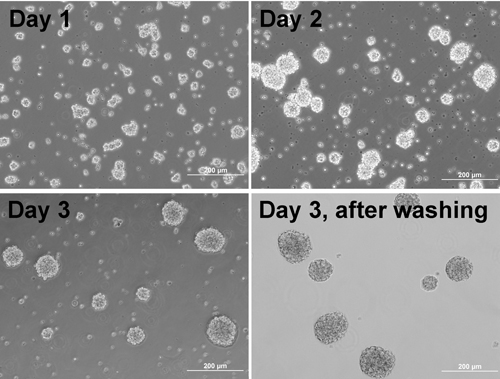
Figura 1. Imagens de contraste de fase de células formando agregados em dias diferentes e agregados após a lavagem.

Figura 2. Phase imagens de contraste de uma cultura agregada 2 e 12 dias após semeado em Matrigel revestido lamínulas.
Access restricted. Please log in or start a trial to view this content.
Discussão
Os primeiros estudos relataram a formação de sinapses e de mielina maduras em rotação mediada livre de culturas agregada flutuante 1. O SNC sistema de cultura agregada descrita aqui combina sem soro crescimento de células progenitoras multipotentes em três agregados dimensional com a conveniência de culturas tradicionais em 2D para facilitar a análise de migração celular, desenvolvimento e diferenciação in vitro. O sistema pode ser modificado e usado para precursoras neurais pesquisas com...
Access restricted. Please log in or start a trial to view this content.
Agradecimentos
Este estudo foi financiado em parte por fundos start-up da Universidade Texas A & M
Access restricted. Please log in or start a trial to view this content.
Referências
- Matthieu, J. M. Myelination in rat brain aggregating cell cultures. Neuroscience. 3, 565-56 (1978).
- Chen, Y. ing Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat. Protocols. 2, 1044-10 (2007).
- Watkins, T. A., Emery, B., Mulinyawe, S., Barres, B. A. Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron. 60, 555-55 (2008).
- Svenningsen, A. F., Shan, W. ei-S. ong, Colman, D. avidR., Pedraza, L. iliana Rapid method for culturing embryonic neuron-glial cell cocultures. Journal of Neuroscience Research. 72, 565-56 (2003).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados