É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
In vivo Ca 2 + - Imagem de Neurônios Corpo Mushroom durante o aprendizado olfativo no Honey Bee
Neste Artigo
Resumo
Abelhas pode ser condicionado em um paradigma de aprendizado apetitivo olfativo (PER-condicionado). Usando odores como estímulos, estabelecemos um método em que o comportamento é gravado simultaneamente imagens de cálcio é usado para medir a atividade do odor evocado nos neurônios do corpo de cogumelo In vivo.
Resumo
A in vivo e semi-vivo, em preparação para a imagem latente de cálcio tem sido desenvolvido em nosso laboratório por Joerges, Küttner Galizia e mais de dez anos atrás, para medir a atividade odor evocado no lobo antenal 1. A partir de então, ele tem sido constantemente refinados e aplicados a neuropiles diferentes no cérebro das abelhas. Aqui, descrevemos a preparação atualmente usado em laboratório para medir a atividade nos neurônios do corpo usando um cogumelo acoplado dextran cálcio sensíveis corante (Fura-2). Nós retrogradamente mancha neurônios corpo de cogumelos pela injeção de corante em seus axônios ou região soma. Nós nos concentramos em reduzir a invasão, para conseguir uma preparação em que ainda é possível treinar a abelha usando PER condicionado. Somos capazes de monitorar e quantificar a resposta comportamental gravando electro-myograms do músculo que controla o PER (M17) 2.
Após a experiência fisiológica das estruturas imaged são investigados em maior detalhe por microscopia confocal para tratar a identidade dos neurônios.
Protocolo
Bee Preparação e Back-fill
- Forrageiras pegar mel de abelha em colmeia e frio no gelo para imobilização.
- Montagem em Plexiglas gravação câmaras 3. Fixar os olhos e tórax para as paredes da câmara gravando com cera baixo ponto de fusão rígido.
- Puxe capilares de vidro tão comumente utilizado para eletrofisiologia e quebrar na ponta para obter um diâmetro da ponta de ca. 10μm. Cobrir a ponta do capilar com pasta de corante. Colar Dye consiste de uma mistura 10:01 de Fura-2 dextran e fixable lisina tetrametilrodamina dextran.
- Para o procedimento de coloração imobilizar antenas com minúcias ou n-eicosane. Retire um pedaço de cutícula acima do cérebro e glândulas empurrar e traquéia para o lado para permitir o acesso ao corpo de cogumelo.
- Injetar capilares em qualquer soma ou região axonal dos neurônios do corpo de cogumelo. Isto pode ser feito a mão livre ou através de um manipulador micro. Em seguida, restaurar parte da cutícula na cápsula de cabeça e soltar antenas.
- Alimentar as abelhas com solução de sacarose 30% antes de armazená-los em um caso umidificado por pelo menos quatro horas ou durante a noite a 20 ° C.
In vivo de imagens
- Impedir os movimentos do exemplo da abelha com um pequeno pedaço de esponja que é pressionado contra o abdômen e fixada com um clipe ou fita para a câmara de gravação.
- Para impedir o movimento do cérebro resultante de bombeamento do esôfago, corte uma pequena incisão na cutícula acima do labrum e retire cuidadosamente o esôfago e seu entorno estruturas sólidas para colocá-la sob tensão, sem danificar o esôfago 4. Cubra com duas silicone componente.
- Faça furos com uma agulha e inserir eletrodos de arame para a gravação de M17.
- Retire parte da cutícula, traquéia e glândulas acima do cérebro. Sugar heamolymph dentro da cápsula cabeça com um pedaço de papel.
- Encher a cápsula cabeça com dois silicone componente. É importante que o cérebro está completamente coberto.
- Abelha lugar no palco do microscópio e coloque uma gota de água sobre a superfície do silicone para imergir o objetivo mergulho do microscópio para a gota. Concentre-se em neurônios manchado.
Estimulação odor e gravação de sinais
Olfatômetro: Nós usamos um computador controlado, dispositivo de estimulação personalizado construído ou "olfatômetro", como descrito anteriormente por Galizia e Vetter 3. Odores são diluídos em um fluxo constante de ar dirigido para as antenas. Qualquer estímulo consiste de um pulso de 3s odor de ar odor 0.2ml saturada. O protocolo de estimulação pode ser definido na TILLVision software de gravação.
Microscópio e Imagem set-up: Nós usamos um microscópio de fluorescência Zeiss. As imagens são gravadas a 25 ° C com uma taxa de amostragem de 5 Hz usando uma TILL-Photonics dispositivo de imagem montado no microscópio. Sinais de cálcio são registrados através de um X60, 0,9 W Olympus mergulho objetivo com um CCD Imago câmera (640X480 pixels, 4X binned em chip para 160X120 pixels). Fura-2 está animado com a luz monocromática de 340 e 380nm de comprimento de onda para medições raciométrica. Fluorescência é detectada através de um espelho dicróico 410nm e um filtro passa-440nm de comprimento. Os parâmetros para a gravação são definidas no software de gravação. Cada medição dura 10s e tempo de exposição para os dois comprimentos de onda pode ser ajustado para a intensidade de coloração em cada preparação.
M17 gravação: O músculo transferidor do lábio (M17) é gravado extracelularmente para monitorar as respostas comportamentais relacionados com a aprendizagem, ou seja, os 5 PER, 6. Injetar um fio de cobre no músculo perto da partes da boca. Injetar eletrodo terra no olho. Os potenciais musculares são amplificados com um costume construir pré-amplificador, digitalizadas e armazenadas em um computador. Início do estímulo é desencadeado pela olfatômetro.
Análise de Dados
- Durante o experimento: As gravações do sinal de cálcio são alimentados em um computador e armazenado. O TILLVision software de gravação permite uma inspecção inicial dos sinais, como o cálculo da relação entre os comprimentos de onda (340nm/380nm) e cálculo de deltaF (subtração da linha de base).
- Processamento de imagem é realizada com o costume programas escritos em IDL. Calcular proporção de Ca 2 + sinais de 340nm e 380nm medições para cada pixel. Determine fundo de fluorescência (F) pela média de mais de frames antes do estímulo e subtrair o sinal raciométrica (deltaF).
- Para definir região de interesse (ROI): Calcular média de frames durante o estímulo e aplicar um filtro passa-baixa (3X3px). Converter em escala de cinza para escala de cores falsas. Determinar a atividade neuronal em estruturas como pontos de atividade em imagens de cores falsas e definir como ROI.
- Calcular dinâmica temporal das regiões ativas pela média dos pixels na ROI sobre todas as imagens sem qualquer filtragem ou correção.
Análise morfológica e Reconstrução
Juntamente com o dextran Fura-2 enchemos os neurônios com o corante rodamina fixable dextran ("mini ruby"). Ambos os corantes têm o mesmo peso molecular, que devem ser co-localizados nos neurônios. Grande campo de imagem permite apenas a resolução espacial muito limitada, portanto recomenda-se a investigar as estruturas manchado após o experimento usando microscopia confocal.
- Após as medições fisiológicas, dissecar o cérebro e se fixar.
- Enxágüe em PBS e desidratar stepwise em etanol e salicilato de metila em claro.
- Microscopia confocal para incorporar cérebro em salicilato de metila.
- Nós usamos um microscópio Leica TCS SP2. Comprimento de onda de excitação é 543nm.
- Nós escanear o cérebro com um ar ou objetiva de imersão em óleo e comparar as estruturas coradas com os dados de imagem.
Resultados representativos:
Se a coloração e preparação foi bem-sucedida, o sinal na escala de cores falsas, por exemplo, em cogumelo corpo neurônios alfa lobo extrínsecos, poderia olhar como na figura 1.
A resposta comportamental (PER) pode ser calculado como freqüência de pico durante a estimulação menos freqüência pico antes do estímulo (Figura 2).
As estruturas manchadas podem ser investigadas em maior detalhe o uso de um microscópio confocal (Figura 3).

Figura 1: Os sinais de cálcio Representante Imaging (estimulação com heptanal). A: região fotografada do cérebro das abelhas. B: image fluorescentes Raw como pode ser visto através de um mergulho X20 objetivo no comprimento de onda de excitação 380nm, o lobo-alfa do corpo cogumelo é descrito em roxo. Corante foi injetado no rim ventro-lateral dos lobos alfa-manchar neurônios extrínsecos. C: Imagem em cor falsa derivado do sinal de média, deltaF (340/380), durante o estímulo três segundo, alfa-lobo descritas em roxo, ROI selecionada delineadas em preto. D: dinâmica temporal do sinal de cálcio em resposta à estimulação odor, sinal média da região de interesse, como indicado no C. E: dinâmica temporal do sinal de cálcio em resposta à estimulação de sacarose da ipsi-e contra-lateral da antena, respectivamente para o ROI indicado em C.

Figura 2: resposta M17 Representante. Após o condicionamento olfativo a abelha estende a tromba quando o odor é apresentado sem recompensa. Linha vermelha indica o estímulo do odor. Detalhe: PER da abelha.
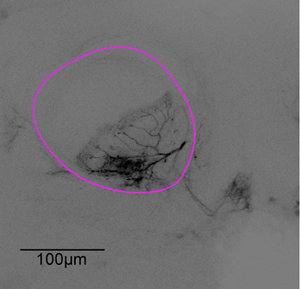
Figura 3: Representante da pilha de imagens. Após a experiência de imagem do cérebro foi dissecado. O neurônio da figura 1 é digitalizado usando um microscópio confocal com uma objetiva de imersão X20 petróleo, alfa-lobo descritas em roxo.
Access restricted. Please log in or start a trial to view this content.
Discussão
Nesta apresentação nós já passamos por todas as etapas para investigar sinais de cálcio vivo na abelha. Nós aplicamos essa técnica para os neurônios do corpo de cogumelo, mas de imagens pode ser feito em todos os neurônios para que uma técnica de coloração pode ser estabelecida. Temos nos concentrado em neurônios na via olfativa da abelha melífera. Os experimentos são realizados em uma câmara escura. A configuração é iluminado com uma luz de onda longa que se encontra fora da faixa d...
Access restricted. Please log in or start a trial to view this content.
Agradecimentos
Este trabalho é financiado pela DFG.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| low melting point hard wax Deiberit 502 | Dr. Böhme Schöps Dental GmbH | ||
| FURA-2 dextran potassium salt, 10 000 MW | Invitrogen | F-3029 | Protect from light. |
| tetramethylrhodamine dextran 10 000 MW | Invitrogen | D-3312 | Protect from light. |
| n-eicosane | Sigma-Aldrich | 21, 927-4 | |
| Kwik Sil Adhesive | World Precision Instruments, Inc. | KWIK SIL | |
| Imaging Set-up | TILL Photonics | ||
| CCD camera | Imago | ||
| CED | Texas Instruments |
Referências
- Joerges, J., Küttner, A., Galizia, C. G., Menzel, R. Representations of odors and odor mixtures visualized in the honeybee brain. Nature. 387 (6630), 285-288 (1997).
- Rehder, V. Quantification of the honeybee's proboscis reflex by electromyiographic recordings. J. Insect Physiol. 33, 501-507 (1987).
- Galizia, C. G., Vetter, R. S. Optical Methods for Analyzing Odor-Evoked Activity in the Insect Brain. Methods in Insect Sensory Neuroscience. Christensen, T. A. , CRC Press. Boca Raton. 345-388 (2004).
- Mauelshagen, J. Neural correlates of olfactory learning paradigms in an identified neuron in the honeybee brain. J Neurophysiol. 69 (2), 609-625 (1993).
- Kuwabara, M. Bildung des bedingten Reflexes von Pavlovs Typus bei der Honigbiene Apis mellifica, Hokaido Univ. Zool. J. Sci. 13, 458-464 (1957).
- Bitterman, M. E., Menzel, R., Fietz, A., Schafer, S. Classical conditioning of proboscis extension in honeybees (Apis mellifera. Journal of Comparative Psychology. 97 (2), 107-119 (1983).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados