É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagens ao vivo de Drosophila melanogaster Embrionárias Migrações hemócitos
Neste Artigo
Resumo
Hemócitos Drosophila dispersam sobre a totalidade do embrião em desenvolvimento. Este protocolo demonstra como montar e imagem essas migrações usando embriões com hemócitos fluorescente etiquetado.
Resumo
Muitos estudos de migração de células endereço usando
Protocolo
Preparação
- Obter linhas apropriadas Drosophila contendo um hemócitos específicos Gal4 driver (por exemplo, srp-Gal4 2) e um repórter geneticamente codificado fluorescente sob controle UAS (por exemplo, uas-GFP). Moscas homozigotos para srp-Gal4, uas-GMA 3 ou CRQ-Gal4, uas-GFP 4, 5 são particularmente úteis para fins de imagem (nb GMA é GFP fundida ao domínio de ligação de actina de moesin), veja abaixo para uma discussão sobre a gama de Gal4 motoristas e uas construções disponíveis (o Centro de Bloomington stock contém uma grande variedade).
- Cruzes tipicamente genética são realizadas de tal forma que alelos mutantes são equilibradas usando fluorescentes balanceadores CTG ou TTG 6, com Gal4 motoristas e uas construções realizadas em alternativa cromossomos homólogos. Isto torna possível selecionar mutantes homozigotos com base na ausência de CTG / TTG-associado de fluorescência da GFP (isto é feito na fase 2.11).
- Ampliar ações e moscas lugar em uma gaiola de assentamento com uma placa de ágar suco de maçã 7. As moscas precisa de pelo menos dois dias para aclimatar à gaiola que estabelece o suficiente antes de embriões começam a ser estabelecidas. Em geral twenty moscas de cada sexo deve ser suficiente para gerar embriões suficiente para geração de imagens, mas deve ser notado que linhas diferentes têm diferentes graus de fertilidade. Nós usamos 55 milímetros pratos de Petri que se encaixam na parte inferior de um copo de plástico, perfurado na sua base para permitir o fluxo de ar. A forma exata da colheita de embriões não é importante, mas os horários são críticos, a fim de coletar corretamente encenado embriões.
- Coletar embriões de um dia para o outro placa de ágar suco de maçã mantida a 25 ° C ou a partir de uma placa cronometrados. Para este último que geralmente permitem que as moscas para colocar em um prato pré-aquecido por 4 horas, antes de remover a placa e colocá-lo a 18 ° C por 15-16 horas antes da montagem de embriões, o que fornece embriões de fase tardia de 12 a para o estágio 15 de desenvolvimento. Uma placa de overnight contém uma maior diversidade de fases, mas oferece a vantagem de níveis mais elevados de expressão repórter fluorescentes em hemócitos devido a um longo período de tempo a 25 ° C como o sistema Gal4-UAS é sensível à temperatura.
Procedimento
- Desalojar embriões a partir da placa de ágar suco de maçã utilizando uma pequena quantidade de água e um pincel macio de ponta. Embriões desalojado pode ser visto facilmente a olho nu.
- Transferência de embriões para um filtro de células (Fisher), ou home-made cesta de 7 por despejar água a partir da placa de ágar suco de maçã na cesta realizada ao longo de um copo para pegar água de resíduos.
- Repita o passo 2,2 até ficar satisfeito você tem embriões suficientes transferidos da placa de ágar suco de maçã.
- Lavar embriões em coador de células / cesta com água.
- Célula local do filtro / cesta na tampa placa de Petri da placa de ágar suco de maçã e acrescente o suficiente lixívia pura para suspender embriões no coador de células / cesta.
- Siga dechorionation dos embriões em um microscópio de dissecção sob brightfield: dechorionation está completa quando os apêndices dorsal ter dissolvido, o que deve ocorrer dentro de dois minutos.
- Remover células do filtro / cesta contendo embriões a partir da lixívia e lavar lixívia residual com água. Todos os vestígios de água sanitária deve ser removido antes de prosseguir para o passo 2.8. Um truque para avaliar se todos os lixívia foi removido para fora da água residual blot em tecidos de cor azul laboratório - se houver lixívia residual a cor azul vai ser branqueada branco / rosa.
- Blot fora da água restante através de tecidos de laboratório / mediwipes aplicado na face inferior da célula coador / cesta.
- Coloque uma gota de água em uma tampa de placa de Petri. Com um pincel fino, recolher todos os embriões dechorionated da cesta embrião e ressuspender-los na gota. Em seguida secar os embriões por aspiração de água usando uma micropipeta ou absorvendo-o cuidadosamente com um tecido de laboratório / mediwipes.
- Uma vez que os embriões foram secos, adicione uma gota de óleo voltalef para cobrir todos os embriões. Colocar uma segunda gota pequena de óleo junto ao gotículas contendo os embriões. NB temos sido incapazes de encontrar um fornecedor baseada no Reino Unido de óleo voltalef; halocarbono óleo 700 (Sigma) pode ser utilizado.
- Sob um microscópio fluorescente dissecção selecionar adequadamente encenado embriões do genótipo desejado usando um par de fórceps relojoeiros (número 5) a partir da gota de óleo. Estas pinças devem ser dobrados para dentro (Figura 1), a fim de colher-se os embriões sem a sua perfuração da membrana vitelina. Transferência de embriões selecionados para a segunda gota de óleo. É importante que você é capaz de ver hemócitos fluorescente no microscópio de dissecação, a fim de ser capaz de coletar boas imagens no microscópio confocal (Figura 2). Normalmente, montagem embriões em estágio 13/14 à migração imagem lateral do hemócitos na linha média ventral ou estágio 15 embriõespara a imagem da motilidade dos hemócitos seguintes dispersão sobre o embrião.
- Vara duas lamelas (18x18mm, espessura 1) para a parte inferior de um prato Petriperm / Lumox (Sarstedt), usando duas pequenas gotas de óleo voltalef, deixando cerca de um centímetro entre eles (Figura 3), que serão utilizados para apoiar uma lamela colocada sobre os embriões, de modo a não esmagá-los. Pratos Petriperm (diâmetro 50mm) contêm uma hidrofóbica, a membrana gás-permeáveis. Nós achamos que os pratos se tornam mais fáceis de usar, uma vez que têm sido usadas várias vezes (os pratos podem ser limpas com álcool 70% e reutilizados).
- Sob brightfield no microscópio de dissecção, pegar embriões selecionados, um por um com a pinça dobrados e alinhá-las lado ventral para cima e paralela à borda da lamínulas (Figura 3). É possível alinhar até 15 embriões, desta forma, dependendo da sua destreza e paciência. É importante para manipular os embriões gentilmente tanto como os embriões e da membrana prato Petriperm são frágeis e podem ser facilmente rompido.
- Uma vez que os embriões são alinhados adicionar uma pequena gota de óleo e deixe-a se espalhar para formar uma camada homogênea entre as duas lamelas. Depois que o óleo se espalhou (isso pode levar alguns minutos) verificar que os embriões ainda estão lado ventral para cima. Se os embriões têm rolado ligeiramente, reposicioná-los novamente com a pinça.
- Finalmente, usando uma pinça (número 3) coloque uma lamínula (18x18mm, espessura 1) ao longo dos embriões, descansando sobre as duas lamínulas previamente aderido. Cola esta lamela à lamela suporta o uso de unha polonês (Figura 3).
- Leve o prato Petriperm com embriões montado ao microscópio confocal ou wide-campo e montar o prato Petriperm no palco usando um adaptador apropriado. Ou um microscópio vertical ou invertida pode ser usado, com a lente objetiva com foco através da lamela (ao contrário através da membrana).
Resultado representante:
Este protocolo descreve como montar Drosophila embriões para geração de imagens ao vivo de hemócitos no lado ventral do embrião. Se feito corretamente, será fácil de gerar ou fotos ou filmes de hemócitos. O principal determinante é o microscópio usado para a imagem do hemócitos (em particular a lente objetiva), mas a natureza das imagens adquiridas também vai depender do estágio de desenvolvimento, a temperatura, os embriões foram levantadas na e as linhas Gal4 e uas usado.
Níveis mais elevados de expressão da proteína fluorescente permitirá hemócitos a ser trabalhada com maior facilidade, por isso é importante ser capaz de ver hemócitos quando os embriões estão em fase de 2,11 do protocolo (Figura 2 contém exemplos de hemócitos clara dentro embriões, tiradas com uma câmera equipada com um microscópio de dissecção). Números, portanto, aumento da Gal4 e constrói uas permitir uma maior relação sinal-ruído. Além disso reduz a necessidade de laser de alta intensidade ou tempo de exposição aumentou quando de imagem, que por sua vez permite um comportamento hemócitos a serem seguidos por longos períodos de tempo.
Níveis muito altos de expressão GFP vai aparecer pequenos detalhes da morfologia hemócitos, particularmente as lamelas como folhas finas que circundam o corpo da célula circular (Figura 4A-B). Regiões circulares excluindo GFP representam fagossomos (Figura 4A-C). Dedo-como filopodia também pode ser visto emergindo das lamelas (Figura 4B). Dois motoristas permanecem Gal4 suficiente para ver estes processos (Figura 4C), especialmente se um ou mais é srp-Gal4 (ver discussão), porém menor velocidade de digitalização ou maior poder de laser sobre o microscópio confocal pode ser necessária. Como diminuir os níveis de expressão se torna mais difícil para a imagem do saliências de hemócitos, no entanto, ainda é possível acompanhar a migração dos hemócitos sob essas condições como o corpo da célula continua a ser evidente, mesmo quando as saliências são menos claras (Figura 4D).
Em fases anteriores de desenvolvimento (até estágio 13) hemócitos migram em estreito contacto uns com os outros e muitas vezes é difícil distinguir células individuais. Ao final do estágio 13 hemócitos formaram uma única linha para baixo da linha mediana ventral (Figura 5A), então, cada vez mais móveis, migrar lateralmente para as bordas do cordão nervoso ventral (Figura 5B). O citoesqueleto de actina dentro do saliências dinâmica de hemócitos pode ser observado diretamente através da expressão do GMA (Figura 5C) ou cereja-moesin.
Montagem da embriões desta forma permite trocas gasosas e evita a desidratação e embriões permanecem viáveis imagem seguinte. Se o embrião é danificado durante a montagem é geralmente óbvia como o conteúdo do embrião vai vazar através da sua membrana vitelina. Se um embrião não começar a desidratar, então este pode muitas vezes foi visto por deformações na membrana vitelina. Ocasionalmente, um embrião vai rolar durante o curso de um filme timelapse, no entanto isso só tende a ser problemático para filmes mais longos prazos. Lastly, montando vários embriões ao mesmo tempo dá ao experimentalista a melhor chance de obter um embrião na orientação perfeita para seu experimento.

Figura 1. Pinças para a manipulação de embriões dechorionated.
As pontas dos relojoeiros fórceps (número, tamanho 5) devem ser dobrados para dentro, a fim de moda uma ferramenta para recolher embriões como mostrado aqui. A superfície externa da região dobrado também é útil para manipular embriões ao se posicionar sobre a membrana Petriperm como eles não possuem bordas afiadas que podem perfurar o embrião.
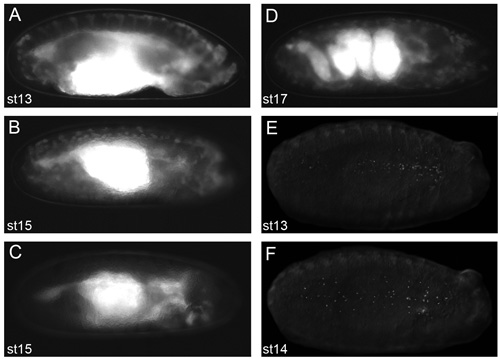
Figura 2. Imagens representativas de embriões que renderá bons resultados de imagem ao vivo.
Imagens de embriões dechorionated em óleo voltalef (2,11 na fase do protocolo), tomada em um microscópio de fluorescência de dissecação. Vistas laterais do estágio 13 (A) e estágio 15 (B) srp-Gal4, uas-GFP; CRQ-Gal4, uas-GFP embriões. Vista lateral de um palco 15 srp-Gal4, uas-GFP / +; CRQ-Gal4, embrião uas-GFP/uas-N17Rac (C) em que hemócitos não conseguiram migrar para fora da cabeça, demonstrando que os embriões olhar como quando hemócitos não são aparentes ao longo de suas rotas migratórias. Vista lateral de um palco 17 srp-Gal4, uas-GFP; CRQ-Gal4, embrião uas-GFP mostrando a estrutura complicada do intestino, nesta fase de desenvolvimento (D); o início da contração muscular impede imagens ao vivo de embriões para além deste estágio de desenvolvimento. Vista ventral da etapa 13 (E) ea fase 14 (F) srp-Gal4, embriões uas vermelho stinger mostrando dispersão de hemócitos com núcleos fluorescente etiquetado. Observação de hemócitos por fluorescência em fase de 2,11 do protocolo é um pré-requisito para obtenção de imagens excelentes; anterior está à direita de todas as imagens.

Figura 3. Montagem de embriões em um prato Petriperm / Lumox.
Duas lamínulas 18x18mm (espessura 1) estão presos à face inferior do prato Petriperm usando uma pequena gota de óleo, separados por cerca de um centímetro, como mostrado. Embriões são então alinhadas lado ventral com seu eixo longo (ântero-posterior) para as bordas das lamínulas e coberto com uma pequena gota de óleo. Depois que o óleo se espalhou para preencher a lacuna entre as duas lamínulas uma lamela terceiro (18x18mm espessura 1) é gentilmente colocada em cima dos embriões de óleo coberto com as duas lamínulas previamente aderido como uma ponte para evitar os embriões de ser esmagado. Esta lamela é então colada às duas pontes lamela usando duas pequenas gotas de unha polonês. Uma vez definido, os embriões podem ser visualizados num microscópio vertical ou invertida com a lente objetiva com foco para baixo através da lamela (ao contrário através da membrana Petriperm).
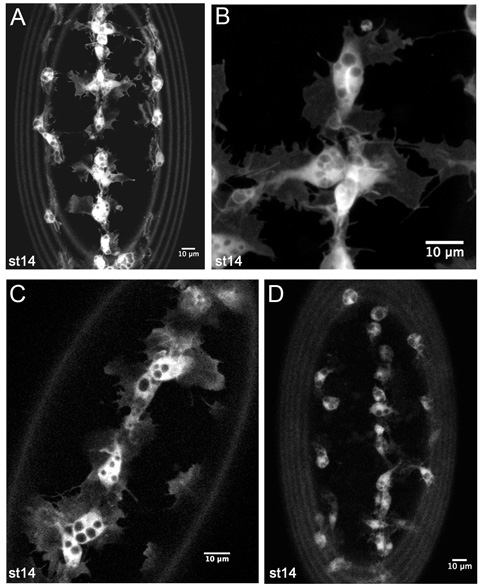
Figura 4. Resultados representativos de imagens ao vivo de hemócitos GFP rotulados.
Z-projeções de hemócitos no lado ventral de um estágio 14 srp-Gal4, uas-GFP; CRQ-Gal4, embrião uas-GFP (AB). (A) é uma imagem de menor ampliação, como as utilizadas para monitorar hemócitos migrações de desenvolvimento em filmes timelapse. (B) é uma ampliação maior ainda de hemócitos na linha média ventral, mostrando detalhes de sua morfologia. (C) é uma fatia única m 1 de hemócitos na linha média ventral em um estágio 14 srp-Gal4, uas-GFP / +; CRQ-Gal4, uas-GFP / + embrião, revelando que menor número de cópias de Gal4 motoristas e uas construções também são suficientes para gerar boas imagens. (D) exibe uma z-projeção de hemócitos em um estágio CRQ-14 Gal4, embrião uas-GFP. Aqui saliências hemócitos são menos óbvios devido à menor expressão da GFP, mas ainda é possível fazer filmes e acompanhar a migração hemócitos com esta combinação de Gal4 motorista e uas construir. Imagens foram obtidas em um microscópio confocal LSM510 Leica; anterior é em todas as imagens, os anéis na periferia de imagens são causadas por vitelínico autofluorescência membrana.

Figura 5. Resultados representativos de imagens ao vivo de hemócitos GMA expressar.
Z-projeções de hemócitos na linha média ventral do estágio 13 (A) e estágio 14 (B) srp-Gal4, uas-GMA embriões, retiradas de filmes timelapse para mostrar as migrações de desenvolvimento de hemócitos. Informações detalhadas sobre a dinâmica de actina pode ser obtido por imagem maior ampliação de hemócitos GMA expressar (C). GMA consiste de GFP fundida ao domínio de ligação de actina dos filamentos de actina moesin e etiquetas. Anterior é em todas as imagens, as imagens foram tiradas em um microscópio confocal.
Discussão
Os elementos mais importantes deste processo são a seleção de embriões saudáveis com hemócitos claramente identificados e montá-los sem danificá-los com cuidado. Uma vez que os embriões são no óleo halocarbonos são resistentes à desidratação e uma vez montada pode ser trabalhada por várias horas. Em nossas mãos, podemos hemócitos imagem para três horas, com desidratação insignificante do embrião ou do óbvio foto danos, tendo um z-stack de imagens a cada três minutos no nosso microscópio co...
Agradecimentos
Este protocolo foi desenvolvido através de nosso trabalho dentro e em colaboração com os laboratórios de Paul Martin e Antonio Jacinto. Agradecemos ao Centro de Ações Bloomington pelo seu excelente serviço e da comunidade Drosophila para continuar compartilhando linhas de voar. BS é atualmente financiado por uma doação do projeto BBSRC. WW é financiado por uma bolsa de Desenvolvimento de Carreira Wellcome Trust.
Materiais
| Name | Company | Catalog Number | Comments |
| Cell strainer | BD Biosciences | 352350 | 70μm pores |
| Halcarbon oil 700 | Sigma-Aldrich | H8898 | |
| Lumox/Petriperm dish | Sarstedt Ltd | 96077305 |
Referências
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bruckner, K. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7, 73-84 (2004).
- Dutta, D., Bloor, J. W., Ruiz-Gomez, M., VijayRaghavan, K., Kiehart, D. P. Real-time imaging of morphogenetic movements in Drosophila using Gal4-UAS-driven expression of GFP fused to the actin-binding domain of moesin. Genesis. 34, 146-151 (2002).
- Stramer, B. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Halfon, M. S. New fluorescent protein reporters for use with the Drosophila Gal4 expression system and for vital detection of balancer chromosomes. Genesis. 34, 135-138 (2002).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Tepass, U., Fessler, L. I., Aziz, A., Hartenstein, V. Embryonic origin of hemocytes and their relationship to cell death in Drosophila. Development. 120, 1829-1837 (1994).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135, 621-626 (2008).
- Doerflinger, H., Benton, R., Shulman, J. M., St Johnston, D. The role of PAR-1 in regulating the polarised microtubule cytoskeleton in the Drosophila follicular epithelium. Development. 130, 3965-3975 (2003).
- Olofsson, B., Page, D. T. Condensation of the central nervous system in embryonic Drosophila is inhibited by blocking hemocyte migration or neural activity. Dev Biol. 279, 233-243 (2005).
- Paladi, M., Tepass, U. Function of Rho GTPases in embryonic blood cell migration in Drosophila. J Cell Sci. 117, 6313-6326 (2004).
- Vlisidou, I. Drosophila embryos as model systems for monitoring bacterial infection in real time. PLoS Pathog. 5, e1000518-e1000518 (2009).
- Jacinto, A. Dynamic actin-based epithelial adhesion and cell matching during Drosophila dorsal closure. Curr Biol. 10, 1420-1426 (2000).
- Wood, W., Jacinto, A. Imaging cell movement during dorsal closure in Drosophila embryos. Methods Mol Biol. 294, 203-210 (2005).
- Kunwar, P. S. Tre1 GPCR initiates germ cell transepithelial migration by regulating Drosophila melanogaster E-cadherin. J Cell Biol. 183, 157-168 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados