É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliar Trials bidimensional cristalização de proteínas da membrana Pequenas de Estudos Biologia Estrutural por Cristalografia Electron
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Avaliação bidimensional ensaios (2D) de cristalização para a formação de matrizes de proteína de membrana ordenado é uma tarefa altamente crítico e difícil em cristalografia de elétrons. Aqui, descrevemos a nossa abordagem na triagem para identificação de cristais e 2D de proteínas da membrana predominantemente de pequena faixa de 15 - 90 kDa.
Resumo
Cristalografia eletrônica tem evoluído como um método que pode ser usado tanto em alternativa ou em combinação com tridimensional cristalização e cristalografia de raios X para estudar estrutura-função perguntas de proteínas da membrana, bem como proteínas solúveis. Triagem para duas dimensões (2D) cristais por microscopia eletrônica de transmissão (EM) é o passo fundamental na busca, otimização e seleção de amostras de alta resolução de coleta de dados por crio-EM. Aqui, descrevemos as etapas fundamentais na identificação de grandes e ordenada, bem como pequenos arrays 2D, que pode potencialmente fornecer informações críticas para a otimização das condições de cristalização.
Ao trabalhar com diferentes ampliações no EM, os dados sobre uma série de parâmetros críticos é obtido. Menor ampliação fornece dados valiosos sobre o tamanho e morfologia de membrana. Em ampliações maiores, as dimensões de cristal possível fim e 2D são determinados. Neste contexto, é descrito como câmeras CCD e online-Transformações de Fourier são usados em ampliações maiores para avaliar proteoliposomes para a ordem e tamanho.
Apesar de os cristais 2D de proteínas da membrana são mais comumente cultivada por reconstituição por diálise, a técnica de rastreio é igualmente aplicável para cristais produzidos com a ajuda de monocamadas, nativo cristais 2D, e ordenou matrizes de proteínas solúveis. Além disso, os métodos aqui descritos são aplicáveis à triagem para cristais de 2D ainda menor, bem como proteínas de membrana maior, onde as proteínas menores requerem a mesma quantidade de cuidado na identificação como nossos exemplos ea rede de proteínas maiores podem ser mais facilmente identificáveis em fases anteriores do exame.
Protocolo
1. Preparação grade de Ensaios Cristalização 2D
- Carbono revestido de 400 malha de cobre EM grades são preparados por mancha negativa. Acetato de uranila é freqüentemente usado e fornece uma mancha de longa duração em termos de armazenamento da solução por vários meses antes do uso, bem como aptidão para armazenamento de longo prazo das grades. Em contraste, outras manchas negativas, como formiato de uranila, proporcionando excelente coloração, precisam ser feitos recentemente 1. Para a preparação rápida de um grande número de redes a ser utilizado para triagem de ensaios de cristalização em 2D, uma versão modificada da coloração negativa é usado. Um volume de 2 mL de amostra pipetado está dentro de uma grade de carbono coberto de EM e incubados por 60 s. Isso é seguido por blotting da borda com um pedaço de Whatman # 4 papel de filtro (Figura 1; de vídeo), e em seguida, 2 mL de acetato de uranila 1% são aplicadas imediatamente, que são apagados novamente a partir da borda da grelha depois de 30 s. Tocar a rede na borda com a borda rasgada do papel de filtro garante a remoção ideal de líquido sem remoção de proteoliposomes. Além disso, a secagem na borda da rede garante melhor preservação do filme de carbono. Cuidados devem ser tomados no preparo e manuseio das grades, como a quebra do filme de carbono previne a adesão da amostra delicada e pode resultar em uma representação imprecisa da amostra. Enquanto os volumes de amostra, tradicionalmente maiores de 5 mL foram e são usados rotineiramente para a preparação de grade, amostras preciosas podem ser salvas através da redução do volume para 2 mL ou menos 2.
- Para produzir o maior membranas possível, algumas de nossas amostras requerem altas concentrações de glicerol ou sacarose (10-20%) para estar presente no buffer de diálise. Isso pode ter um efeito negativo sobre a preparação da rede, como o glicerol ou sacarose é altamente viscosa e impede acetato de uranila de penetrar adequadamente o buffer e, portanto, incompleta coloração das membranas. Consequentemente, uma grade possível será obscurecida. Ou o buffer pode ser trocado por centrifugação das amostras e substituição por glicerol / sacarose livre de buffer (não mostrado), ou as grelhas podem ser lavadas com tampão ou glicerol / sacarose livre de buffer em um a vários ciclos antes coloração negativa semelhante ao uma técnica usada para crio-EM 3,4.
2. Avaliar Trials Cristalização 2D por EM
- Dependendo do tipo de porta-amostras, ou uma ou várias redes são carregados. A ampliação de dois-10K, que será referido aqui como ampliação de intermediários, permite uma primeira impressão de distribuição de média e grau de dispersão das membranas, morfologia e tamanho, que é tomado conhecimento no caderno de laboratório 5. Áreas adequadas são registrados como representante súmulas com a ajuda de uma câmera CCD ou, se uma câmera CCD não está disponível, no filme.
- Baixa ampliação na faixa de cerca de 400-800x é usado nos momentos em que uma visão geral de toda a amostra / grid é desejada. Embora não seja empregada em cada grade, baixa ampliação fornece informações valiosas de ajuda na avaliação da preparação da rede em termos de vários aspectos: ambos coloração negativa e quebra parcial potencial do filme de carbono, a concentração da amostra na grade, e possivelmente irregular distribuição proteoliposome. Quadrículas indivíduo pode ser visto com binóculos ou a câmera CCD. Com alguns EMs é possível salvar posições de interesse particular, que pode ser recuperado para inspeção posterior em ampliações maiores.
- Uma vez que uma área da grade de interesse foi identificada em uma ou outra ampliação baixa ou intermediária, a ampliação é alterado para cerca de 60K 50K. Dependendo do cristal de membrana, eo tamanho da célula unitária, se conhecido, ampliações tão baixo quanto 30K e tão alta como 80K são usados. A gama de ampliação de 30-80K será referido como alta ampliação para fins de triagem para cristais 2D. Focando ocorre tanto na definição do foco da baixa dose set-up, com a opção após a imagem / foto configuração, ou nas imediações da área de interesse.
- Em caso de ambiguidade em saber se a área de interesse é de fato uma membrana, a amostra é inspecionado para o carbono-filme do tamanho do proteoliposomes, mica, ou outros artefatos. Para esta finalidade, dobrando as bordas revelar e morfologia típicas.
- Agora, a área de interesse é inspecionado com uma câmera CCD. Uma imagem CCD é coletado na 30K-80K ampliação, dependendo do tamanho da membrana, as proteínas ou o tamanho da célula unitária, ou conhecida área cristalina. A rede de uma proteína de membrana menores e / ou na maior parte hidrofóbica não é necessariamente visível pela avaliação visual da imagem CCD-se. Nem toda a imagem é usada para transformar um online-Fourier (FT, ou rápido FT-FFT). Este FT irá conter uma quantidade significativa de ruído, no entanto, se o conjunto ordenado é pequeno. Assim, um tamanho da imagem reduzida em caixa permitirá uma relação sinal-ruído melhorada de um smalLer cristal e uma identificação mais fácil. Para este fim, a caixa é movido sobre a imagem e um FT viver é avaliada.
A intensidade / brilho do feixe é ajustado mantendo baixa dose condições para a amostra, bem como as configurações da câmera CCD em mente. Dependendo da câmera CCD utilizado, a gama da FT ao vivo é ajustado para a identificação ideal de conjuntos ordenados. Um valor muito elevado podem obscurecer pontos devido às contribuições de ruído, e um valor de gama excessivamente baixos irá impedir pontos mais fracos de ser identificados. Estes pontos mais fracos pode ser devido à menor matrizes cristalinas com manchas na FT pouco acima do nível de ruído.
Embora os dados com maior resolução tiver sido coletado de um pequeno número de amostras 6, comumente a resolução de cristais negativamente coradas em 2D é limitada ou não se deve esperar para ser melhor do que a resolução aproximadamente 15A. Com um defocus de aproximadamente -400 nm, e não mais de 1-3 ordens de manchas devem ser facilmente identificados. Amostras geralmente não são avaliados para a resolução, como crio-EM coleta de dados dará uma indicação adequada de resolução mais alta possível. Nitidez de manchas e mosaicity possíveis são anotados embora.
- Membranas diferentes, assim como morfologias membrana, são avaliados para a ordem em grandes ampliações. Isto é particularmente crítico no início ou estágios intermediários de ensaios de cristalização em 2D, como proteoliposomes menores ao invés de maior ou remendos da membrana pode conter as áreas mais promissoras. Percentagens muito baixas de cristais 2D vai exigir a aquisição de imagens e FT, ou de difração óptica, de um grande número de imagens desde a identificação inicial de conjuntos ordenados, com freqüência levam a rápida melhoria do tamanho e qualidade 2,4,7.
3. Resultados representante
Proteoliposomes idealmente ordenou mostrar facilmente reconhecíveis, pontos afiados. Cristais grandes e bem ordenadas são facilmente identificados por online-FT de imagens CCD ou de difração óptica de micrografias.
O exemplo mostra cristais 2D de uma proteína de membrana de 18kDa pequenos que são até vários microns de tamanho. Manchas na FT são facilmente identificados e afiada. O movimento da caixa de live-FT mostra que a malha é contínua, sem mosaicity. A rede de uma grande proteína com um domínio mais extenso solúveis pode ser identificado na tela pequena do EM. CCD coleção de imagens e FT é necessário fornecer um meio de melhor avaliação e para obter informações sobre, mosaicity, por exemplo, possível (show FT). Ao calcular uma FT de um proteoliposome que não é imposta, o ruído pode ser inicialmente confundido com spots. Enquanto a caixa para o live-FT é movido, no entanto, as manchas desaparecerão. Por outro lado, as matrizes de pequeno porte, com cristalinidade questionável, terão suas vagas restantes estacionária quando o live-FT é movido até um pouco mais a área da imagem. Além disso, estes pequenos cristais podem ser reconhecidos por geralmente ter os tamanhos mesma célula da unidade, e as distâncias entre pontos diferentes no SFT pode ser medido de várias maneiras, como com um círculo de um tamanho específico. Cristais de lipídios exibir uma morfologia distinta e lattice FT.
Não é incomum encontrar precipitação em ensaios iniciais. Aqui precipitação de proteínas, sem a reconstituição precisa ser distinguido de agregados lipídicos pequenos embora. Amostras que parecem ser precipitados em baixa ampliação freqüentemente acabam por ser agregados de lipídios, quando visto em maior ampliação. Após a inspeção de 30-50K, as bordas dessas estruturas escuras revelam que eles são compostos de membranas, sem precipitação da proteína. Estas são observações importantes como os agregados de lipídios pode ser aumentado de tamanho grande para as membranas nos experimentos seguintes.
Maus resultados em amostras de avaliação são, por vezes ligado a uma concentração baixa de membrana que impede a triagem adequada e rápida. Isto pode frequentemente ser superado com o uso de uma maior concentração de proteína para a cristalização 2D por diálise. Alternativamente, as membranas podem ser deixados de se contentar com alguns dias na parte inferior do tubo Eppendorf durante o armazenamento. Em alguns casos, a resolução rápida, ou quase instantânea de membranas ocorre e pipetagem da parte inferior do tubo irá resultar em uma maior densidade de membrana no grid. Outra opção é muito mais rápida centrifugação (em 3000-8000 rpm durante 1-3 minutos) das amostras com amostragem posterior da parte inferior do tubo.
Amostras em condições ideais irá conter uma grande percentagem de cristais 2D. Não é necessário apontar para uma aparência homogênea das membranas, como a coleção maior e mais bem ordenada cristais 2D são selecionados visualmente para dados. Estes tipos de amostras será facilmente reconhecido quando os ensaios de cristalização são repetidos, bem como quando as amostras são utilizadas paraCryo-EM coleta de dados, resultando em um número máximo de imagens em alta resolução.
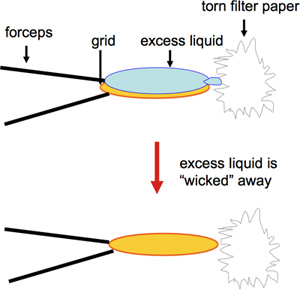
Figura 1. Esta figura mostra blotting a borda da grade com um pedaço de papel Whatman # 4 filtro.
Discussão
Avaliação adequada de amostras requer uma avaliação cuidadosa de um número suficiente de membranas. Por exemplo, amostras com tão baixo como 2% matrizes cristalinas de mais de 180 proteoliposomes imaged deu informações importantes para a otimização rápida de condições de cristalização 2D 7.
Quando a precipitação da proteína ocorre, uma grade pode ser abandonado de rastreio mais após a inspeção com pequeno aumento, embora a precipitação parcial ocasional de p...
Agradecimentos
Agradecemos aos nossos colaboradores para fornecer amostras de proteínas valiosas, que contribuíram para algumas das nossas experiências e observações métodos relacionados. Günther Schmalzing gentilmente cedido a oportunidade de FR para participar deste projeto. Barbara Armbruster, Jacob Brink e Deryck Mills são agradecidos por sua ajuda em circulação e de entrada no equipamento. O financiamento foi fornecido pelo NIH conceder HL090630.
Materiais
| Name | Company | Catalog Number | Comments |
| 400-mesh copper TEM grids coated with carbon film | |||
| forceps: regular and anti-capillary | Dumont #5 and Dumont N5AC or similar | ||
| Micropipette and pipette tips | |||
| Whatman #4 filter paper | |||
| 1% uranyl acetate | |||
| Dialysis sample to be screened for 2D crystals | |||
| Glycerol/sucrose-free dialysis buffer | Optional | ||
| JEOL-1400 transmission electron microscope (TEM) | similar 80 – 120kV TEM equipped with an Lab6 or tungsten filament and film and/or CCD cameras (Gatan Orius SC1000 and/or UltraScan1000 CCD cameras and Gatan Digitial Micrograph software package or Tietz cameras (TVIPS)) |
Referências
- Johansen, B. V. Bright field electron microscopy of biological specimens V. A low dose pre-irradiation procedure reducing beam damage. Micron. 7, 145-156 (1976).
- Schmidt-Krey, I. Electron crystallography of membrane proteins: Two-dimensional crystallization and screening by electron microscopy. Methods. 41, 417-426 (2007).
- Wang, D. N., Kühlbrandt, W. High-resolution electron crystallography of light-harvesting chlorophyll a/b-protein complex in three different media. J Mol Biol. 217, 691-699 (1991).
- Schmidt-Krey, I., Rubinstein, J. L. Electron cryomicroscopy of membrane proteins: specimen preparation for two-dimensional crystals and single particles. Micron. , (2010).
- Schmidt-Krey, I., Mutucumarana, V., Haase, W., Stafford, D. W., Kühlbrandt, W. Two-dimensional crystallization of human vitamin K-dependent γ-glutamyl carboxylase. J Struct Biol. 157, 437-442 (2007).
- Trachtenberg, S., DeRosier, D. J., Zemlin, F., Beckmann, E. Non-helical perturbations of the flagellar filament: Salmonella typhimurium SJW117 at 9.6 Å resolution. J Mol Biol. 276, 759-773 (1998).
- Zhao, G., Johnson, M. C., Schnell, J. R., Kanaoka, Y., Irikura, D., Lam, B. K., Austen, K. F., Schmidt-Krey, I. Two-dimensional crystallization conditions of human leukotriene C4 synthase requiring a particularly large combination of specific parameters. J Struct Biol. 169, 450-454 (2010).
- Cheng, A., Leung, A., Fellmann, D., Quispe, J., Suloway, C., Pulokas, J., Abeyrathne, P. D., Lam, J. S., Carragher, B., Potter, C. S. Towards automated screening of two-dimensional crystals. J Struct Biol. 160, 324-331 (2007).
- Vink, M., Derr, K. D., Love, J., Stokes, D. L., Ubarretxena-Belandia, I. A high-throughput strategy to screen 2D crystallization trials of membrane proteins. J Struct Biol. 160, 295-304 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados