Method Article
Electrosoldável célula visualizado com microscopia de fluorescência
Neste Artigo
Resumo
Neste vídeo demonstramos eletrofusão eficiente de células In vitro Por meio do método de adesão modificados utilizando eletroporação ea detecção posterior de visualização células fundidas com microscopia de fluorescência.
Resumo
Eletrofusão celular é um método seguro e não-virais e não-químicas que podem ser usados para preparar células híbridas para terapia humana. Eletrofusão consiste na aplicação de curto pulsos de alta voltagem elétrica para as células que estão em contato próximo. Aplicação de curto, pulsos de alta tensão elétrica provoca desestabilização da membrana plasmática celular. Membranas desestabilizado são mais permeáveis para moléculas diferentes e também propenso à fusão com qualquer membranas vizinhas desestabilizadas. Eletrofusão é, portanto, um método conveniente para alcançar uma fusão não-específicos de células muito diferentes
Protocolo
I. Colocação das células com Cell trackers CMFDA e CMRA
- Experimentos foram realizados em células de camundongo previamente preparado linhagem de células de melanoma (B16-F1). As células são cultivadas em dois separados 25 cm 2 frascos de cultura (TPP, ZDA) a confluência de 70-80% em meio de cultura DMEM (meio modificado Dulbecco Eagle), suplementado com 10% de soro fetal bovino, 0,15 mg / ml L-glutamina, 16 mg / ml de gentamicina (todos da Sigma-Aldrich, Alemanha), 200 unidades / ml crystacillin (Pliva, Croácia), e incubados em 5% de CO 2 a 37 ° C.
- Prepare duas soluções 10 mM estoque de trackers Cell (Invitrogen, EUA), acrescentando 10,76 mL e 9 mL (para CMFDA Verde e Laranja para CMRA, respectivamente) de DMSO (Sigma-Aldrich, Alemanha) a 50 mg do corante no original frasco Invitrogen. A solução de reserva podem ser armazenadas no frigorífico a 4 ° C por alguns meses. Antes de iniciar os experimentos, aquecer a solução até que os cristais de DMSO dissolver.
- Prepare-bicarbonato livre Krebs-Hepes tampão (130 mM NaCl, 4,7 mM KCl, 1,2 mM MgSO 4, 1,2 mM KH 2 PO 4, 11,7 mM D-glucose, 1,3 mM CaCl 2, 10 mM HEPES, pH 7,4). Em dois tubos de 15 ml Eppendorf separadamente mistura 2,1 mL de cada solução estoque (10 mM CMFDA ou CMRA, respectivamente) em 3 ml de bicarbonato de livre tampão Krebs-Hepes. Isso gera uma "solução de carga", contendo cerca de 7 mM CMFDA (ou CMRA).
- Lave as células duas vezes com bicarbonato sem tampão Krebs-Hepes e insira o carregamento soluções para os frascos. Incubar as células por 30 minutos em 5% CO 2 a 37 ° C. Durante esta primeira incubação reagentes passar livremente através das membranas celulares, mas uma vez dentro da célula, os reagentes são transformados em células impermeant produtos da reação fluorescente.
- Após a incubação em primeiro lugar, lavar e incubar as células com meio de cultura por mais duas horas em 5% CO 2 a 37 ° C.
- Trypsinize células em ambos os frascos (carregado com CMFDA e CMRA) e misturar as células vermelhas e verdes juntos em uma proporção de 1:1 em um tubo de centrífuga de 50 ml (TPP, ZDA). Ajuste a concentração de células de 5 x 10 6 células / ml por diluição com meio DMEM ou por concentração com a centrífuga. Colocar uma gota 20 l de suspensão de células em cada poço da placa de 24 com vários poços (TPP, ZDA). Incubar as células em 5% de CO 2 a 37 ° C por 20 min para permitir que um pouco anexar à superfície do poço e estabelecer contatos celular.
II. Eletrofusão
- Prepare tampão fosfato de potássio isoosomolar (10 mM KH2PO4, 10 mM K 2 HPO 4, 1mM MgCl 2, 250 mM de sacarose) e tampão fosfato de potássio hypoosmolar (10 mM KH2PO4, 10 mM K 2 HPO 4, 1mM MgCl 2, 75 mM de sacarose) .
- Coloque a vários poços com células para a posição microscópio estágio, os eletrodos no fundo do poço e conectá-los ao gerador de pulsos.
- Lavar as células com 1 ml de tampão fosfato de potássio isoosomolar. Adicionar 350 mL de tampão fosfato de potássio hypoosmolar a fim de induzir inchaço celular. O buffer deve cobrir os eletrodos.
- Deixe células em tampão hypoosmolar por 2 minutos antes da aplicação de impulsos elétricos. Durante este tempo influxo de moléculas de água dentro das células devido ao desequilíbrio osmótico entre o interior eo exterior das células causar um aumento do volume celular. Pulsos elétricos devem ser aplicados quando as células estão perto do seu volume máximo, antes de começar a regulamentar o volume diminui.
- Para alcançar eletrofusão ideal e manter a viabilidade celular, os parâmetros ideais de pulsos elétricos devem ser usados. Estes dependem de linha celular utilizada [1]. Neste experimento um trem de pulsos retangulares de 8 (cada uma com duração de 100 mS a 1 Hz) é aplicado a cada amostra, utilizando dispositivo de eletroporação (no nosso caso Cliniporator, IGEA, Itália). Os pulsos são entregues a duas paralelas eletrodos Pt / Ir fio com 0,8 mm de diâmetro e 5 mm de distância entre eles, criando um campo elétrico de aproximadamente 1200 V / cm entre os eletrodos em cada bem, exceto para o controle de poço.
- Deixam as células sem ser perturbado por 10 minutos após a entrega de pulso. Determine o rendimento de fusão por meio de microscopia de contraste fluorescente e fase.
III. Aquisição de imagem e determinação do rendimento de fusão
- As células são observados usando um microscópio de fluorescência (no nosso caso Zeiss Axiovert 200, Zeiss, Alemanha) equipado com um objetivo (x20) e uma câmera CCD refrigerado (VisiCam 1280, Visitron, Alemanha). As imagens são adquiridas em Metamorph 7.1.1 (dispositivos Molecular, EUA), mas o software de aquisição semelhante também pode ser usado. CMFDA está animado com um monocromador (Polychrome IV, Visitron, Alemanha) a 492 nm e 548 nm no CMRA. A fluorescência de CMFDA e CMRA é adquirido através de dois filtros de emissão, um centrado em 535 nm (HQ535/30m, por CMFDA) e os outros centrada em 510 nm (D605/55m, para CMRA, tanto Chroma, EUA). O uso de espelho dicróico (Q515LP) impediu a conversa entre canais.
- Adquirir três imagens (contraste de fase, fluorescência vermelha e verde) para cinco campos escolhidos aleatoriamente em cada poço. Criar três imagens de cada canal triplet imagem. Na imagem, citoplasma fluorescentes podem ser vistos em conjunto com as membranas celulares. Células fusionadas podem assim ser facilmente determinado [Figura 1].
- Contar todos os três tipos de células (vermelho, verde e duplamente fluorescente) em cada imagem do canal três. Determinar a porcentagem de células duplamente fluorescentes, dividindo o número de células duplamente fluorescentes com o número de todas as células em cada imagem. Rendimento de fusão é definida como a porcentagem de células duplamente fluorescentes multiplicado por 2 já que metade das células fundidas não são detectadas (quando as células do fusível da mesma cor).
Resultados representante
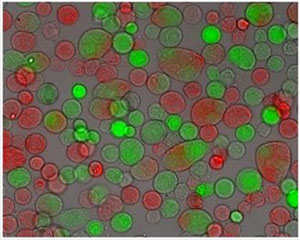
Figura 1 Três imagem de microscopia canal de B16F1 células após eletrofusão:. Contraste de fase, CMRA de fluorescência (excitação em 548 nm) e CMFDA de fluorescência (excitação a 492 nm), ampliação da objetiva 20x
Discussão
A capacidade das membranas celulares para fundir não especificamente, por exemplo, por campos elétricos externos, é importante para a medicina, biotecnologia e pesquisa em biologia. Fusão inespecíficos como permite a produção de grande valor células híbridas e seus produtos, tais como anticorpos monoclonais, e fornece informações sobre os mecanismos fundamentais de fusão [2]. Eletrofusão é um método muito eficaz, já que pode ser devidamente ajustada para diferentes tipos de células. Eletrofusão é alcançado quando as células em contato físico são trazidos para seu estado fusogenic (propenso a fusão), por meio de pulsos de alta tensão elétrica. A eficiência de eletrofusão depende de vários parâmetros que afetam duas partes do processo de eletrofusão. Primeira parte do processo de eletrofusão é realização do contato físico entre as células, que pode ser obtido com diferentes métodos [3-8]. Método de aderência (células de crescimento de confluência) pode ser usado de forma eficiente, devido aos contatos célula espontaneamente estabelecido nas zonas de grande entre as células, no entanto, produz muito grandes células com núcleos fundidos muitos. Estamos usando o método modificado adesão, onde as células mais pequenas (com 2-5 núcleos), que são mais propensos a sobreviver e proliferar, são obtidos (Figura 1). Contato entre as células também se beneficiam com inchaço osmótica das células, devido ao tratamento osmótico utilizado no experimento [9]. Segunda parte do processo de eletrofusão é a realização do Estado fusogenic das membranas celulares. Estado Fusogenic se correlaciona bem com o estado electropermeabilized da membrana (células não são especificamente permeabilizadas de moléculas que normalmente não podem passar através da membrana intacta) e é regida pelos mesmos parâmetros dos pulsos elétricos (amplitude, número, comprimento e freqüência) [10] . Os valores dos parâmetros elétricos necessários para o eletroporação ideal [1] e eletrofusão diferem entre diferentes células e dependem de células tamanho e suas propriedades biológicas. Parâmetros elétricos, portanto, precisam ser otimizadas para diferentes linhagens celulares, que são usados como parceiros de fusão, a obtenção de fusão.
Divulgações
Agradecimentos
Este trabalho foi financiado pela Agência de Pesquisa esloveno (projeto J2-9764 e um programa de P2-0249). Este vídeo representa material suplementar para o "Eletroporação baseado em Tecnologias e Tratamentos" workshop científico e pós-graduação, organizado pela Faculdade de Engenharia Elétrica da Universidade de Ljubljana, na Eslovénia.
Materiais
| Name | Company | Catalog Number | Comments | |
| CMRA | Reagent | Invitrogen | C34551 | Cytosolic fluorescent dye |
| CMFDA | Reagent | Invitrogen | C7025 | Cytosolic fluorescent dye |
| DMSO | Reagent | Sigma-Aldrich | D2650 | |
| DMEM | Reagent | Sigma-Aldrich | D5671 | Dulbecco’s modified Eagle’s medium |
| Fetal calf serum | Reagent | Sigma-Aldrich | F4135 | |
| L-glutamine | Reagent | Sigma-Aldrich | G7513 | |
| crystacillin | Reagent | Pliva | 625110 | antibiotic |
| gentamicin | Reagent | Sigma-Aldrich | G1397 | antibiotic |
| Hepes | Reagent | Sigma-Aldrich | H0887 | |
| KH2PO4 | Reagent | Merck & Co., Inc. | A124873 927 | |
| KH2PO4 | Reagent | Sigma-Aldrich | 4248 | |
| MgCl2 | Reagent | Sigma-Aldrich | M-8266 | |
| NaCl | Reagent | Fluka | 71382 | |
| KCl | Reagent | Merck & Co., Inc. | A154336 908 | |
| MgSO4 | Reagent | Sigma-Aldrich | M2643 | |
| D-glucose | Reagent | Sigma-Aldrich | G8270 | |
| CaCl2 | Reagent | Sigma-Aldrich | C4901 | |
| sucrose | Reagent | Sigma-Aldrich | 16104 | |
| Electric pulse generator | Tool | IGEA | Cliniporator VITAE | |
| Multiwell plate | Tool | Techno Plastic Products | 92424 | |
| 50 ml centrifuge tube | Tool | Techno Plastic Products | 91050 | |
| 15 ml centrifuge tube | Tool | Techno Plastic Products | 91015 | |
| 25 cm2 culture flask | Tool | Techno Plastic Products | 90026 | |
| Electrodes | Tool | Custom Made | Pt/Ir |
Referências
- Čemazar, M., Jarm, T., Miklavčič, D., Maček-Lebar, A., Ihan, A., Kopitar, N. A., Serša, G. Effect of electric-field intensity on electropermeabilization and electrosensitivity of various tumor-cell lines in vitro. Electro. Magnetobiol. 17, 263-272 (1998).
- Trontelj, K., Reberšek, M., Kandušer, M., čurin šerbec, V., Miklavčič, D. Optimization of bulk cell electrofusion in vitro for production of human-mouse heterohybridoma cells. Bioelectrochemistry. 74, 124-129 (2008).
- Rols, M. -. P., Teissié, J. Modulation of electrically induced permeabilization and fusion of Chinese hamster ovary cells by osmotic pressure. Biochemistry. 29, 4561-4567 (1990).
- Neil, G., Zimmermann, U. Electrofusion. Methods in Enzymology. 220, 174-196 .
- Abidor, I. G., Li, L. -. H., Hui, S. W. Studies of cell pellets: II. Osmotic properties, electroporation, and related phenomena: Membrane interactions. Biophysical journal. 67, 427-435 (1994).
- Jaroszeski, M. J., Gilbert, R., Fallon, P. G., Heller, R. Mechanically facilitated cell-cell electrofusion. Biophys J. 67 (4), 1574-1581 (1994).
- Ramos, C., Bonefant, D., Teissié, J. Cell hybridization by electrofusion on filters. Analytical biochemistry. 302, 213-219 (2002).
- Cao, Y., Yang, J., Yin, Z. Q. Study of high-throughput cell electrofusion in a microelectrode-array chip. Microfluid Nanofluid. 5, 669-675 (2008).
- Ušaj, M., Trontelj, M., Kandušer, M., Miklavčič, D. Cell size dynamics and viability of cells exposed to hypotonic treatment and electroporation for electrofusion optimization. Radiol. Oncol. 43, 108-119 (2009).
- Teissié, J., Ramos, C. Correlation between electric field pulse induced long-lived permeabilization and fusogenicity in cell membranes. Biophys. J. 74, 1889-1898 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados