É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fotoconversão de proteínas purificadas fluorescentes e Dual-sonda Destacando Optical em células vivas
Neste Artigo
Resumo
Este protocolo descreve uma abordagem geral para realizar fotoconversão de proteínas fluorescentes em um microscópio confocal de varredura a laser. Descrevemos os procedimentos para a fotoconversão de amostras de proteínas puried, bem como para dual-sonda destacando ópticos em células vivas com mOrange2 e Dronpa.
Resumo
Photoconvertible proteínas fluorescentes (pc-PQ) são uma classe de proteínas fluorescentes com "óptica highlighter" capacidade, o que significa que a cor da fluorescência pode ser alterada pela exposição à luz de um comprimento de onda específico. Destacando óptico não invasivo permite marcação de uma subpopulação de moléculas fluorescentes e, portanto, ideal para acompanhar uma única célula ou organelas.
Parâmetros críticos para fotoconversão eficientes são a intensidade eo tempo de exposição da luz fotoconversão. Se a intensidade é muito baixa, fotoconversão será lento ou não ocorrer. Por outro lado, a intensidade ou exposição muito muito tempo pode photobleach a proteína e, assim, reduzir a eficiência do fotoconversão.
Este protocolo descreve uma abordagem geral como configurar um microscópio laser confocal para aplicações pc-FP fotoconversão. Primeiro, vamos descrever um procedimento para a preparação de amostras de gotículas de proteína purificada. Este formato de amostra é muito conveniente para estudar o comportamento fotofísicas de proteínas fluorescentes sob o microscópio. Em segundo lugar, vamos usar o exemplo de gotículas de proteína para mostrar como configurar o microscópio para fotoconversão. E, finalmente, vamos mostrar como executar destacando óptica em células vivas, incluindo dual-sonda destacando óptica com mOrange2 e Dronpa.
Protocolo
1. Preparação de amostras de gotículas proteína fluorescente
Uma amostra de gota proteína fluorescente é constituída por uma emulsão 1-octanol/water com a proteína fluorescente que residem na fase aquosa. Esta emulsão está entre uma lâmina de microscópio e uma tampa de vidro 22 milímetros quadrados para aplicações de microscopia.
- Antes de fazer amostras de gotículas proteína fluorescente das lâminas e lamínulas de vidro devem ser limpas e revestidas com um agente hidrofóbico.
- Limpa vidros, lavando 5 minutos com acetona e deixar secar por via aérea. (Opcionalmente, após a limpeza do vidro pode ser tratada por 30 segundos em um aspirador de plasma para obter resultados de revestimento ideal).
- Prepare uma solução de 2% methyltrimethoxysilane em acetona e revestimento do material de vidro durante um minuto de incubação 2 nesta solução. Depois de remover o revestimento de vidro a partir da solução e deixar secar por via aérea. Em seguida, lavar com etanol 70% a partir de um frasco de spray e deixar secar novamente. (Opcionalmente, neste momento o vidro pode ser cozido por 1 hora a 80 ° C a ligação covalente o revestimento para o vidro). Vidro revestidas podem ser armazenados por pelo menos um mês.
- Proteínas fluorescentes são purificadas como Seu proteína 6-tag de E. Coli 1. Medir o espectro de absorção da proteína purificada e preparar uma diluição de ações com uma densidade óptica de aproximadamente 0,1 em STE tampão (150 mM NaCl, 10 mM Tris-HCl pH 8, 1 mM EDTA), contendo 0,1% de albumina bovina sérica (BSA) . Além disso preparar 10 ml de uma mistura 1:1 de buffer 1-octanol e STE em um tubo de 15 ml cônico e misture vigorosamente. Depois de deixar a mistura até que a separação de fase está concluída. A fase superior é o 1-octanol. (Atenção: 1-octanol Porque tem um cheiro forte, é importante usar um recipiente bem fechado por tudo o que entra em contato com o 1-octanol).
- Para fazer a emulsão pipeta 45 mL 1-octanol e 5 mL de proteínas fluorescentes em um tubo de microcentrífuga. Toque no tubo algumas vezes com o dedo para começar a formação da emulsão e, em seguida, sonicate o tubo por 30 segundos em um banho de sonicação. Entretanto obter uma lâmina de microscópio revestidas e tampa de vidro pronto. Após sonicação a emulsão deve ser completamente nublado. Imediatamente após sonicação pipeta 4 mL de emulsão a partir do meio do tubo em uma lâmina de microscópio revestidas e cubra com uma tampa de vidro revestido.
- Se o procedimento for feito corretamente a emulsão deve equitativamente distribuída entre a lâmina de microscópio e do vidro objeto. Dentro de minutos, a amostra deve ser estável, consistindo de ~ 10 mm de espessura gotículas fluorescentes com diferentes diâmetro. O maior gotas são perto do centro da amostra e os menores estão localizadas mais para as bordas.
2. Criação de um experimento fotoconversão
O procedimento a seguir é uma estratégia geral para a criação de um experimento fotoconversão proteína fluorescente. Este procedimento pode ser aplicado para proteínas purificadas, bem como para as células vivas.
- Os parâmetros a seguir fornecem um ponto geral de partida para criar sua experiência fotoconversão:
Objetiva de imersão 40x 1.3NA petróleo
= Tamanho da imagem 512 x 512 pixels
Varredura zoom = 4
Pixel tempo de permanência = ms 6.
Z-resolução (tamanho pinhole) = 3 mm - Configure dois canais de detecção para a fluorescência inicial e photoconverted, bem como um "canal fotoconversão". Neste exemplo, usaremos purificada mOrange2 proteína, que é um laranja-vermelho proteína fluorescente photoconvertible. As espécies de laranja é detectada através de 561 nm de excitação ea fluorescência é coletada entre 570 nm e 630 nm. As espécies photoconverted vermelho é detectada através de 633 nm de excitação ea fluorescência é coletada entre 640 nm e 700 nm. Para o "canal fotoconversão" select 488 nm de excitação e de fluorescência coletar entre 490 nm e 540 nm. (Nota:. Canais a imagem fotoconversão não é estritamente necessário)
- Use o canal para a imagem latente da fluorescência inicial com a digitalização contínua para ajustar a potência do laser e ganhar detector de qualidade de imagem ideal.
- Ativar o canal fotoconversão e selecione uma potência do laser de baixa. Iniciar uma série de imagens de lapso de tempo e aumentar gradualmente até que o laser fotoconversão significativos de branqueamento da fluorescência inicial é observado. Continuar a digitalizar até a fluorescência inicial é de aproximadamente 75% branqueada.
- Desactivar o canal fotoconversão e ativar o canal de detecção para a fluorescência photoconverted. Iniciar um ganho de imagem com detector de altura e potência do laser de baixa e aumentar gradualmente a potência do laser até a fluorescência photoconverted é detectado. Uma vez que você detectar a fluorescência photoconverted você pode ajustar a potência do laser e ganhar detector de qualidade de imagem ideal.
- Finalmente, a potência do laser utilizadopara fotoconversão, bem como a duração do fotoconversão precisam ser otimizados. Aumentando a potência do laser fotoconversão vai acelerar a taxa de fotoconversão, potência do laser no entanto muito vai photobleach a proteína.
- Uma vez que a potência do laser ideal fotoconversão e duração foram determinados, estes parâmetros podem ser usados para configurar um padrão fotobranqueamento ou módulo FRAP e do "canal fotoconversão" não é mais necessário.
3. Dual-sonda destacando óptica com mOrange2 e Dronpa
Por causa do vermelho-deslocado propriedades espectrais, mOrange2 pode ser usado em combinação com a proteína verde Dronpa photoswitchable fluorescentes para dual-sonda destacando óptico para permitir destacando seletiva de 4 células individuais (organela) populações.
- As células são cultivadas em placas de vidro de fundo Mattek e transfectadas 24 horas antes da imagem utilizando transfecção Lipofectamine2000 padrão 1.
- Configure o microscópio para mOrange2 fotoconversão como descrito na seção 2.
- Configure o microscópio para photoswitching Dronpa. Dronpa fluorescência pode ser fotografada usando o "canal fotoconversão" mOrange2 (ver passo 2.2). (Nota: Minimize a potência do laser usado para imagens Dronpa, porque o poder do laser demais fará com que a inativação de Dronpa.) Adicione um canal para a fotoativação Dronpa. Usamos 800 nm de dois fótons de excitação para fotoativação, mas esta alternativa pode ser conseguido usando excitação 405 nm. Determine a potência do laser necessária para imagem, fotoativação, e photoinactivation Dronpa de fluorescência.
- Atenção: fotoconversão de mOrange2 e inativação de ambas as Dronpa ocorrer após excitação 488 nm. Devido à potência do laser de alta exigido para mOrange2 fotoconversão isso também inativar Dronpa fluorescência. Por outro lado, a inativação Dronpa ocorre já na potência do laser muito mais baixo e pode ser realizada sem fotoconversão mOrange2 significativa.
- Uma vez que os parâmetros para mOrange2 fotoconversão e photoswitching Dronpa são definidas, destacando sonda dupla óptica é conseguido através dos seguintes passos. Primeiro, inativar Dronpa fluorescência em todo o campo de visão com baixo poder de excitação nm 488. Em segundo lugar, selecione uma região de interesse e mOrange2 photoconvert com alto poder de excitação nm 488. Finalmente, selecione uma região de interesse para ativar Dronpa fluorescência.
4. Resultados representante
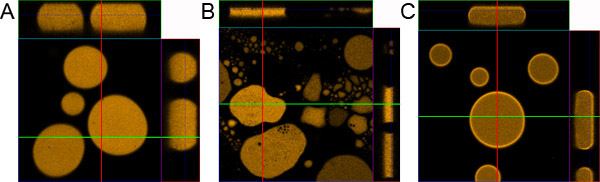
Figura 1. Gota a preparação da amostra. A) amostra gota corretamente preparado. B) Amostra preparada sem revestimento da lâmina de microscópio e tampa de vidro. C) Amostra preparado sem adição de BSA de 0,1%.
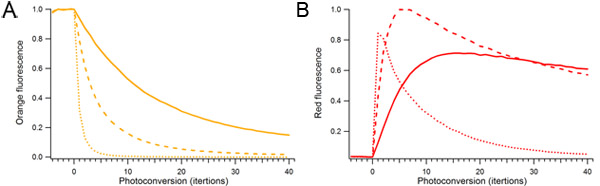
Figura 2. Efeito do poder fotoconversão laser e duração de mOrange2 fotoconversão. Gotículas contendo Único mOrange2 proteína foram continuamente photoconverted usando diferentes quantidades de potência do laser 488 nm. Potência do laser usado para fotoconversão relativa foi de 10% (sólido), 25% (tracejada), e 100% (pontilhada). A) as espécies de laranja fluorescente. B) Photoconverted vermelho espécies fluorescentes.
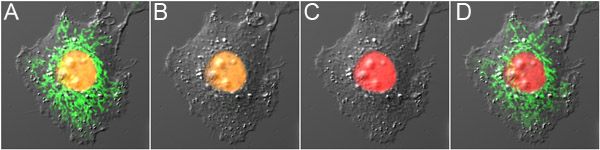
Figura 3. Dual-sonda destacando óptica com mOrange2 e Dronpa. A Cell) expressando mOrange2-histona H2B e Dronpa-Mito antes fotoconversão, mostrando fluorescência laranja no núcleo e fluorescência verde na mitocôndria. B) Dronpa fluorescência foi desligado com baixo poder de excitação nm 488, causando fotoconversão mínimo de mOrange2. C) mOrange2 foi photoconverted para vermelho com alto poder de excitação nm 488. D) Dronpa fluorescência foi ligado novamente usando 800 nm 2 photon-excitação. Os painéis são superposições de imagens de fluorescência, juntamente com a imagem de contraste de interferência diferencial.
Discussão
A amostra purificada gota proteína fluorescente é um formato de amostra muito conveniente para a caracterização fotofísicas de proteínas fluorescentes, por exemplo para estudar fotobranqueamento cinética e cinética fotoconversão. O volume de gotículas extremamente pequenas (~ 20 picolitros) facilita a fotodegradação e experimentos fotoconversão, que pode ser difícil de executar em sistemas baseados cuvete. Além disso, como mostrado aqui a amostra de gota é ideal para a criação de um microscópio confoc...
Divulgações
Agradecimentos
Agradecemos a Mike W. Davidson (Florida State University) para a prestação de DNA plasmídeo que codificam proteínas fluorescentes. Este trabalho foi financiado pelo National Institutes of Health conceder GM72048 (para DWP).
Materiais
| Name | Company | Catalog Number | Comments |
| Microsope slides | VWR international | 48312-003 | |
| 22 mm cover glass | Corning | 2940-245 | |
| 1-octanol | Sigma-Aldrich | O4500 | |
| methyltrimethoxysilane | Sigma-Aldrich | M6420 | |
| MatTek dishes | MatTek Corp. | P35G-1.5-14-C | |
| Lipofectamine2000 | Invitrogen | 11668-019 |
Referências
- Kremers, G. J., Hazelwood, K. L., Murphy, C. S., Davidson, M. W., Piston, D. W. Photoconversion in orange and red fluorescent proteins. Nature Methods. 6, 355-358 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados