É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microdissecção de tecidos oculares Zebrafish embrionárias
Neste Artigo
Resumo
Este artigo descreve uma abordagem para microdissect retinas zebrafish com e sem epitélio pigmentar da retina em anexo, 1-3 embriões dia postfertilization.
Resumo
Peixe-zebra é um modelo animal popular para a pesquisa sobre o desenvolvimento do olho por causa de sua rápida
Protocolo
Parte 1: Preparativos antes microdissecção
- Soluções
- E3 média 4 (5 mM NaCl, 0,17 mM KCl, 0,33 mM CaCl 2 e 0,33 mM MgSO 4).
- Solução de Ringer com 1, 5 (116 mM NaCl, 2,9 mM KCl, 1,8 mM CaCl 2, 5 mM HEPES, pH7.2), esterilizado por filtração.
- 5N NaOH.
- Ataque químico de agulhas de tungstênio
- Garantir um pequeno copo contendo NaOH 5N sobre uma placa de Petri por argila.
- Anexar um clipe de papel no lado do copo, para que ele entra em contato com a solução de NaOH.
- Conecte o eletrodo negativo de uma fonte de alimentação DC para o clipe de papel eo eletrodo positivo para uma extremidade de uma peça curta (~ 2 cm) de fio de tungstênio.
- Enrole a outra ponta do fio de tungstênio com uma bola de barro e mergulhe esse fim na solução de NaOH.
- Aumentar a tensão para cerca de 3V e mergulhe o fio para cima e para baixo na solução de NaOH até uma taxa de ataque bom é atingido. Uma agulha de boa qualidade geralmente pode ser gravado em 10 minutos.
- O fio de tungstênio expostos à solução se tornará gradualmente mais fino. Quando a bola de barro cai, o outro lado do fio que ainda está ligado ao eletrodo positivo terá uma forma agulha fina.
- Lavar a agulha fina com solução de Ringer ou E3 para remover os depósitos de sal.
- Coloque a agulha para um aplicador de madeira por fita ou um suporte de agulha para fácil manuseio.
- Placas de cultura
- O Falcon 60 x 15 mm placas de cultura de poliestireno está pronto para uso para microdissecção da retina.
- Para dissecar RPE ligado à retina, esmagar dois embriões completamente em uma placa de cultura contendo solução de Ringer para se livrar da adesividade da superfície de 30 minutos antes da dissecção. Pouco antes de dissecação, lavar a placa com solução de Ringer extensivamente fresco é.
- Embriões de coleta e preparo
- Peixe-zebra adulto são mantidas como descrito 4, 5.
- Separar os peixes do pai em tanques de criação estática pairwise por um divisor na noite anterior de reprodução.
- Remover o divisor após a luz da sala está ligada na manhã seguinte. Permitir que os pais a cruz em intervalos de 10 minutos a cada meia hora. Separar os peixes depois de cada cruzamento.
- Manter os embriões coletados de cada cruzamento em meio E3 separadamente a 28 ° C.
- Embriões em estágio de 10 a 12 horas após a fertilização (HPF) e resgatá imediatamente antes da dissecação nos pontos de tempo específico, de acordo com critérios estabelecidos 1, 6.
Parte 2: Dissecção - remoção de cérebro e exposição do olho 1
- Os procedimentos descritos nesta seção são comuns para dissecar retina (parte 3A) e RPE ligado à retina (Parte 3B).
- Todos dissecações fina são feitas por uma ponta da pinça Dumont e assistido por um outro par de fórceps Dumont para o posicionamento do tecido. Uma agulha de tungstênio quimicamente gravadas podem ser usadas para manipulações mais fino, se necessário.
- Todos dissecações finas são realizados em ampliação ~ 5-8x sob um microscópio Olympus SZX16 equipado com um objetivo 1X ou equivalente.
- Manter os embriões em meio E3 em uma bancada incubadora a 28 ° C ao lado do microscópio para o acesso fácil embrião durante a dissecção.
- O estágio do microscópio é aquecida a 28 ° C por uma placa térmica para minimizar a influência da flutuação da temperatura na expressão gênica.
- Transferência de um embrião em um estágio específico do desenvolvimento de solução de Ringer em um Falcon 60 X 15 milímetros placa de cultura preparado como descrito na Parte 1 # 3.
- Cortar a cabeça com a parte anterior do tronco rapidamente a partir do corpo.
- Pinos na extremidade posterior deste tecido na placa de cultura com a pinça auxiliar.
- Abra a cabeça no lado dorsal a partir da testa anterior.
- Remover o cérebro de modo que o lado medial dos olhos está exposta e é voltada para cima para manipulações mais.
3A parte: dissecção da retina 1
- Prepare o embrião, como descrito na Parte 2.
- Cuidadosamente a escova RPE expostos no lado medial do globo ocular que é voltada para cima pela ponta da pinça até que uma pequena abertura para a retina é visto.
- Continue a escovação e peeling de ação até que o lado medial da retina é quase todo exposto. Evitar arranhões e socos na retina exposta.
- Para remover o RPE lateral na retina que agora está voltado para baixo, a abordagem que e escova em um ângulo de aproximadamente 45 ° a partir da superfície da placa de cultura.
- Remover o RPE que é anexado relativamente firmemente à ora serrata fixando a parte destacada do RPE ao cplaca ULTURA para dissecção, e levante a retina suavemente.
- Rolar a retina no fundo do prato de cultura para limpar o RPE residual.
- Percebemos que neste particular Falcon placa de cultura de poliestireno tem uma aderência preferencial de RPE por aproximadamente 20 minutos uma vez que um embrião é esmagado. Esta propriedade é utilizada para a remoção de restos RPE. No entanto, as células da retina se ater à superfície, em menor grau, o que pode ser inspecionado de perto sob alta ampliação. Um tem que encontrar um equilíbrio entre a integralidade da remoção do RPE e integridade da retina.
- A lente geralmente adere à placa de cultura e se separa do retina durante o processo de laminação. Ocasionalmente, é necessário destacar a lente por uma agulha de tungstênio gravado com uma ação de roda na superfície da lente.
- Estes procedimentos podem remover com êxito o EPR da retina sem comprometer a integridade do tecido. Isto é indicado por uma boa morfologia geral (Figura 1B e B ') e histologia (Figura 1B "), a flecha, em particular, a preservação da matriz extracelular entre a camada de fotorreceptores ea RPE é excepcionalmente bom (Figura 1B."; comparar com a histologia do embrião inteiro (Figura 1A ")).
3B parte: RPE ligado à dissecção da retina 3
- Prepare o embrião, como descrito na Parte 2.
- Pin da cabeça até a placa de cultura pela forceps assistente. Levante os olhos suavemente do lado lateral posterior e rolar para o lado anterior.
- A coróide presuntivo e tecido escleral do lado de fora da camada de RPE estão ligados relativamente bem para a pele e pode ser na maior parte descascada rolando o olho com atenção para o lado anterior.
- Remova a lente com uma agulha de tungstênio após a lateral do olho é exposta e quando o olho ainda está ligado à pele.
- Estes procedimentos podem com sucesso preservar a camada RPE inteiro com a retina. Coróide presuntivo e tecido escleral pode ser em grande parte removido (Figura 1C, C 'e C ").
Parte 4: coleta de amostra de tecido para o trabalho RNA
- As amostras dissecados podem ser coletados em TRIzol em um tubo de microcentrífuga RNase-free para jusante caracterização RNA como descrito anteriormente 1.
Resultados representante
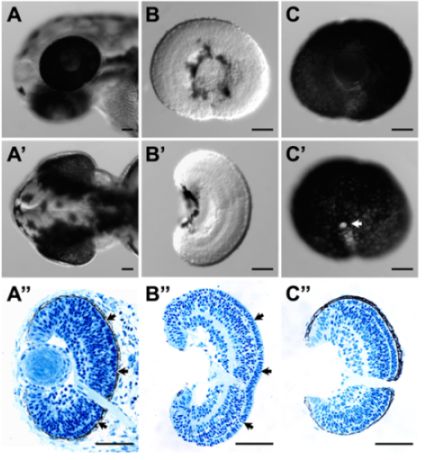
Figura 1. (A) e lateral (A) vista dorsal de uma cabeça de peixe-zebra larval em 52 hpf antes da dissecção. (A ") A seção correspondente histológica da cabeça larval em (A) e (A '). (B) e lateral (B) vista dorsal de uma retina dissecados aos 54 hpf. A superfície da retina estava intacto de ambos os laterais e vista dorsal. (B ") A seção correspondente histológica da retina dissecada em (B) e (B '). A estrutura da retina e laminação da retina estava intacto. Em particular, a matriz extracelular entre a camada de fotorreceptores e EPR (A ", setas) foi bem preservada na retina dissecados (B", setas). (C) e Lateral (C ') vista medial de um dissecados retina RPE-anexado aos 52 hpf. RPE camada estava intacta e contínua, que também foi indicada pela secção histológica do tecido dissecado (C "). A área branca no C 'é o nervo óptico (seta). Para histologia, amostras de tecidos foram coletados e fixados em 4% paraformaldeído. plástico incorporação e secção das amostras foram realizados conforme descrito 3. barra de escala = 50 mm.
Discussão
Microdissecção de tecidos oculares zebrafish pode efetivamente obter retinas intactas e RPE-anexado retinas. Este auxilia substancialmente estudos de expressão que pertencem a um tecido ocular específico (ie retina ou RPE). Na verdade, temos utilizado com sucesso destes procedimentos para obter perfis de expressão de RNA de toda a retina 1 e RPE 3. A utilidade destes perfis é fortemente apoiado pelos nossos recente identificação de vias e famílias de genes que são perturbados em uma difer...
Divulgações
Agradecimentos
Este trabalho é suportado por um fundo de arranque do Departamento de Ciências Biológicas da Universidade Purdue.
Materiais
| Name | Company | Catalog Number | Comments |
| Cordless pestle motor | VWR international | 47747-370 | |
| DC power supply | Lascar | PSU130 | Any DC supply would work. The specific voltage of a different machine will need further optimization. |
| Disposable pestle & microtube, 1.5 mL (DNase, RNase and pyrogen-free) | VWR international | 47747-366 | These are used for tissue collection in TRIzol for expression analysis. |
| Dumont #5 forceps, Tips: 0.05 x 0.01mm, Inox | World Precision Instruments, Inc. | 500341 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Dumont #5SF forceps, Tips: 0.025 x 0.005mm, Inox | Fine Science Tools | 11252-00 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Falcon polystyrene culture plates, 60 X 15 mm | BD Biosciences | 351007 | These plates are used as dissection plates. |
| Olympus SZX16 Stereomicroscope | Olympus Corporation | SZX16 | Any stereomicroscope would work. We used Leica stereomicroscope in previous studies1-3 without any issues. We also use the 1X objective exclusively for the dissection even though we have a 2X objective installed. |
| Sharpening stone | Fine Science Tools | 29008-01 | Use this to sharpen the tip of the forceps if necessary |
| Thermo plate | Tokai Hit | MATS-U55SZX2B | This is used to maintain the temperature of the tissue throughout dissection and minimize the influence of temperature fluctuation on gene expression. We also put the whole microscope in an environmentally controlled room at 28°C during dissection in previous studies1-3 with good success. |
| Trizol, 100 mL | Invitrogen | 15596-026 | |
| tungsten wire, 0.015 inch diameter | World Precision Instruments, Inc. | TGW1510 | |
| Wooden Applicator | Puritan | 807 | This is used for holding the chemically-etched tungsten needle. |
Referências
- Leung, Y. F., Dowling, J. E. Gene expression profiling of zebrafish embryonic retina. Zebrafish. 2, 269-283 (2005).
- Leung, Y. F., Ma, P., Link, B. A., Dowling, J. E. Factorial microarray analysis of zebrafish retinal development. Proc Natl Acad Sci U S A. 105, 12909-12914 (2008).
- Leung, Y. F., Ma, P., Dowling, J. E. Gene expression profiling of zebrafish embryonic retinal pigment epithelium in vivo. Invest Ophthalmol Vis Sci. 48, 881-890 (2007).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish : a practical approach. , (2002).
- Westerfield, M. The zebrafish book : a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203, 253-310 (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. Prog Retin Eye Res. 27, 89-110 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados