Method Article
Visualização e Quantificação de Interações intracelulares de Neisseria meningitidis Humanos e α-actinina por Imagem Confocal
Neste Artigo
Resumo
Neisseria meningitidis (Nm), um patógeno respiratório gram negativas humana específica, pode ligar para a saúde humana α-actinina. Aqui apresentamos um protocolo para visualização de colocalisation da bactéria intracelular com α-actinina após a entrada de bactérias em células do cérebro humano microvascular endotelial (HBMECs).
Resumo
A proteína Opc de Neisseria meningitidis (Nm, meningococo) é uma superfície expressa proteína integral de membrana externa, que pode atuar como uma adesina e um invasin eficaz para células epiteliais e endoteliais. Nós identificamos endotelial superfície localizada integrinas como receptores principais para OPC, um processo que requer Opc para ligar primeiro a ligantes de integrinas tais como vitronectina e através destes para a célula-expressa receptores 1. Este processo leva à invasão bacteriana de células endoteliais 2. Mais recentemente, observou-se uma interação de Opc com uma proteína encontrada em 100kDa lisados de células inteiras de células humanas 3. Inicialmente observou essa interação quando as proteínas da célula hospedeira separados por eletroforese e apagou para nitrocelulose eram revestidas com Opc-expressando Nm. A interação foi direta e não envolvem moléculas intermediárias. Por espectrometria de massa, nós estabelecemos a identidade da proteína como α-actinina. Como nenhuma superfície expressa α-actinina foi encontrado em qualquer uma das oito linhas de células examinadas, e como interações Opc com células endoteliais na presença de chumbo sérico para a entrada de bactérias para dentro das células alvo, examinamos a possibilidade de as duas proteínas interagem intracelularmente. Para isso, cultivadas cérebro humano células endoteliais microvasculares (HBMECs) estavam infectados com Opc-expressando Nm por longos períodos e os locais de bactérias internalizadas e α-actinina foram examinados por microscopia confocal. Observou-se dependente do tempo de aumento de colocalisation Nm com a proteína do citoesqueleto, que foi considerável após um período de oito horas de internalização bacteriana. Além disso, o uso de software de imagem quantitativa permitiu-nos obter uma medida relativa da colocalisation de Nm com α-actinina e outras proteínas do citoesqueleto. Aqui apresentamos um protocolo para visualização e quantificação do colocalisation da bactéria com proteínas intracelulares após a entrada de bactérias em células endoteliais humanas, embora o procedimento também é aplicável a células epiteliais humanas.
Protocolo
1. Imunofluorescência Protocolo
Infecção semeadura, e coloração imuno-
Os procedimentos a seguir exigem de segurança adequado nível de cultura de tecidos e instalações de laboratório de microbiologia.
DIA 1
A. Preparação de células-alvo para a infecção
- HBMECs semente na confluência de 50% (~ 1.5x10 4 células / cm 2) em lamínulas (16 mm de diâmetro) colocados em uma placa de 12 poços (3,8 centímetros área de crescimento de 2 / poço).
Meio de crescimento: RPMI 1640 suplementado com inativado pelo calor de 15% (56 ° C, 30min) FBS, 2 mM de glutamina, piruvato de sódio 1 mM, 100 U / mL de penicilina / estreptomicina, 1% (v / v) MEM aminoácidos não essenciais ácidos solução e 1% MEM solução vitaminas. - Cultura durante a noite (O / N) a 37 ° C, em 5% incubadora de CO 2.
B. cultura bacteriana
- Crescer a tensão de interesse S / N (16-18 h) no meio de infusão por exemplo, necessários Brain Heart (BHI) placas de ágar suplementado com sangue de cavalo de 10% aquecida a 37 ° C em atmosfera de 5% CO 2 4.
DIA 2
A. Preparação da suspensão (N. meningitidis) bacteriana
- Usando um loop cultura de 10 L, fazer uma suspensão da cultura durante a noite bacteriana em 2 mL PBSB (PBS com cálcio e magnésio).
- Permitir grandes agregados bacterianos para resolver deixando a suspensão em repouso por 5 min à temperatura ambiente (RT).
- Sem perturbar o sedimento, transferir o top 1 mL da suspensão (stock inóculo) em um tubo estéril.
- Para calcular o número de bactérias no inóculo de ações, adicionar alíquotas (20-50 mL) para tubos contendo 1mL de volumes SDS 1% em NaOH 0,1 M e misture suavemente para solubilizar.
- Medir o teor de ácidos nucleicos da solução através da determinação da absorbância a 260nm (A260). Em nossas mãos, A260 de 1 corresponde a 5x10 8 unidades formadoras de colônias / ml (ufc / mL). Isto pode ser verificado através da preparação de uma série de diluições do inóculo de ações em PBSB, chapeamento de fora em placas de ágar e contando colônias após S / N incubação.
- Diluir uma alíquota do inóculo ações no meio infecção [(M199 suplementado com 2% decomplemented (56 ° C, 30min) normal de soro humano (NHS)] para obter a densidade requerida bacteriana na infecção de células-alvo.
- Em nosso laboratório, uma relação de infecção de 200-300 bactérias por célula-alvo é utilizada rotineiramente.
B. Infecção Cultura de Células
- Lavar as lamelas com células-alvo cultivadas 3 vezes com meio de Hank para remover qualquer traço de antibióticos.
- Infectar as células com preparada suspensões bacterianas (descrito acima) por 3 horas a 8 horas a 37 ° C, em 5% CO 2.
- No final do período de infecção, lave as células três vezes com PBS e fixar em 500 mL de paraformaldeído a 2% (PFA) por 30-45 min em temperatura ambiente ou O / N a 4 ° C.
- Fixação paraformaldeído na concentração e tempo mostrado acima foi considerada adequada para a preservação da morfologia bacteriana e celular.
- Após a lavagem off paraformaldeído, permeabilise as células paraformaldeído fixa, incubando em 0,1% Triton X-100 diluído em PBS por 10 min.
- Lavar as amostras 3 vezes com PBS.
- Proceder à coloração imuno-ou, alternativamente, deixar amostras em 500 mL de 1% BSA / PBST O / N a 4 ° C.
DIA 3
Imuno-coloração
Coloração de bactérias intracelulares e α-actinina podem ser realizadas sequencialmente ou simultaneamente com o uso de apropriados anticorpos primário e secundário como se segue; todos os procedimentos podem ser realizados em 12-lamelas.
- Bloquear a lamínulas contendo as células permeabilised com 500 mL de 3% BSA / PBST (PBS contendo 0,05% Triton X-100) por 30-60 min em temperatura ambiente
- Após a lavagem com PBS, a transferência de cada lamela de um novo poço seco na placa de 12 poços.
- Adicionar os anticorpos primários contra bactérias e α-actinina; oitenta a 100 mL de anticorpos por lamela é suficiente se adicionado cuidadosamente para cobrir a superfície da lamela. Incubar por 1h em temperatura ambiente.
- Usamos anti-soro de coelho policlonais contra Neisseria meningitidis (laboratório-raise) e anticorpo monoclonal (mAb) contra α-actinina (Abcam) simultaneamente. Em alguns experimentos, no lugar do anti α-actinina, mAbs contra actina ou vimentina foram utilizados (Sigma).
- No final da incubação, adicionar 200 mL de PBS para o bem, levante a lamela e colocar em um novo poço de PBS contendo 500 mL.
- Após 5 min, retire PBS por pipetagem e adicione PBS fresco. Repita duas vezes. Transferência de lamínulas para umpoço seco novo.
- Adicionar os anticorpos adequados secundário conjugado com fluorocromos diferentes diluído em BSA 1% / PBST; incubar a RT por 1h no escuro.
- Para a detecção bacteriana, utilizou-se anti-Ig de coelho conjugada à TRITC e para a detecção da proteína α-actinina e outros do citoesqueleto, usamos anti-rato conjugado com ou Ig FITC (Sigma) ou Alexa Fluor 488 - (Invitrogen).
- No final da incubação, lavar como nos passos 4 e 5.
- Contra mancha com 0,6 mg / mL em PBS DAPI (DNA da mancha) por 5 min à temperatura ambiente no escuro.
- Lavar com PBS.
- Monte lamínulas (células virada para baixo) em lâminas com uma gota de meio de montagem (e, g. Mowiol ou Vectashield)
- Loja no escuro a 4 ° C.
- As amostras estão prontas para a observação ao microscópio.
2. Microscopia Confocal Scanning Laser (CLSM)
Para observar e captar imagens de bactérias intracelulares e elementos do citoesqueleto, nós usamos amostras immunolabelled e imagens captadas com uma Leica SP5-AOBS microscópio laser confocal anexado a uma Leica DM i6000 microscópio invertido de epifluorescência. Todas as imagens foram coletadas utilizando um 63x NA 1,4 objetivo de imersão em óleo e processar com o software Leica.
CLSM procedimento:
- Para iniciar o procedimento CLSM, adicione uma gota de óleo de imersão para o objectivo e colocar a lâmina da amostra, lamela voltada para baixo, no palco microscópio.
- Definir o microscópio para um modo visual e encontrar a área de interesse usando as peças olhos do microscópio.
- Usando o software Leica, selecione o modo de aquisição xyz.
- Selecione o formato de 512 x 512 (tamanho do quadro). Para estudos colocalisation, maior a resolução, mais precisa a imagem, tendo presente o limite de resolução do microscópio. Em seguida, selecione o modo bidirecional X, que irá aumentar a velocidade de digitalização e ajudar a reduzir a foto-branqueamento.
- Configurar seqüencial configurações de digitalização. Clique em "seq" função e escolher um dos modos de digitalização. Usamos "entre linhas" mode.
- Selecione a laser vigas de acordo com os fluorocromos conjugado com os anticorpos secundários: 405 nm para o DAPI (azul), 488 nm para Alexa Fluor 488 (verde) e 561 nm para TRITC (vermelho). Ativar tubo fotomultiplicador (PMT) 1, 2 e 3, respectivamente. Ajustar as configurações de PMT para detectar o comprimento de onda de emissão correta.
- Configurar superior ("begin") e inferior ("end") de z-stacks ou série. Em seguida, defina a necessária "tamanho z-passo".
- Neisseria meningitidis é um diplococos (Figura 1G) e uma vez que cada coccus tem um diâmetro aproximado de 0,5 m, o tamanho do z-passo de 0,20 mM foi escolhido para aumentar a probabilidade de digitalização de cada coccus pelo menos duas vezes. Ele também está dentro do tamanho do passo para a melhor resolução de 0,1 - 0,2 mm.
- Definir os parâmetros de digitalização final, selecionando uma média de linha de 3 para melhorar a relação sinal-ruído.
- Ao clicar em "start" imagens duplas ou triplas manchadas são obtidos através de varredura seqüencial em comprimentos de onda diferentes para eliminar cross-talk entre cromóforos diferentes.
- Para uma indicação de colocalisation de dois fluorocromos, selecione a opção "overlay" função de mesclar canais selecionados em uma única imagem, por exemplo, quando ambos Alexa 488 (verde) e TRITC (vermelho) fluorocromos colocalise, cor amarela irá aparecer na imagem sobreposta .
- Compile z-pilhas ou séries com o "máximo de projeção" função para a construção de uma imagem 2D necessária para visualizar colocalisation possível. Análise mais detalhada da colocalisation podem ser obtidas através da análise de cada seção óptica.
- Depois de adquirir o z-pilhas ou séries, processar os seus dados para obter uma imagem ortogonais para visualização da localização intracelular de vários elementos (Figura 1E).
3. Quantificação de Colocalisation
Análises estatísticas das imagens microscópio de varredura confocal são realizados com software Volocity (Improvisação, PerkinElmer). Este software fornece uma ferramenta desenhada especificamente para a análise colocalisation como descrito por Manders et al. (1993) 5. Colocalisation no contexto de imagens de fluorescência digital pode ser descrito como a detecção de um sinal no mesmo voxel (volume pixel) local em cada canal. Os dois canais são formados por imagens de dois fluorocromos diferentes tomadas da área de mesma amostra (guia do usuário Volocity). Análises estatísticas são realizados com software Volocity (Improvisação, PerkinElmer), utilizando análise quantitativa Colocalisation descrito abaixo.
Análise quantitativa Colocalisation
- Criar uma biblioteca com imagens CLSM usando software Volocity.
- Selecione "foco ampliado" a partir da imagem na barra superior. Esta ferramenta irá compilar z-pilhas em uma imagem 2D a ser analisado.
- Selecione "co-localização" ferramenta. Os dois canais a serem analisados devem ter a mesma profundidade de cor.
- Selecione a área que vai ser quantificados. Definir o limite para remover qualquer fundo.
- Criar a saída colocalisation selecionando "gerar co-localização". Colocalisation estatísticas são geradas para as regiões de interesse selecionadas anteriormente.
- Coeficientes Manders selecionar 'R (coeficiente de sobreposição) e My (coeficiente colocalisation).
- Coeficientes Manders "não são sensíveis à intensidade da coloração como eles são normalizados contra a intensidade total de pixels, assim eles podem ser empregados quando a coloração de um antígeno é mais forte que o outro.
- Sobreposição R coeficiente de acordo com Manders 5,6 representa o verdadeiro grau de colocalisation, ou seja, o número de pixels que colocalise comparado com o número total de pixels.
- Por outro lado, o coeficiente colocalisation, My, descreve a contribuição de fluorescência da fracção mais abundante (neste caso, α-actinina, verde) para a fracção menos abundante (neste caso, as bactérias, vermelho), ou seja, o número de pixels vermelhos que se sobrepõem com pixels verde em comparação com o número total de pixels vermelhos.
- Coeficientes Manders "variam entre 1 e 0, sendo 1 colocalisation alto, 0 não sendo, mas que pode ser expresso como porcentagem para facilitar a interpretação.
- Os valores das exportações estatísticas para um documento Excel para apresentação de dados.
4. Resultados representante
Localização intracelular de Opc-expressando Neisseria meningitidis e α-actinina
Imagem confocal de cérebro humano microvascular células endoteliais infectadas com Nm para 3 e 8 horas, como descrito acima colocalisation indicado de α-actinina e Nm que parecia ser menos frequentes em 3 experimentos infecção h (não mostrado), em comparação com as culturas infectadas por 8 h ( Figura 1 AF). A colocalisation demonstrável de α-actinina com Opc-expressando meningococos foi observado cada vez em> 5 experimentos replicar. Análise estatística dos colocalisation usando várias imagens confocal foi realizada como descrito acima. No geral, em HBMEC infectados com Opc-expressando meningococos,> sobreposição de 25% do verde (α-actinina) e (Nm) pixels vermelhos foi obtido (Figura 2B, Overlap coeficiente R). Em contraste com a α-actinina, experimentos em que a rotulagem de bactérias internalizadas e quer actina ou vimentina foi realizada, colocalisation ocasional foi observado com a actina, mas que com vimentina foi rara (Figura. 2B).
Os dados também foram analisados através do coeficiente de My, que leva em conta a abundância relativa de cada fracção. Minha é uma medida da frequência de ocorrência do sinal mais abundante (neste caso verde, α-actinina) cada vez que o sinal de menos abundante (neste caso vermelho, bactérias) ocorre. Esta medida mostra um nível impressionante de ocorrência de α-actinina nas imediações do meningococos internalizada (Figura 2A e C).
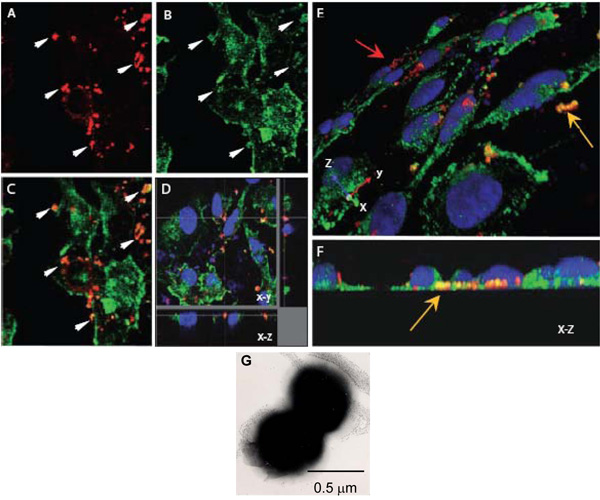
Figura 1. Microscopia confocal a laser para avaliar as interações intracelulares de N. meningitidis com α-actinina. AH. Monocamadas confluentes endoteliais cultivadas em lamínulas foram infectadas com o Opc-expressar (AF) N. meningitidis. Após 8 h, não aderente bactérias foram lavados, células fixas com paraformaldeído e permeabilised com 0,1% Triton X-100. Posteriormente, as bactérias e α-actinina foram coradas como descrito acima (α-actinina, verde, bactérias, vermelho).
AC. Um campo mostrando imagens xy da localização Nm (A) ou α-actinina (B). A imagem sobreposta no (C) indica várias regiões em que a cor amarelo-laranja aparece sugerindo colocalisation. Setas em (A) e (B) mostram regiões onde um alto grau de α-actinina acumulação parece ter ocorrido em torno de bactérias.
D. dissecção óptica de um colocalisation infectados monocamada HBMEC indicando cerca de bactérias intracelulares localizada na base de uma célula.
Novamente, isso não é colocalisation devido à proximidade acidental de α-actinina, como o general mancha de α-actinina nesta região é baixa.
E e F. As imagens tridimensionais de monocamadas infectadas HBMEC processados como descrito acima. Uma vista oblíqua da superfície apical (E) mostra bactérias aderentes manchados de vermelho (seta vermelha), enquanto que várias bactérias localizada na superfície basal das células endoteliais (seta amarela) são distintamente laranja / cor amarela. Localização basal pode ser visto mais claramente em (F), que é um fim-on XZ seção transversal.
G. A imagem do microscópio de elétrons negativamente manchada de N. meningitidis mostrando a suadiplococcal predominante de. Cada cocos é de aproximadamente 0,5 m de diâmetro.
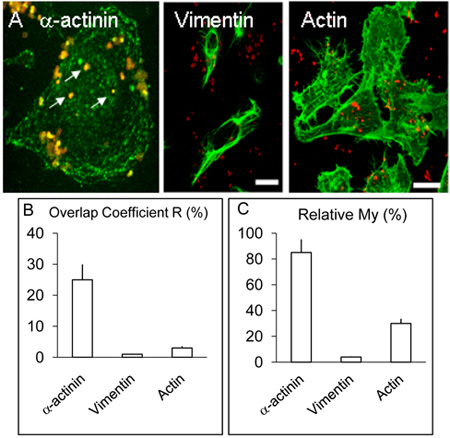
Figura 2. Localização e distribuição de α-actinina, actina e vimentina em células HBMEC.
Monocamadas A. Infected de HBMEC foram tratados como descrito na legenda acima, mas além de α-actinina, algumas lamínulas foram utilizados para a detecção de actina ou vimentina por processo semelhante ao de α-actinina. Como acima, α-actinina concentrada em torno de várias bactérias internalizadas (setas brancas). Vimentina e actina não colocalise com bactérias a níveis apreciáveis. Bar representa 20 mM.
B. & C. Os valores para os coeficientes de R e My foram obtidos mais de três experimentos utilizando software Volocity como descrito acima.
Discussão
A possibilidade de ligação de internalizada Opc-expressando Neisseria meningitidis para α-actinina foi explorado usando HBMEC pelo exame do colocalisation de bactérias e as proteínas do citoesqueleto em células infectadas depois de 3 e 8 h período de incubação. Por microscopia confocal, colocalisation de Neisseria meningitidis com α-actinina poderia ser demonstrada. Notadamente, embora as bactérias foram internalizadas em 3 h, houve colocalisation pouco com α-actinina neste ponto do tempo. Associação de bactérias com a proteína do citoesqueleto apareceu a exigir um período mais longo de residência intracelular como após 8 h período de infecção, um número significativo de bactérias tinha α-actinina aparentemente em estreita associação. Alfa-actinina é uma proteína multifuncional, e interações bacterianas com o elemento do citoesqueleto poderia ter influência significativa sobre a função das células-alvo, que é um assunto de estudos atuais.
Quantificação de colocalisation como descrito acima exige uma preparação meticulosa espécime. Atenção especial deve ser dada à fixação da amostra, bloqueando diluições período e anticorpos. Para a melhor relação sinal-ruído, cada anticorpo primário e secundário devem ser titulados em experimentos preliminares para determinar a concentração ideal. Em nossa experiência, o Mowiol meio de montagem produzida melhores imagens.
Divulgações
Agradecimentos
Os estudos foram financiados pelo Wellcome Trust e UK Meningite. HBMEC linhagem de células foi fornecido pelo Dr. KS Kim. Imagem confocal e microscopia eletrônica foram realizados na Unidade de BioImaging Wolfson, da Universidade de Bristol. Gostaríamos também de agradecer ao senhor Alan Leard, Dr. Mark Jepson (University of Bristol), eo Sr. Alan Tilley (PerkinElmer) por sua ajuda e conselhos.
Materiais
1. Microscopia Confocal Scanning Laser (CLSM):
Leica SP5 confocal sistema de imagem: Este sistema, usando uma combinação de AOTF (acústico-óptico sintonizável filtro) e um AOBS (acústico-óptico divisor de feixe), simplifica a excitação com comprimentos de onda específicos.
2 Software:
Leica confocal software LCS, Leica Microsystems, na Alemanha.
Volocity 5 Improvisação, PerkinElmer, EUA.
Referências
- Virji, M., Makepeace, K., Moxon, E. R. Distinct mechanisms of interactions of Opc-expressing meningococci at apical and basolateral surfaces of human endothelial cells; the role of integrins in apical interactions. Molecular Microbiology. 14, 173-184 (1994).
- Virji, M., Makepeace, K., Peak, I. R., Ferguson, D. J., Jennings, M. P., Moxon, E. R. Opc- and pilus- dependent interactions of meningococci with human endothelial cells: molecular mechanisms and modulation by surface polysaccharides. Molecular Microbiology. 18, 741-754 (1995).
- Sa E Cunha, C., Griffiths, N. J., Murillo, I., Virji, M. Neisseria meningitidis Opc invasin binds to the cytoskeletal protein alpha-actinin. Cellular Microbiology. 11, 384-405 (2009).
- Virji, M., Kayhty, H., Ferguson, D. J., Alexandrescu, C., Alexandrescu, J. E., Heckels, E. R. The role of pili in the interactions of pathogenic Neisseria with cultured human endothelial cells. Molecular Microbiology. 5, 1831-1841 (1991).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of colocalization of objects in dual color confocal images. Journal of Microscopy. 6, 357-382 (1993).
- Zinchuk, V., Zinchuk, O., Okada, T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena. Acta Histochemica et Cytochemica. 40, 101-111 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados