Method Article
Adultas e embrionárias Cultura Microexplant Músculo Esquelético e isolamento de células-tronco musculares
Neste Artigo
Resumo
O micro-dissecados técnica de explantes é um método robusto e confiável para isolar proliferativa das células do músculo esquelético juvenil, adulto ou músculos embrionárias como fonte de células-tronco do músculo esquelético. Excepcionalmente, estas células têm sido clonal para produzir derivados do músculo esquelético linhas de células-tronco usado para in vivo o transplante.
Resumo
Cultivadas embrionárias e adultas células do músculo esquelético têm uma série de diferentes usos. O micro-dissecados técnica de explantes descritos neste capítulo é um método robusto e confiável para isolar um número relativamente grande de proliferação de células do músculo esquelético juvenil, adulto ou músculos embrionárias como fonte de células-tronco do músculo esquelético. Os autores usaram micro-dissecados culturas de explantes para analisar as características de crescimento de células musculares esqueléticas em músculos do tipo selvagem e distrófica. Cada um dos componentes do crescimento do tecido, ou seja, a sobrevivência celular, proliferação de senescência, ea diferenciação podem ser analisados separadamente, utilizando os métodos descritos aqui. O efeito líquido de todos os componentes do crescimento pode ser estabelecida por meio de medir as taxas de crescimento dos explantes. O método de micro-explante pode ser usado para estabelecer culturas primárias de uma ampla gama de tipos de músculos diferentes e idades e, como descrito aqui, foi adaptado pelos autores para permitir o isolamento de embriões precursoras de músculo esquelético.
Excepcionalmente, micro-explante culturas têm sido usadas para derivar clonal (origem única célula) de células-tronco do músculo esquelético (SMSC) linhas que podem ser expandidos e utilizados para in vivo o transplante. Em SMSC vivo transplantado comportar-se como funcional, de tecidos específicos, células satélites que contribuem para a regeneração do músculo esquelético de fibra, mas que também são retidos (no nicho de células satélites), como um pequeno grupo de células-tronco indiferenciadas, que podem ser re-isoladas em cultura pelo método de micro-explante.
Protocolo
Duas abordagens podem ser empregadas para isolar proliferativa células do músculo esquelético. Nos tecidos musculares primeiros são digeridos enzimaticamente para isolar células isoladas antes de chapeamento out 1. O segundo método é explante pedaços de tecido muscular na cultura para permitir que as células a crescer durante a incubação 2, 3. O segundo método é descrito neste protocolo. Cultura de tecidos em si tem suas raízes na cultura explante. O ano de 2007 foi o 100 º aniversário dos experimentos clássicos de Harrison na qual ele obteve outgrowths neurônio através da incubação de explantes nervosas pendurado gotas de linfa 4. Técnicas de cultura de explantes foram utilizadas e requintada, com uma variedade de diferentes contextos em que se seguiu a 100 anos como um meio de gerar proliferativa culturas primárias de células adultas e embrionárias 4, 5. O princípio por trás da técnica de explantes, no entanto, permanece o mesmo; para minimizar o trauma de isolamento de células primárias pela manutenção da estrutura tridimensional do tecido pai durante os estágios iniciais cruciais do crescimento das células, proporcionando as células outgrowing com uma mídia rica nutritivo em que a proliferar. No músculo esquelético há uma vantagem adicional para usar a cultura de explantes, porque o ato de cortar o tecido muscular imita trauma da fibra muscular, o gatilho usual para a ativação de células satélite, migração e proliferação de 3, 6. Adulto células do músculo esquelético por satélite (também chamado de mioblastos) são a população de células-tronco proliferativa responsáveis pela reparação da fibra muscular e crescimento de 7.
Explantes músculo esquelético, assim, imitar o no ambiente vivo da regeneração muscular e estimular a migração de células-tronco e divisão. No embrião, a maioria do músculo esquelético de vertebrados (músculos do tronco e dos membros) deriva da somitos, embora somitomeres e arcos branquiais dão origem à musculatura da cabeça 8, 9. O myotome podem ser identificados como dois grupos distintos de Myf-5 células-tronco expressar localizados nas bordas dorsal, medial e lateral do somito diferenciação, respectivamente. Respectivamente, essas células geram os músculos epaxial das costas, que diferenciam in situ, e da musculatura ventral e lateral hypaxial (membros, abdômen e músculos respiratórios) que exigem a migração de células-tronco musculares do somito 10. Embrionárias musculares migração de células-tronco está sob o controle da Pax 3 11. Myf-5 expressão é essencial para o estabelecimento da musculatura embrionárias e essa importância persiste até os músculos pós-natal, onde mais de 98% das células satélites ativadas expressar Myf-5 12. Myf-5 é, portanto, um marcador confiável e específico da população do esqueleto muscular proliferação de células-tronco em tecidos adultas e embrionárias. Células do músculo-tronco embrionárias (células progenitoras muscular também chamado de célula, os precursores do músculo esquelético, mioblastos ou células embrionárias, mesmo satélite) pode ser isolado do somitos de embriões em estágio inicial pinto mouse, e sapo 13. A fim de isolar culturas miogênicas dos músculos esqueléticos embrionárias de embriões mais velhos, os autores adaptaram a técnica de explantes microdissecção para tecidos embrionários. Uma abordagem semelhante é utilizada por Cossu et al. 14 de gerar populações de células clonais do somito embrionárias 14.
1. Cultivo in vitro de células de células-tronco musculares (SMSC)
SMSC são linhas celulares de origem única célula que foram clonalmente derivados de culturas primárias explante do músculo esquelético. Eles podem ser cultivadas utilizando a metodologia padrão de cultura de tecidos se bastante cuidado é tomado. Note-se que, salvo indicação em contrário, todas as manipulações descritas são realizadas sob condições assépticas, usando uma capela de fluxo laminar (classe 1 ou classe 2 gabinete estéril) e todos os reagentes cultura são aquecidas a 37 ° C em banho-maria antes de usar.
- Para trazer SMSC de armazenamento de nitrogênio líquido (ver secção 1.2 para o congelamento até método) criotubos devem ser descongeladas rapidamente eo conteúdo transferido para 5 mL pré-aquecido (37 ° C) meio de cultura para a centrifugação imediata DF10 (1.000 g por 3 min) para remover DMSO . O melhor método para descongelar células é por meio de pipetagem repetida de pequenas quantidades de pré-aquecido meio de cultura para o frasco antes de transferir para o tubo de centrifugação. O processo de descongelamento de células deve ser realizada muito rapidamente desde células criopreservadas conter DMSO 10%, que é tóxico para as células à temperatura ambiente (cerca de 2 min LD50).
- Centrifugação após o sobrenadante é removido e as células são lavadas pela re-suspensão de células do sedimento em mais 5 mL DF10, então centrífuga como antes.
- O pellet celular é então misturado para o segundo tempo com 5 mL de DF10 ea suspensão celular resultante é transferido para um 25 centímetros pequena 2 ve cultura de plásticoSSEL.
- Culturas são mantidos a 37 ° C em uma incubadora umidificada contendo 5% de CO 2 no ar. A menos que navios são utilizados com uma tampa de filtrada, a tampa do frasco deve ser ligeiramente afrouxados por várias horas para permitir que o ar no recipiente de cultura para equilibrar com a incubadora e acidificar o meio de cultura. pH do meio é controlado por meio da incorporação de um indicador de pH vermelho de fenol corante em meio de cultura.
- Células descongelado deve ser sempre monitorado 24 h após o plaqueamento e re-alimentadas com meio DF10 fresco para garantir a remoção de detritos de células e toxinas residuais (ver notas 1 e 2).
1.1. Subcultura
Para estabelecer linhas de SMSC, quando as células atingem cerca de 95% confluência, eles devem ser removidos de suas navio cultura, diluído e colocado em um navio novo para permitir um maior crescimento. Este procedimento subcultura pode ser alcançado por meio de um número de diferentes processos enzimáticos, tripsina / EDTA sendo o mais utilizado (ver nota 3). É uma prática (e bom) costume de cultivar células em densidades que os obrigam a ser repicadas no terceiro dia de crescimento. Para a maioria das linhas de células SMS isso pode ser alcançado pelas células divisão 10/01 em cada subcultura. Isto permite um acompanhamento atento das células e permite que aqueles que executam a cultura de tecido para identificar imediatamente o comportamento crescimento anormal (por exemplo um crescimento mais rápido), que podem indicar alterações fenotípicas para a linha de células, tais como a transformação ou a redução da apoptose causada pela adaptação às condições de cultura. Além disso, uma rotina consistente e cuidadoso subcultura reduz drasticamente a incidência de tais eventos.
- Para subcultura usando tripsina (trypsinisation) Os navios são retirados da incubadora e seu meio descartado por aspiração.
- Células são então lavadas duas vezes com estéril de cálcio e magnésio livres de tampão fosfato (PBS), 10 mL por lavagem, retirada de cada vez por aspiração.
- Dissociar a monocamada de células (25 mm 2 frasco) 1 mL 1 tripsina / EDTA é adicionado e deixado sobre as células em temperatura ambiente por 2 min 3 até que as células começam a destacar (ver Nota 4). Isto pode ser visto pelo usuário experiente como pequenos furos formando na monocamada ligeiramente opaca quando o balão é realizada à luz (ver nota 5). Enquanto as células devem ser tripsinizadas por tempo suficiente para garantir uma suspensão única célula, o cuidado deve ser tomado para não expor demais SMSC para trypsinisation uma vez que irá resultar em altos níveis de morte celular e apego pobre quando as células são re-plated.
- Para interromper a reação de tripsina, soro meio contendo (DF10) é adicionado a um mínimo de 2 volume (ou seja duas vezes o volume da solução de tripsina). Quando subcultura a 25 mm 2 frasco é conveniente adicionar 9 mL DF10 nesta fase. A divisão 1 / 10 das células pode ser facilmente feito através da diluição de 1 mL da suspensão de células, resultando em um frasco de 25 milímetros nova cultura 2, juntamente com um mL de meio de mais 9 DF10 fresco. As células restantes podem ser usados para expansão celular (transferência para um vaso maior), criopreservados (ver secção 1.2) ou contados e banhado em pratos experimental, poços ou placas para ensaios de proliferação e sobrevivência, diferenciação, o tratamento do fator de crescimento ou outros fins (ver abaixo).
1.2. Criopreservação de linhagens de células e culturas primárias
- Para as células de criopreservação são dissociados de suas monocamada de subcultura (Seção 3.1.1) e peletizada por centrifugação (3 min a 1.000 g).
- O sobrenadante é removido por aspiração e células são cuidadosamente e rapidamente re-suspenso em 10 mL de congelamento para baixo mix (DMSO 10% em DF10) antes de serem re-peletizada por centrifugação.
- Desta vez, o pellet é ressuspenso em congelar suficiente até para permitir que mistura 0,5 mL de suspensão celular por cryovial (ver Tabela 1) e imediatamente colocado em 80 ° C durante a noite.
- Criotubos são transferidos para o nitrogênio líquido no dia seguinte para armazenamento de longo prazo (ver Nota 6). Tal como acontece com o descongelamento de células, este processo de criopreservação deve ser realizada rapidamente. Enquanto DMSO é de proteção para as membranas celulares durante o congelamento é muito tóxico para as células sem congelamento temperaturas.
1.3. Determinar o número de células
- Para determinar a concentração de células de uma suspensão de célula única (subcultura seguinte) uma hemocitómetro Neubauer pode ser usado. Para garantir a precisão da contagem a lamela deve ser montado firmemente sobre a base hemocitómetro (ver Nota 7).
- Uma pequena gota de suspensão de células é então colocada perto da borda da lamínula e será retomada por ação capilar.
- Células são então contadas usando um microscópio invertido com contraste de fase de iluminação. Para aumentar a precisão da concentração celular final, o cells na câmara de contagem não deve sobrepor-se, se o fizerem a suspensão célula original deve ser diluído e as células re-contadas. Aglutinação deve ser evitado por dissociação completa das células durante trypsinisation e 100-200 células em uma área de superfície conhecida deve ser contado para obter uma estimativa precisa do número de células. Um método conveniente usando o hemocitómetro Neubauer é a contagem de células em duas ou mais 16 conjuntos quadrados. Densidade de células por mililitro é então obtém-se dividindo o total pelo número de conjuntos de contados (eg 2) e multiplicando por 10 4. Por exemplo, 100 células contadas mais de 2 x 16 conjuntos de quadrados = 100 / 2 = 5 x 10 5 células / mL.
2. Estabelecer Primária Culturas Microexplant Músculo Esquelético
Cultura micro-explante primário pode ser usado para isolar SMSC de qualquer músculo esquelético acessíveis incluindo os músculos individuais de frente e membros posteriores, diafragma, costas e músculos abdominais. O método para derivar culturas microexplant dos músculos juvenil e adulto é descrito em detalhes por Smith e Schofield 3 e foi, posteriormente, amplamente utilizado para obter células SMS de juvenis, os músculos de camundongos adultos e idosos. O método também pode ser usado para derivar cultura de células do músculo esquelético de peixe 24 e músculo-esquelético humano (Rao e Smith, inédito). Conseqüência do SMSC de um microexplant muscular mouse é ilustrada na Figura 1a, b. O método foi modificado para o isolamento de células musculares embrionárias precursor (ver Seção 3). O método básico é o seguinte:
- Dissecção asséptica do músculo-alvo (s) de um rato recém-abatidos é conseguido usando instrumentos esterilizados, uma área de trabalho limpo e uso liberal de spray álcool 70%.
- Músculos isolados são lavados através de duas mudanças de DF20 médio e são colocados em meio DF20 fresco em um 60 mm 2 prato. Usando um microscópio estéreo dissecção músculos são cuidadosamente microdissecado em condições estéreis para excluir tecido, gordura conjuntivo e osso.
- Peças muscular limpos são então cortadas em 400 m 3 cubos que, usando uma pinça joalheiro s, são colocados individualmente no centro 60 poços de uma placa de 96 poços contendo 50 mL DF20 (ver Nota 8). Poços são verificadas sob o microscópio e colocado na incubadora. Os poços exteriores são preenchidos com soro fisiológico para evitar a secagem de poços contendo explantes (3).
- Penhora Microexplant e conseqüência é marcado após 24-48 h de incubação e, posteriormente, 48-72 intervalos h (dependendo da taxa de crescimento dos músculos sendo cultivadas).
- Para a expansão e isolamento de células SMS, as culturas devem ser conseqüência de um acompanhamento individual de células com morfologia predominantemente SMSC, células mononucleadas ou seja esférica com alta refratividade, que crescem em cachos agregando (ver figura 3.1b).
- Uma vez conseqüência explante é estabelecida poços individuais são alimentados (ver Nota 9) pela adição de incrementos de 50 mL de meio quando o meio acidifica devido à densidade celular aumentada. Quando o poço está cheio e de cultura de células quase confluentes, poços são alimentados por substituição de 50% do meio de cada vez para garantir a manutenção de "condicionamento" fatores secretados pelas células (veja comentários sobre meio condicionado em clonagem; Seção 2.1). Para suprimir a diferenciação, a 60-70% confluência outgrowths explante primário são ligados em cálcio esgotados médio, substituindo DF20 médio de cálcio com depleção DMEM/F12 (todos os suplementos são os mesmos) para a alimentação de células 3.
- Explante meio condicionado podem ser preparados a partir de culturas nesta fase e armazenados para uso durante a expansão e clonagem de SMSC primário (para o método de clonagem, veja Seção 2.1, Figura 1c f). Culturas são repicadas utilizando o método dispase (ver secção 3.5).
- SMSC clonalmente derivados podem ser analisadas in vivo por via intramuscular (Figura 3.1 gk) 19.
- Cariótipo pode ser realizada em clonalmente derivados linhas SMSC para confirmar o status diplóide (veja Seção 2.2, Figura 3.1 l) 25.
- Este método pode ser adaptado para o músculo cultivo embrionário (Seção 3).
2.1. Derivação clonal
Culturas primárias de mioblastos explante (Figura 1a, b) são uma ferramenta útil e precisa para o estabelecimento de uma variedade de parâmetros de crescimento diferentes no tipo selvagem e mutante músculos esqueléticos. Derivação de clones, o isolamento de uma linhagem de células de uma única célula, é um passo essencial para o isolamento de células-tronco musculares e também pode ser usado para linhas subclone SMSC transfectadas com construções RNAi ou transgenes. Fundada culturas explante SMSC e primário são altamente dependentes da densidade e "crash "(destaque do prato e morrer) se banhado para fora em uma célula muito baixa densidade. Isto porque fatores de liberação SMSC solúveis que são necessários para manter o crescimento e sobrevivência das células. Para simular uma cultura de alta densidade e de fornecimento desses fatores durante o processo de clonagem, SMSC são clonados em auto-condicionado médio. A adição de meio condicionado foi encontrado para ser essencial para permitir que as células individuais a se proliferar em um ambiente isolado.
- Meio condicionado é preparado a partir de SMSC proliferando cultivadas por 48 h entre 33 e 75% confluência.
- Os meios de comunicação em que essas células são cultivadas é removido após 48 horas e filtrada usando um filtro de seringa de 0,2 mm; isso garante a esterilidade do meio condicionado e remove todas as células residuais e resíduos.
- Este meio condicionado é misturado na proporção de 1:1 com meio de cultura fresco (meio de clonagem, ver Nota 10) e é usado como meio de cultura para clonagem única célula.
- Para alcançar diluições células única célula estão dissociadas de uma suspensão única célula por trypsinisation cuidado (estabelecido SMSC) ou tratamento dispase (culturas de explante primário) e diluído a uma concentração de um celular por 100 mL meio de clonagem.
- 50 mL desta suspensão de células pode ser banhado em cada um dos 60 poços centro de uma placa de 96 poços.
- Células podem se conectar através da incubação a 37 ° C em 5% CO 2 por 6 h e cada bem é, então, cuidadosamente marcado para a presença de células. Poços contendo 0 ou mais de uma célula são descontados nesta fase.
- Poços contendo uma única célula anexados são cuidadosamente anotadas e da colônia derivadas desta única célula é cuidadosamente monitorados (diariamente durante os primeiros dias) para garantir que apenas uma colônia, derivada de uma única célula, é presente. Linhagens celulares eram apenas derivados de poços contendo um celular. Figura 1c-e ilustra a expansão das colônias de células derivadas de um único.
- Uma vez que a colônia atinge confluência na placa de 96 poços que podem ser repicadas em um poço de uma placa de 48 também.
- As linhas de células clonadas podem então ser cuidadosamente expandiu-se em 24 - e 6-bem até as placas células suficientes estão disponíveis para a chapa em um frasco de 25 cm 2.
- A origem do músculo esquelético dessas culturas pode ser demonstrado pela expressão de Myf-5 (Figura 1f) ou outro músculo esquelético-específicos marcadores como MyoD e Pax 7.
- Nesta fase as linhas são congelados para baixo antes de uma maior expansão (ver Tabela 1).
2.2. Cariótipo
Cariótipo é um importante método de fenótipo de células de monitoramento. Linhagens de células obtidas por derivação clonal deve ser cariotipadas para garantir que eles mantiveram um complemento cromossômico diplóide sem bruta rearranjos cromossômicos que poderia afetar seu fenótipo.
- Para as células são cultivadas para cariotipagem fase exponencial tardia (80 confluentes%) em 25 cm 2 vasos cultura (2 dias após repicagem) para maximizar a proporção de células mitóticas em cultura.
- Vinte e quatro horas antes do cariótipo das células são alimentadas com 10 mL meio de cultura fresco. 0,2 mL de colchicina 10 mg / mL (ver Nota 11) é então adicionada às células que são incubados por um h mais 1 a 37 ° C.
- Após 1 h, as células estão sujeitas ao procedimento padrão, exceto que trypsinisation subcultura de médio a cultura e lavagens PBS são retidos para maximizar o número de células mitóticas colhida.
- As células dissociadas, manteve médio e lavagens de PBS giram a 1.000 g por 3 min para agregar as células eo sobrenadante removido e descartado em lixívia.
- O pellet celular é então re-suspensas em 5 mL de cloreto de potássio 0,0075 M para exatamente 4 min, antes que as células são novamente peletizada por centrifugação.
- A maior parte do sobrenadante é aspirado, deixando um pequena quantidade (~ 5-10 mL) no tubo para a re-suspensão. Ressuspender as células sacudindo a base do tubo de falcon até uma suspensão de células é atingido. As células são então colocados no gelo e fixados em feitos recentemente fixador gelada (metanol: ácido acético glacial na proporção de 3:1) da seguinte forma: 10 mL de fixador é adicionado lentamente gota a gota para as células usando um pequeno vidro Pasteur pipeta ( este evita a coagulação das células).
- Células são colocadas em gelo por 30 min e depois peletizada por centrifugação após o qual o pellet de células ressuspensas em 0,5 ml de fixador fresco.
- Slides são produzidos por deixar cair a suspensão de células fixadas em lâminas preparadas (ver secção 3.2.2.1), realizada em um ângulo de 45 °. Para garantir o bem-espaçados metáfase espalha a pipeta deve ser realizada pelo menos 30 cm acima do slide.
- Para visualizar os cromossomos, as lâminas são coradas por 2 min em Leishman da Mancha, diluído com três volumes de Gurr pH 6,8 pouco antes de usar.
- Lâminas são secas à temperatura ambiente e montadas em DePex meio de montagem.
2.2.1. Preparação de Slides para Cariotipagem
- Lâminas de vidro (lâminas de microscópio Premium, VWR International, Reino Unido) estão preparadas para uso no protocolo de cariótipo, colocando-os durante a noite em um recipiente (vidro) grande quantidade de ácido sulfúrico.
- Slides são então colocados em água corrente por 8 h, e são então armazenados em etanol 70% até serem necessárias.
- Antes do uso, slides deve ser lavado em água corrente por um mais 30 min e secas ao ar em temperatura ambiente por 1-2 h.
3. Estabelecer primário Micro-explante Culturas de embriões
Três linhagens de camundongos foram utilizados para validar este método, do tipo selvagem (C57BL/10), juntamente com mdx e CAV3KO (mutantes ambos distróficos). A distrofina deficiente do rato mdx originou espontaneamente em C57BL/10, esta linha foi obtido a partir do laboratório Bullfield em 1991 e desde então tem sido continuamente mantidos em nossa colônia puras 26. Camundongos distróficos CAV3KO, que contêm uma mutação no gene da caveolina-3, foram criados para o fundo C57BL/10 por 10 gerações antes de serem utilizados neste estudo 27. Cada linha do mouse gerou uma robusta reprodutíveis perfil proliferação conseqüência, e de sobrevivência, que foi embrionárias fase específica e diferente para cada cepa. Os seguintes protocolos foram adaptados para embriões de Smith e PN Schofield (1994) 3, essencialmente, como em Merrick 21.
3.1. De colheita de embriões
- Para obter encenado embriões, os pares são configurados como natural (1:1) acasalamentos e fêmeas verificado a cada manhã para plugues vaginal. No dia da detecção do conector, os embriões são contados como E0.5 dias (12 h pós-fertilização).
- Uma vez tomadas vaginal foram detectados os machos são retirados da gaiola para garantir a precisão da encenação embrionárias.
- Quando a fase embrionária desejado é alcançado (E11.5 a E17.5) as mães são mortas por deslocamento cervical, o abdome é raspada, a pele e as áreas circundantes são esfregadas com álcool 70% eo útero é removido através de uma incisão horizontal abdominal feita utilizando instrumentos estéreis de dissecação.
- O útero é então lavado uma vez no principal meio de explantes cultura (PECM) antes de serem colocados em um pequeno prato contendo PECM fresco antes de dissecção.
- E11.5 a E17.5 embriões são dissecados do útero através de um microscópio de dissecação e colocados individualmente em placas de Petri contendo PECM em prontidão para microdissecção detalhadas.
3.2. Microdissecção embrião
- Embriões individuais são mais dissecados para isolar áreas ricas em músculo esquelético (ver Figura 2a). Traseiras e forelimbs (hypaxial músculos esqueléticos) são dissecados fora, bem como a parede superior e inferior do corpo (predominantemente epaxial músculos esqueléticos). Para fazer isso de uma incisão ao longo do comprimento do tórax, abdome e pelve é criado para permitir que os órgãos internos do embrião a ser removido.
- Para enriquecer para embrionárias células do músculo esquelético haste (eSMSc), a cabeça, medula espinhal e todos os órgãos internos são então removidas.
- Em embriões mais velhos (E15.5-E17.5 embriões), também é possível remover a pele e cartilagem / osso novo para aumentar a proporção de células musculares nas culturas.
3.3. Configurando Culturas Microexplant Embrião
- Uma vez forelimbs, membros posteriores e superior e paredes inferior do corpo foram dissecados eles são colocados em PECM fresco e mais microdissecção para produzir pequenos cubos de tecido de tamanho igual (~ 0,5 mm 3; Figura 2a).
- Estes microexplants são depois colocados em 60 poços no centro de uma placa de 96 poços (um explante por poço) contendo PECM 50μL por poço. Um mínimo de 60 poços contendo um explante por poço são estabelecidas, por embrião estudado.
- Para o centro de cultura de embriões 60 poços pode ser subdividida em regiões onde o que denota explante foi obtido a partir de (Figura 2b). Este design permite que 15 poços cada um contendo, respectivamente, membro anterior, parede superior do corpo, e hindlimb explantes parede inferior do corpo 21.
3.4. Conseqüência de monitoramento
Taxa de crescimento é uma medida confiável da taxa de crescimento de explantes embrionárias do músculo esquelético e nas condições cuidadosamente controladas descrito aqui é altamente reprodutível.
- Explantes são incubados a 37 ° C e 5% CO 2 por 3 semanas e marcou no dia 3, 7, 14 e 21 de cultura usando um microscópio invertido. Explantes são pontuados de acordo com o nível de confluência de células em cada poço individual (Figura 3a, e).
- Imagens fotográficas de culturas podem ser tomadas, por exemplo, usando uma câmera SLR acoplada ao microscópio e 100 ASA Fuji (cor) ou Kodak TMAX (preto e branco) de filme profissional (Figura 3f).
- Um esqueletomúsculo-específicos de anticorpos específicos para Myf-5 pode ser usado para demonstrar a origem do músculo esquelético de eSMSc, dependendo de tensão 80% 95 de células isoladas usando esse método são Myf-5 positivo. Outros marcadores, como MyoD e Pax 7 também pode ser usado para demonstrar a origem do músculo esquelético dessas populações de células. Embora essas células contêm uma percentagem muito elevada de células embrionárias do músculo esquelético-tronco não pode ser assumida (especialmente para os embriões mais jovens) que todos eles são de origem músculo-esquelético, ou que todos eles são as células-tronco. Para isolar populações de células-tronco puro é necessário clonalmente derivar culturas explante primário, conforme descrito na Seção 2.1.
3.5. Subcultura primária Explantes embrionárias
Uma vez confluentes, as culturas de explantes exibindo as características morfológicas de SMSC (Figura 3f) pode ser repicadas da seguinte forma 3, 21:
- Meio de cultura é retirado dos poços selecionados, filtrado usando uma seringa de 0,2 m Acrodisc R_ filtro e reservados para uso como meio condicionado. O meio pode ser armazenado a 4 ° C durante 1 semana.
- 100 L de 1:10 dispase diluído em PECM é adicionado a cada poço e as placas, em seguida, retornou à 37 ° C incubadora por 20 min.
- A ponteira é então usado para raspar suavemente as células soltas da superfície do poço.
- A suspensão de células é então centrifugado a 1.000 g por 3 min para agregar as células eo sobrenadante é retirado e descartado.
- Células são ressuspensas em 200 mL de 1:1 mistura de meio condicionado e PECM.
- A mistura de células é transferido para 48 placas de expansão bem mais longe.
- Para análise in vitro em células pode ser banhado com uma densidade de 5 x 10 3 células / cm 2, quer em 48-lamelas (cada um contendo um 9 mm 2 lamela de vidro estéril) ou em 8-bem-lâminas de vidro de câmara. Para as células análise diferenciação são cultivadas durante a noite para 50-60% de confluência, antes de serem transferidos para o meio de diferenciação permissiva (ver secção 4 para em detalhes o método in vitro) durante 3 dias, antes da fixação.
4. Na análise in vitro de células do músculo esquelético Stem e culturas primárias
4.1. Preparação de células
- Dispase subcultivadas (Seção 3.3) primária culturas explante embrionárias são banhados em meio PECM / condicionado em lamínulas em 48-lamelas com uma densidade de 3 x 10 3 células / cm 2 e permitiu a anexação.
- Para avaliação da apoptose e proliferação lamínulas são lavados duas vezes em PBS, fixadas em paraformaldeído a 4% (ver secção 4.2) em PBS por 20 min em temperatura ambiente, seguido por mais 10 min PBS lavagem.
- Lamínulas preparadas deste modo pode ser armazenado a 4 ° C por até 1 semana em PBS ou PBS / glicina.
4.2. Preparação de fixador Paraformaldeído
- Em um exaustor, pesar 4 g de paraformaldeído (PFA; Sigma-Aldrich, UK) e adicionar a um frasco de vidro de 100 mL de PBS estéril com um agitador magnético. Uma máscara facial e luvas devem ser usados para proteção.
- Em um exaustor, a solução é aquecida e agitada continuamente em uma placa magnética, até o pó se dissolva. Isso leva cerca de 10/05 min a 65 ° C. Cuidados devem ser tomados para evitar o aumento da temperatura acima de 70 ° C, como existe o risco da solução explodir em altas temperaturas.
4.3. Apoptose e ensaio de proliferação
- Lamínulas fixo (preparado como na Seção 4.1) são marcadas com 10 mcg / mL para DAPI 3 min.
- Lamínulas são lavadas uma vez em PBS (5 min a 10) e invertida em um ponto de vectashield meio de montagem numa lâmina de vidro 17, 18.
- As bordas da lamínula são selados com verniz (ver Nota 12).
- Para o armazenamento, as lâminas são embrulhados em papel alumínio e colocado a 20 ° C.
- Para a contagem, as lâminas são vistas sob fluorescência (filtro UV) em um microscópio de pé e marcou para células apoptóticas e mitótica usando uma retícula ocular. Vinte grades distribuídos aleatoriamente são contados (representando ~ 1000 células), e as células são morfologicamente caracterizadas como não-apoptóticas, ou apoptose mitóticas (Figura 3 g).
- Índices de mitose e apoptose são calculadas como uma proporção de células total.
4.4. Imuno-histoquímica
Células fixadas em lamínulas também pode ser usado para imuno-histoquímica. Para recuperação antigênica usando uma panela de pressão lamínulas devem ser firmemente fixados a lâminas de vidro usando clipes de papel padrão. Imunocoloração pode ser usado para identificar células em proliferação, usando um anticorpo Ki67 (01/01, 000 de diluição), para estabelecer a identidade, usando um anticorpo para Myf-5 (01/01, 000 de diluição), ou para investigar a expressão gênica (verSecção 4.5). Imunocoloração pode ser conseguido usando uma série de métodos, o seguinte (descrito em (28, 29)) é usado rotineiramente pelos autores:
- Tampão citrato de sódio é pré-aquecido na panela de pressão. Para recuperação antigênica, as lâminas contendo tecido seccionado são colocados no buffer aquecidos e aquecidos sob pressão por 2 min. Pressão é alcançado, tornando irreversível a tampa de panela de pressão e de colocação no peso. Uma vez que o tempo de recuperação 2 min tem decorrido a panela de pressão é, então, cuidadosamente colocados em água corrente fria para reduzir a pressão. Para evitar que o buffer fervendo, o cuidado deve ser tomado para não remover a tampa até que a pressão é igualada com a pressão atmosférica. Pressão é suficientemente reduzida quando o peso pode ser removido facilmente (sem força) e da tampa. Slides são então removidas do buffer e lavadas em PBS à temperatura ambiente por 10 min.
- Slides são pré-bloqueada por imersão em 3% de água de peróxido de hidrogênio / torneira por 5 min e, em seguida lavadas três vezes em PBS + 0,05% Tween 20 (10 min por lavagem).
- Bloqueio é realizado por um de incubação de 30 min em tampão de bloqueio TNB (fornecido no kit TSA) em temperatura ambiente.
- Anticorpo primário é diluído em tampão TNB à diluição apropriada (chegou por titulação, ver Nota 12) e incubadas overnight a 4 ° C (ou, alternativamente, 1-2 h à temperatura ambiente).
- Após três lavagens de 10 min em PBS + 0,05% Tween 20, as lâminas são incubadas por 1 h à temperatura ambiente em que o anticorpo biotinilado apropriado segundo diluído em TNB buffer.
- Após mais três lavagens 10 min em PBS + 0,05% Tween 20, as lâminas são incubadas por 30 min em streptavidina-HRP (fornecido no kit TSA) diluído 1:100 em tampão TNB e, em seguida lavadas três vezes (10 min cada) em PBS + 0,05% Tween 20.
- Biotinil tiramida (reagente de amplificação; TSA kit) é então adicionado a cada seção para entre 8 e 15 min (o tempo exato deverá ser obtido por experimentos de otimização).
- Amplificação seguinte, lavagem das lâminas por três vezes (10 min cada) em PBS + 0,05% Tween 20 e, em seguida, incubar por 30 min em SA-HRP.
- Após três lavagens mais (10 min cada) em PBS + 0,05% Tween 20, visualize utilizando 3,3 _-diaminobenzidina tetrahidrocloreto cromógeno (DAB) por 5 a 10 min. Então realizar duas lavagens final em água antes de contracoloração slides em hematoxilina e lamínulas. DAB é um conhecido agente cancerígeno e deve ser manuseado com cuidado (como, por colchicina, Seção 3.2.2).
4.5. Diferenciação
- SMSC banhado em lamelas ou slides câmara (ver nota 13) também pode ser diferenciada antes da fixação para análise miotubo.
- Para estes experimentos células são banhados com uma densidade de 10 4 / cm 2 e permitiu anexar por 6 a 8 h.
- As células são depois passou para as condições de diferenciação permissivo para 3 dias (ver nota 14).
- Meio de diferenciação é composto por DMEM + 0,5% FCS suplementado com soro de cavalo 2% e 1% de glutamina. Esta diferenciação meio de cultura permissiva é substituído em 48 intervalos h.
- Lamínulas são então fixados em paraformaldeído 4% como acima (Seções 3.4.1 e 3.4.2).
4.6. Transfecção de SMSC: expressão dos transgenes e Construções shRNAi
Células-tronco e culturas primárias são refratários a transfecção e com a maioria dos métodos a taxa de transfecção em SMSC e células primárias de músculo esquelético é muito baixa (<10%), impedindo o uso de métodos de transfecção transiente. Para superar isso, tem sido prática comum em nosso laboratório para isolar derivados clonal de transgene culturas transfectadas (ver Secção 3.2.1) transfecção seguinte com fosfato de cálcio ou lipofectamine. Alternativamente, as células podem ser eficientemente transfectadas com infecção de construções virally embalados. Figura 1m mostra expressão estável de β-galactosidase em PD50A, um derivado SMSC clonal isolados sob G418 infecção seleção a seguir com pIRV, uma replicação defeituosa retrovírus portador de genes para resistência e neo/G418 β-galactosidase (19). Esta linhagem celular foi usado para demonstrar formalmente que SMSC se comportar como células-tronco funcionais in vivo (ver figura 3.1). Enquanto a geração de uma linha celular estável clonal expressando um gene marcador é desejável no tronco vivo experimentos transplante de células, é um método demorado e insatisfatório de analisar a função do gene in vitro. Por estas razões, os autores desenvolveram recentemente uma modificação otimizada do reagente transfecção Lipofectamine 2000, que é capaz de fornecer taxas de transfecção de 60 a 70%. Isto permite a análise da função do gene utilizando transfecção transitória de transgenes ou RNAi construções em SMSc ou culturas de explante primário (Figura 3h, i). Os autores usam um curto hairpin RNAi vetor (pSHAG RNAi) (30) para gerar construtos shRNAi capazes de atingir gene específico de expressão de mRNA em SMSC. O sucesso da técnica shRNAi depende de dois elementos: (a) um método de transfecção eficiente e (b) o desenho de uma seqüência de curto hairpin que reconhece especificamente o gene alvo. A shRNAi construir direcionado para eGFP pode ser usado para validar o método knockdown RNAi (Figura 3j, m).
4.7. Optimizado LipofectamineTM Protocolo Transfection 2000 para SMSC
- Células são banhados em 5 a 10 4 células / cm 2 em slides câmara em 250 mL meio de cultura DF10 e cultivadas por 18 h para atingir confluência de 95% (confluência ideal para cada linhagem celular foi estabelecido através da avaliação taxas de transfecção em diferentes densidades).
- Para cada poço, 0,5 mg de DNA (vetores shRNAi, transgenes) é adicionado a 33 mL de soro livre de DMEM suplementado com 2 mM de glutamina e misturado delicadamente em um tubo Eppendorf estéril.
- Para cada poço, 1,25 mL de Lipofectamine 2000 é separadamente diluído em um mais 33 mL de soro livre de médio DMEM + glutamina, gentilmente misturados e mantidos em temperatura ambiente por 5 min
- As misturas de DNA e são, então, rapidamente lipofectamine somados, misturado delicadamente por 60 s por pipetagem e então incubadas a temperatura ambiente por 19 min para permitir DNA Lipofectamine 2000 para formar complexos.
- Para a transfecção, 66 mL de mistura complexa é adicionado a cada câmara de bem e slides são suavemente embalado por 10 s para garantir a distribuição igualitária dos complexos.
- As células são incubadas por 24-72 horas a 37 ° C e 5% CO 2. Dependendo da construção de expressão gênica, funcional ou knockdown shRNAi é detectada pela primeira vez entre 8 e 24 h pós-transfecção.
5. Resultados representante
Quando explantes são cuidadosamente explantado do músculo esquelético de adultos ou de embriões explantes começará a gerar células dentro de algumas horas a 72 horas de incubação a 37 ° C (5% CO 2 / ar) (Figura 3A). O tempo necessário para que isso ocorra depende da fonte de explantes: explantes embrionárias vai superar mais rapidamente do que adultos mais velhos explantes músculo esquelético. Em nossa experiência o tempo de crescimento é altamente reprodutível 3, 29. Expansão da população celular irá ocorrer durante um período de dias (explantes embrião) ou semanas (mais velhos explantes músculo esquelético) para gerar alta densidade agregar culturas de células SMS primário (ver Figura 3B-F para ilustração dessas culturas). Figuras 1 e 3 mostrar resultados representante da derivação de sucesso e cultura de músculo esquelético e explantes embrionárias, derivação clonal e in vivo de transplante de músculo esquelético derivadas de células-tronco adultas, β-galactosidase rotulagem, cariótipo e myf-5 imunohistoquímica de SMSC embrionárias para ilustrar origem músculo esquelético de . populações de células Figura 3 mostra um resultado representativo de marcar conseqüência (usando Myf-5 imunohistoquímica para visualizar SMSC), a morfologia das células musculares embrionárias primária; DAPI coloração para apoptose e do protocolo de transfecção shRNAi. Mais detalhes podem ser encontrados nas legendas das figuras relativas a estas duas figuras. Figura 2 ilustra o procedimento a partir do embrião dissecção micro-enriquecido para gerar populações de células-tronco embrionárias do músculo esquelético.
Tabela 1: tabela de cálculo para estimar o número de criotubos necessários para a viabilidade celular durante o congelamento máximo célula para baixo protocolos
| Placa Flask / / câmara de slides | Volume de meio de cultura | PBS lava | Volume de tripsina | Número de congelar baixo frascos (3.1.2) |
| De 96 poços | 50 mL | 2 X 100 L | 25 mL | N / A |
| 48 bem | 150 mL | 2 X 200 mL | 50 mL | N / A |
| 24 poços | 500 mL | 2 X 700 mL | 200 mL | N / A |
| 6-bem | 3 mls | 2 X 3 mls | 500 mL | 1 |
| Pequena (25 cm 2) | 10 mls | 2 X 10 mls | 1 mL | 2 |
| Médio (80 cm 2) | 10 mls | 2 X 10 mls | 3 mls | 4 |
| Grandes (175 cm 2) | 10 mls | 2 X 10 mls | 5 mls | 8 |
| Câmara bem | 500 mL | 2 X 500 mL | 100 L | N / A |
N / A = não aplicável; número de células eram demasiado baixos para congelar para baixo, a menos que vários poços foram congelados para baixo juntos.
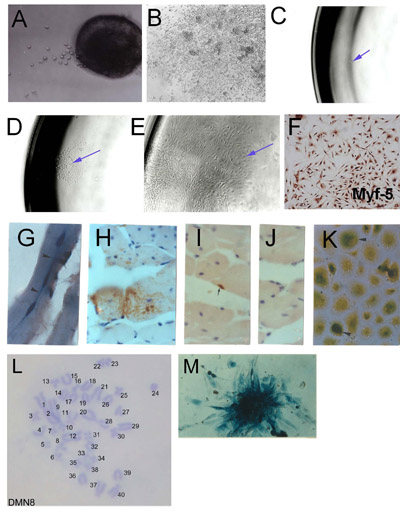
Figura 1. Isolamento de células-tronco do músculo esquelético (SMSC) de microexplants: (A) conseqüência antecipada na explantado músculo esquelético adulto (dia 2) (B) conseqüência explante Fundada mostrando culturas agregadas e alta densidade celular.. Derivação clonal de SMSC. (C) de células Único isoladas em uma placa de 96 poços. (D) colônia de origem única célula. (E) Fundada população clonal. Verificação (F) da identidade SMSC usando Myf-5 imuno-histoquímica. Células derivadas de SMSC clone PD50A (expressando β-galactosidase) em ratos acolhimento em três meses (G) e (HJ) 14 meses após a injecção de 2.000 células PD50A em músculo tibial anterior do rato. (G) Três recentemente fundida (núcleos centralmente localizado ) β-galactosidase de células positivas (mancha azul) em fibras musculares (secção longitudinal). (H) a contribuição extensivo de β-galactosidase de células positivas (mancha marrom, detectado pelo anti-β-galactosidase de anticorpos) em fibras musculares (seção transversal ). (I) β-Galactosidase positivo células satélites (mancha marrom, detectado pelo anti-β-galactosidase de anticorpos). (J) controle de anticorpo secundário (sem coloração). (K) β-Galactosidase células positivas (mancha azul) proliferar em cultura, quando isolado de músculos anfitrião injetado 12 meses pós-injeção. (L) Cariótipo de uma linha de SMSC rato clonal (DMN8) mostrando normais diplóides Histoquímica cromossomo do complemento. (M), mostrando β-galactosidase expressão em uma colônia de células PD50A ( Figura 3.1 g, k, reproduzido com a permissão de AACR imprensa, Smith e Schofield, 1997).
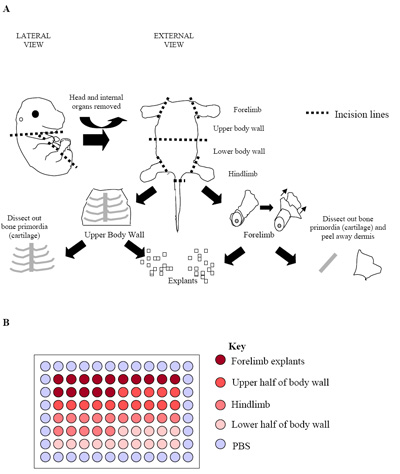
Figura 2. (A) Ilustração do processo de dissecação do embrião. A figura representa um embrião primordial E15.5 onde o osso (cartilagem) poderia facilmente ser identificado e dissecado livre do tecido muscular ao redor do esqueleto. Nesta fase, e em embriões fase posterior (E15.5 E17.5), derme também foi removido para maximizar a proporção de células do músculo esquelético obtidos. (B) Instalação de culturas de explante primário em uma placa de 96 poços. Cada embrião foi usado para produzir uma placa como visto acima. Prática usual é a placa de réplicas de três embriões separados (três placas = 180 poços) para estabelecer as taxas de crescimento.
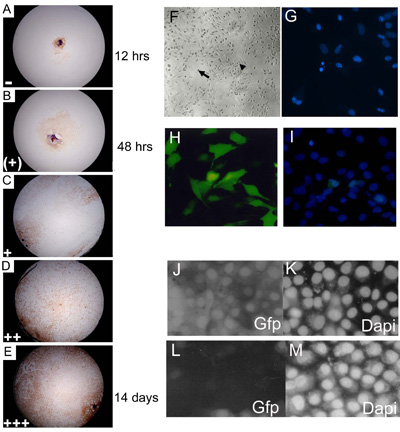
Figura 3. Embrionárias culturas de explantes primários foram marcados aos 3, 7, 14 e 21 dias de cultura e de um representante designado nível conseqüência do nível de confluência. (AE) C57BL10 E15.5 principal embrionárias culturas explante corados com Myf-5 para ilustrar 0 14% (); 15 24% (+); 25 49% (+); 50 74% (++); 75 100% ( + + +) níveis de confluência. A proporção de poços mostrando cada nível de crescimento (em cada dia de scoring) foi multiplicado por um número arbitrário (= 1; (+) = 2; + = 3; + + = 4 e + + + = 5), antes de recolha de dados para dar um valor conseqüência final. Aproximadamente 85% do tipo selvagem eSMSc (C57BL/10) primária mancha para o marcador de células do músculo esquelético Myf-5. Ampliação é 10. (F) Fundada culturas embrionárias têm as características morfológicas dos adultos SMSC, células bipolares (seta pequena) e esférica células monomórficas (seta grande). (G) Identificação de fragmentar núcleos apoptóticos usando coloração DAPI. (HI) Altos níveis (~ 75%) de transfecção de uma construção GFP-expressar em linhas celulares SMS usando o método otimizado Lipofectamine transfecção de 2000. (I) Contagem do número total de células é ajudada por DAPI contracoloração. RNAi usando pSHAGshRNAigfp (JM) abole a expressão GFP em SMSC (ver (29) para um exemplo dessa construção usado como um controle). (J) Controle (transfecção mock) mostrando a expressão GFP em uma linha SMSC GFP. (K) DAPI controle (L). shRNAiGfp 24 h após a transfecção. (M) DAPI controle para as células transfectadas shRNAiGfp em (L).
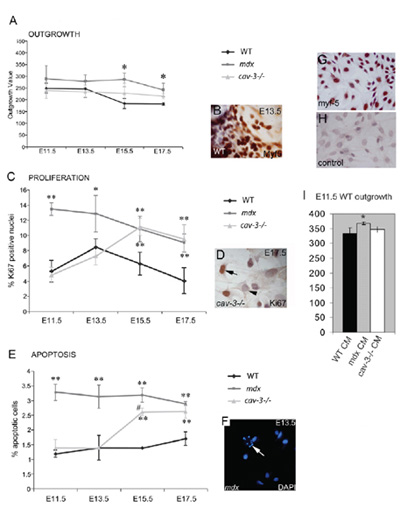
Figura 4. Distróficos, mioblastos Myf5 positivo embrionárias são hiperproliferativas e propenso à apoptose. (A) A taxa de crescimento de mioblastos embrionárias a partir de cultura de explantes muscular is aumentou tanto em mutantes mdx de E11.5 e em mutantes cav-3 (-/-) na E15.5 e E17.5 quando comparado com explantes WT cultivadas em paralelo. (B) A explante Myf5-histoquímica. (C) hiperproliferação de mioblastos embrionários em mutantes mdx de E11.5 e em mutantes cav-3 (-/-) de E15.5, conforme determinado pelo Ki67 positivo imunorreatividade (D). apoptose (E) a partir E11.5 elevados em embriões mdx e de E15.5 em embriões cav-3 (-/-), como mostrado pela coloração DAPI (F); na seta F aponta para um celular por apoptose. * P <0,05 comparado com WT; ** p <0,01 comparado com WT; * p <0,05 quando comparado mdx com cav-3 (-/-) (G, H) E15.5 primários cultivados WT mioblastos embrionários com Myf5 coloração. (G) e um controle segundo anticorpo (H). (I) A taxa de crescimento de explantes E11.5 WT aumentada (* p <0,05) em E11.5 mdx médio explante-condicionado (CM), mas não na cav-3 CM (-/-) ou WT. Barras de erro indicam Este valor sd é reproduzido sob direitos autorais autores e foi publicado pela Companhia de Biólogos em Merrick et al., 2009.
6. Notas: etapas críticas e possíveis modificações
- Quando as células descongeladas ter anexado a densidade de células muito baixo, é prudente para substituir apenas metade da média para evitar acidente cultura.
- SMSC isolado do músculo distrófico são suscetíveis à apoptose e devem ser tratados com cuidado especial. SMSC distróficos (como a linha celular dfd-13, que foi estabelecida a partir do músculo esquelético obtido a partir de cinco semanas de idade distróficos (mdx) ratos) devem ser cultivadas em densidades mais elevadas de células que o habitual para mioblastos. Tais linhas de apoptose de células sensíveis também são criopreservadas em densidades mais elevadas (ver Secções 1.1 e 1.2) (19).
- Um método alternativo de remoção de células de uma monocamada utiliza dispase, que fornece um método suave de célula de dissociação, com a vantagem que ele pode ser realizado na presença de FCS e cálcio (presente no DF10). Dispase pode, portanto, ser usado para subcultura e expandir as culturas primárias do músculo esquelético explante e clones earlystage SMSC (ver Secções 2 e 3).
- Para frascos maiores a quantidade de tripsina / EDTA utilizado deve ser escalado da seguinte forma: 75 mm 2 frasco (3 mL de tripsina) e 175 mm 2 frasco (5 mL de tripsina). Da mesma forma para áreas menores superfície reduzir a quantidade de tripsina utilizado (ver Tabela 1).
- Alternativamente, a dissociação pode ser monitorado usando um microscópio invertido, este é recomendado para iniciantes.
- Criopreservação de linhas de células normalmente é realizada através de um navio confluentes (175 mm 2) plástico grande. Entre 7 e 9 criotubos pode ser obtida de um navio tão grande, dependendo do perfil da linha de sobrevivência de célula a ser criopreservados. Culturas primárias e linhagens de células recém-criadas são frequentemente muito refratária a congelar os procedimentos. Para melhorar a recuperação e sucesso de congelamento até duas abordagens tais células podem ser usadas (separadamente ou em combinação). (A) O conteúdo FCS do congelamento baixo mistura pode ser aumentada de 10% (até um máximo de 50%). (B) O congelamento abaixo processo pode ser retardado por colocar criotubos na fase de vapor de N2 por 12-24 h antes de transferir os frascos para a fase líquida.
- Uma maneira conveniente para verificar firme apego da lamela haemacytometer é olhar para Anéis de Newton (reflexos de arco-íris no vidro) na lamela ou, alternativamente, para segurar o haemacytometer cabeça para baixo sobre uma mão aberta.
- Uma variação do método de explante pode ser empregado para culturas de curto prazo para utilização em ensaios de proliferação imuno-histoquímica, ou apoptose. Explantes microdissecção são colocados no vidro usando slides oito bem-câmara. Um método alternativo é usar 9 mm 2 lamínulas colocados em placas de 24 poços. Em ambos os casos, dois explantes são transferidos para cada poço em 150 mL de médio DF20. Em alternativa, culturas primárias podem ser repicadas pelo método dispase e banhado para fora em lamínulas colocados em placas de 24 poços ou diretamente em slides oito bem-câmara.
- Para a análise quantitativa das taxas de crescimento de um mínimo de 60 poços contendo um explante por poço são estabelecidas, por músculo / tensão mouse. Para estabelecer parâmetros de crescimento de uma cepa pelo menos três animais separado deve ser usado. Placas e poços individuais não são alimentados ao mesmo tempo conseqüência está sendo marcado.
- Para a clonagem de linhas estabelecidas SMSC é suficiente para as células única cultura em uma mistura 1:1 de meio condicionado e DF10 médio. Para explantes primários é necessário aumentar o teor de soro do meio de cultura para 20%.
- Colchicina é altamente tóxico e um conhecido agente cancerígeno e deve ser manuseado com cuidado. Dupla de usar luvas e trabalhar nos confins de uma bandeja designado é essencial. Todos os materiais descartáveis (ou seja, Gilsondicas) são colocados em um copo de água sanitária (hipoclorito de sódio 5%) durante a noite antes da eliminação com grandes quantidades de água no dia seguin-wing.
- Atualmente usamos anticorpos primários específicos para Ki67 e Myf-5 cada um em 01/01, 000 de diluição. A diluição ideal para anticorpos primários precisa ser estabelecida empiricamente para cada anticorpo a ser utilizado e, idealmente, também para diferentes lotes do mesmo anticorpo, mesmo quando obtidos a partir da mesma fonte.
- Slides câmara também pode ser utilizado para este ensaio. Antes de fixar as células em PFA 4%, o meio de cultura é removido e as células lavadas duas vezes com 37 ◦ C estéril PBS. As câmaras de bem, junta e cola são removidos eo lâminas de vidro colocado em um vidro de 50 mL frasco contendo Coplin preparada paraformaldeído 4% em temperatura ambiente, que é então suavemente embalado em um Gyro Rocker-R_ shaker durante 25 min. Lâminas são lavadas duas vezes em PBS (temperatura ambiente) e imediatamente utilizada ou armazenada em PBS a 4 ◦ C (curto prazo; 1-2 semanas) para análise (IHC) imuno-histoquímica.
- Se a formação miotubo mais extensa é necessária células primárias de músculo esquelético podem ser diferenciadas por até oito dias.
Discussão
Culturas de explantes microdissecado pode ser usado de forma confiável e reprodutível isolar populações de células contendo uma proporção muito alta (~ 85%) de Myf-5 proliferativa positiva células do músculo esquelético haste (SMSC). Sob as condições de cultura rigorosamente controlados descritas aqui as culturas de explante primário pode ser usado para caracterizar os comportamentos de crescimento de rato geneticamente mutantes SMSC e pode ser usado como um meio de geração de miotubos de detalhada análise in vitro dos processos de diferenciação. Manutenção cuidadosa e manipulação dessas culturas permite a longo prazo de cultura e de expansão. Usando os métodos descritos aqui também é possível derivar clonal músculo esquelético linhas de células estaminais a partir de culturas de explantes, por meio da diluição única célula. Para alcançar a proliferação de células isoladas único durante o procedimento de clonagem, "meio condicionado" é usado para imitar a exigência normal destas células de alta densidade de cultura. O método é aplicável (com modificação) para embrionárias, tecidos adultos e idosos, adultos e, além de mouse pode ser usado para isolar as células dos músculos esqueléticos de outras espécies, incluindo humanos (Rao e Smith, não publicado), embrião de galinha e peixe ( salmão) 24. SMSC clonalmente derivados podem ser analisadas in vivo por via intramuscular transplante e sob essas condições injetado SMSC irá combinar com miotubos hospedeiro para formar fibras musculares híbrido. SMSC por via intramuscular injetado não formam tumores e foram encontrados nos músculos anfitrião na posição das células satélites mais de um ano após a injeção, sugerindo que eles estão sujeitos a controle endógeno pelo satélite células-tronco niche.These célula pode ser re-isolado injetado hosts como SMSC proliferativa mais de 12 meses após a injeção anfitrião 19.
Divulgações
Agradecimentos
Agradecemos a Patrick Paddison pelo seu dom do vetor de transporte shRNAi. Angela Sloan gerou a GFP imagem RNAi na Figura 3. Agradecemos também aos organismos de financiamento a seguir para o seu apoio:
Muscular Dystrophy Campaign RA2/592/2 número de concessão; SPARKS conceder número 02BHM04, The Royal Society número de concessão 574006.G503/1948./JE BBSRC e número de concessão 6/SAG10077.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
Referências
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados