É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Geração de recombinante do vírus Influenza de DNA plasmidial
Neste Artigo
Resumo
Resgate de vírus influenza A partir de DNA plasmídeo é uma técnica básica e essencial experimental que permite aos pesquisadores a gripe para gerar vírus recombinante para estudar os múltiplos aspectos da biologia do vírus da gripe, e para ser usado como vetores potenciais ou vacinas.
Resumo
Esforços por um número de grupos de pesquisa da gripe têm sido fundamental no desenvolvimento e melhoria da influenza A genética reversa do vírus. Originalmente estabelecida em 1999
Protocolo
1. Influenza transfecção de resgate de vírus
Vírus influenza A pertence à família Orthomyxoviridae de vírus de RNA de fita negativa envolvido. A influenza A genoma do vírus é composto por oito genes diferentes de RNA de polaridade negativa que codificam, pelo menos, 11 proteínas virais (Figura 1) 4. Vamos nos concentrar, neste relatório, sobre o resgate de um dos cepa de laboratório mais comum, a influenza A/PR/8/34, 5 usando plasmídeos ambisense (PDZ), contendo os 8 influenza A/PR/8/34 segmentos viral ( Figura 2).
Para o resgate de vírus de influenza recombinante de DNA plasmídeo, recomendamos 3 transfections independentes por cada vírus recombinante. Se mais de um resgate vírus recombinante é tentada, escala os seguintes passos accordantly ao número de vírus para ser resgatado. A transfecção seguinte e protocolo de infecção é estabelecida para 6-bem-pratos. Uma representação esquemática do protocolo é ilustrada na Figura 3.
- OptiMEM-Lipofectamine 2000 (LPF2000) mistura: Prepare 250 L de mídia OptiMEM e 6-8 mL de LPF2000 por transfecção. Incubar por 5-10 minutos em temperatura ambiente (RT). Enquanto isso, prepare a mistura de transfecção do plasmídeo.
- Mistura de transfecção do plasmídeo: Prepare o coquetel de transfecção do plasmídeo em 50 ul de mídia OptiMEM. Nós usamos geralmente 1 mg de cada DNA influenza plasmídeo por socorro. Adicionar 1 ml de os plasmídeos PDZ (a 1 mg / mL) PB2, PB1, PA, HA, NP, NA, M e NS para um tubo contendo 50 mL dos meios de comunicação OptiMEM.
- OptiMEM-LPF2000-DNA plasmídeo mistura: Adicionar 250 L a partir do passo 1,1 na mistura de transfecção influenza DNA plasmídeo (passo 1.2). Incubar a mistura por 20-30 minutos em temperatura ambiente. Enquanto isso, preparar suspensões de células MDCK 293T e de transfecção.
- Preparação de 293T/MDCK co-cultura: Antes de começar, trazer a 1X PBS, DMEM 10% FBS 1% PS mídia e EDTA-tripsina mistura a 37 ° C. A densidade das células deve ser a confluência de 80-90% no dia da transfecção. Geralmente, um prato milímetros confluentes 100 de 293T e um prato milímetros confluentes 100 de células MDCK pode ser usado por 10-12 resgates. Nós vamos usar 250 L de células por poço. Ambas as linhas de células será ressuspenso em um total de 3 ml de DMEM 10% FBS PS 1%.
- Ressuspender cuidadosamente cada linha de células em 10 ml de DMEM 10% FBS PS 1% em um tubo de centrifugação de 15 ml. Você terá um tubo de células 293T e um tubo de células MDCK.
- Ressuspender as células 293T em 3 ml de DMEM 10% FBS PS 1% e quando ressuspenso, entregar a 3 ml para as células MDCK para ressuspender as células. Isto lhe dará a mistura de células MDCK 293T e para ser usado para o seu co-cultura.
- Adicionar 250 mL das células 293T/MDCK por poço (10-12 junho bem-poços).
- Após 20-30 minutos de incubação RT (passo 1.3), adicionar 1 ml de DMEM 10% FBS PS 1% para a mistura de DNA OptiMEM-LPF2000-influenza plasmídeo.
- Adicione o ml 1.3 (passo 1.5) para os poços com a 250 mL de células 293T/MDCK (passo 1.4).
- Agite suavemente o 6-bem-placa e deixar a incubar transfecção overnight (ON) na incubadora a 37 ° CO C e 5% 2.
- No dia seguinte, cerca de 16-24 horas após a transfecção, alterar a mídia de transfecção e incubar as células transfectadas em DMEM BA 0,3% a 1% PS contendo 1 mg / ml de TPCK-tripsina por 48 horas.
- Após 48 horas de mudar a mídia, transferir o sobrenadante das células transfectadas em um tubo de microcentrífuga.
- Centrifugar o sobrenadante de cultura de tecidos em microcentrífuga por 1-2 minutos, 13.000 rpm.
- Infectar novas células MDCK em 6 bem-placas (banhado no dia anterior) ou ovos de 10 dias de idade embrionados de galinha com 200 mL do sobrenadante centrifugado cultura de tecidos a partir do passo 1.10. Incubar as células e / ou ovos a 37 ° C por 2-3 dias.
- Infecção de ovos de 10 dias de idade embrionados de galinha: Todos os procedimentos para infectar os ovos de galinha embrionados são realizados em condições estéreis.
- Vela os ovos de 10 dias de idade, usando uma caixa de luz candling para ver a interface entre o saco de ar e na cavidade alantóide. Faça uma marca de lápis na fronteira interface.
- Com uma agulha de seringa de 5 ml fazer um buraco na casca de ovo.
- Com uma seringa de 1 ml, infectar cada ovo com 200 mL do sobrenadante de cultura de tecidos a partir do passo 1.10.
- Cobrir o buraco na casca de ovo com cera derretida usando um cotonete.
- Incubar os ovos infectados em 37οC por 2-3 dias.
- Infecção de novas células MDCK: O dia antes da passagem do sobrenadante de cultura de tecidos a partir da 293T/MDCK co-culturas, prépare de 6 pratos bem placa com células MDCK para alcançar confluência de 80-90% no dia seguinte. Geralmente, um confluentes 100 milímetros placa de cultura de tecidos pode ser dividida em 6-8 poços. Lavar as células, duas vezes, com PBS 1X, trypsinize e preparar as placas de 6 poços. Agite suavemente com a mão as placas, a fim de ter uma distribuição uniforme das células. Cultura das células, ON, na 37 ° C incubadora, 5% CO 2. Antes da infecção, verifique as células ao microscópio para confirmar uma monocamada, então, prosseguir com a infecção:
- Lave as células, duas vezes, com 1 ml de PBS 1X.
- Infectar com o 200 mL do sobrenadante da cultura de tecidos centrifugada por 1 hora em temperatura ambiente. Não deixe que as células secas. Rock the 6-bem-placa a cada 10 minutos.
- Após uma hora de absorção viral, remova a mídia infecção das células MDCK e adicionar 2 ml de DMEM BA 0,3% a 1% PS contendo 1 mg / ml de TPCK-tripsina.
- Em 48-72 horas após a passagem, dependendo da eficiência de transfecção e da carga de vírus, um efeito citopático (CPE) será observado nas células MDCK infectados. CPE sugere um resgate bem sucedido. No entanto, um ensaio HA (seção 2) deve ainda ser realizados para confirmar a presença do vírus no sobrenadante de cultura de tecidos.
- Infecção de ovos de 10 dias de idade embrionados de galinha: Todos os procedimentos para infectar os ovos de galinha embrionados são realizados em condições estéreis.
- Colheita de fluido alantóide de ovos embrionados de galinha infectados: Todos os procedimentos para colher o fluido alantóide de ovos infectados são realizados em condições estéreis. Cerca de 8-12 ml de líquido alantóico podem ser colhidos de cada ovo de 10 dias de idade infectadas. Antes da colheita do líquido alantóico, incubar os ovos de galinha para 2 horas (ou ON) a 4 ° C para matar o embrião de galinha e coagular o sangue.
- Lavar os ovos com etanol 70% para estabelecer condições estéreis.
- Abra o ovo, com cuidado, sobre a cavidade do ar batendo com uma colher. Remova a casca quebrada com a ajuda de fórceps.
- Com uma agulha de 1 ml, retire a membrana alantóide, sem quebrar a gema do ovo.
- Estabilizar o embrião de galinha com uma espátula como você guia uma pipeta de 10 ml para o líquido alantóide. Recolher o líquido alantóico tanto quanto possível, em um tubo de centrífuga de 15 ml de gelo em um balde de gelo sem quebrar ou recolher qualquer gema do ovo. Use um tubo de centrifugação de 15 ml para cada ovo.
- Centrifugar durante 5 minutos a 4 ° C e transferir o líquido alantóico (sem ter peletizada células vermelhas do sangue) para um novo 15 tubos de centrífuga ml.
- Armazenar os tubos contendo o líquido alantóide centrifugadas a 4 ° C até que eles são verificados para a presença do vírus resgatado com um ensaio de hemaglutinação (HA).
2. HA ensaio para confirmar o resgate de vírus influenza recombinantes
Ensaio de hemaglutinação (HA) é rotineiramente usado para detectar a presença do vírus resgatados em sobrenadantes tecido MDCK cultura e / ou o fluido alantóide de ovos colhidos. Alternativamente, imunofluorescência (IFA) também pode ser realizada. Uma vez um ensaio identifica a presença do vírus resgatado, o vírus deve ser purificado e placa a composição genética do vírus será confirmada por RT-PCR e seqüenciamento.
A presença do vírus no tecido MDCK sobrenadantes de cultura e / ou no fluido alantóide de ovos infectados pode ser determinada macroscopicamente usando HA de frango (ou outra fonte) glóbulos vermelhos (RBC). A presença do vírus induz a hemaglutinação da RBC, enquanto a ausência de vírus permite a formação de uma pelota vermelha no fundo do poço (Figura 4). No caso do vírus da gripe, acredita-se que cerca de 10 3 -10 4 unidades formadoras de placa (UFP) são obrigados a dar um sinal positivo no teste de HA e, portanto, um IFA pode ser realizada em paralelo com o ensaio de HA para confirmar um resultado verdadeiro negativo. IFA com primário anti-influenza anticorpos é mais sensível que o ensaio HA porque menos de 103-104 vírus podem ser detectados com esta técnica. É possível que sobrenadantes ou líquidos alantóide que são HA-negativos são positivos pelo IFA. Neste caso, o vírus deve ser amplificada por passaging, novamente, em células MDCK ou em ovos. Líquido alantóico e / ou sobrenadantes de cultura de tecidos a partir da segunda passagem deve agora ser claramente positivo no ensaio HA.
HA ensaios são realizados em placas de 96 poços V-bottom. Negativo (por exemplo, PBS 1X) e positivo (sobrenadante de cultura de tecidos e / ou líquido alantóico de uma infecção pelo vírus influenza) amostras de controle deve sempre ser incluídos em qualquer ensaio de HA para validá-lo.
- Dispensar 50 ul de PBS 1X em cada poço da V bottom-96 poços da placa.
- Adicionar 50 ul deos sobrenadantes tecido MDCK cultura e / ou líquido alantóico dos ovos infectados para o primeiro poço e, fazer 2 diluições de série para os poços seguinte. Descartar a 50 mL extra do bem passado.
- Adicionar 50 ul de 0,5% -1,0% frango células vermelhas do sangue (preparado em PBS 1X) a cada poço.
- Incubar a V-bottom 96 poços da placa por 30-45 minutos (até um ponto vermelho é visível na parte inferior de uma amostra de controlo negativo PBS) no gelo. Ler e interpretar os resultados, conforme indicado na Figura 4.
3. Passagem de sobrenadantes de cultura de tecidos
Um resultado negativo no ensaio de HA pode ser um resultado da eficiência de transfecção baixa com baixos níveis de vírus presente estar no sobrenadantes de cultura de tecidos e / ou líquido alantóico. Passagem destas amostras em ovos frescos MDCK e / ou embrionados permitirá a amplificação do vírus (como indicado na Figura 3) As infecções são realizados conforme descrito anteriormente na seção 1.11.2.
4. Resultados representante
Resgate de vírus influenza sucesso será confirmada pela presença de um ensaio de HA positivo (Figura 4). Além disso, a existência de CPE em células infectadas com o sobrenadante de cultura de tecido ou com o fluido alantóide de ovos irá sugerir um resgate positivo viral.
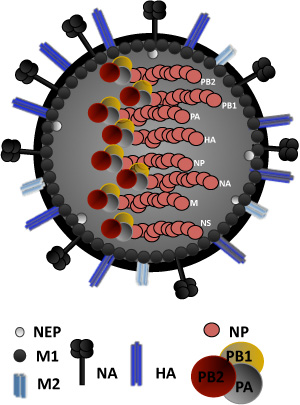
Figura 1. Influenza estrutura Virus: vírus Influenza é cercada por uma bicamada lipídica que contém as duas glicoproteínas viral (HA, NA) e, também, a proteína canal iônico, M2. HA é a proteína viral anexo, responsável pela ligação com ácido siálico contendo receptores. NA é responsável pela libertação viral a partir de células hospedeiras. Debaixo da bicamada lipídica, é uma camada de proteína composta pelo interior de proteínas da matriz superfície do envelope 1, M1, que desempenha um papel no virion montagem e brotamento ea proteína nuclear de exportação (NEP), exigido para a exportação nuclear da ribonucleocapsids viral. O núcleo do vírus é feita de um complexo ribonucleoproteína (RNP), composto de 8 de single-stranded RNA viral negativa genes encapsidated pela nucleoproteína viral, NP. Associadas com o complexo RNP são as viral RNA polimerase dependente de RNA subunidades PA, PB1, PB2 e. As proteínas não estruturais NS1 e PB1-F2, codificada pelos segmentos de RNA NS e PB1, respectivamente, não são parte da estrutura do virion.
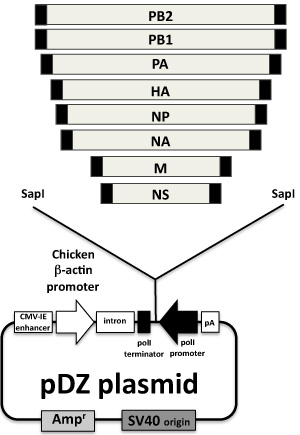
Figura 2. Plasmídeos de resgate de vírus influenza: A oito genes da influenza vírus clonados no PDZ ambisense plasmídeo são indicados. PDZ plasmídeo 6, derivado da expressão da proteína plasmídeo pCAGGs 7, é um vetor plasmídeo bidirecional com uma RNA polimerase humana Eu promotor e um rato uma sequência de terminador que codifica o RNA genômico sentido negativo, em orientação oposta à polimerase I unir, uma polimerase II cassete de transcrição (promotor de frango β-actina e poli) codifica as proteínas virais do mesmo gene viral. cDNAs de cada segmento viral são gerados por RT-PCR com primers frente e verso contendo o Sapi site de endonuclease de restrição e as regiões não-codificadoras de cada segmento (caixas-pretas no final dos genes virais). O produto da PCR é clonado no PDZ digerido com Sap-I.
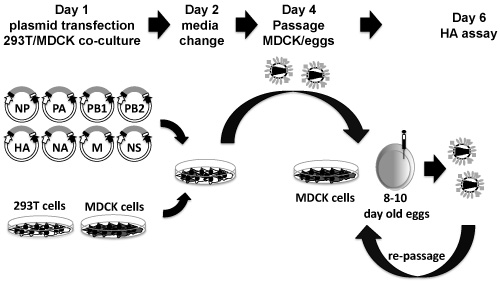
Figura 3. Oito plasmídeo baseado em sistema de resgate influenza: PDZ plasmídeos contendo os genes 8 influenza viral são co-transfectadas, em suspensão, em 293T-MDCK células co-culturas (dia 1). Vinte e quatro horas após a transfecção, mídia sem FBS, mas contendo TPCK / tripsina é substituído (dia 2). Quarenta e oito horas após mudar a mídia, o sobrenadante de cultura de tecidos é colhida e utilizada para infectar células MDCK ou 10 dias de idade, ovos de galinha embrionados (dia 4). 48-72 horas pós-amplificação, sobrenadantes de cultura de tecidos de células infectadas ou MDCK líquido alantóico de ovos são colhidas e analisadas para a presença do vírus por HA (dia 6). Se nenhum vírus é detectado, os sobrenadantes mesmo e / ou líquidos alantóico podem ser re-frescos várias passagens em células MDCK e / ou ovos embrionados.
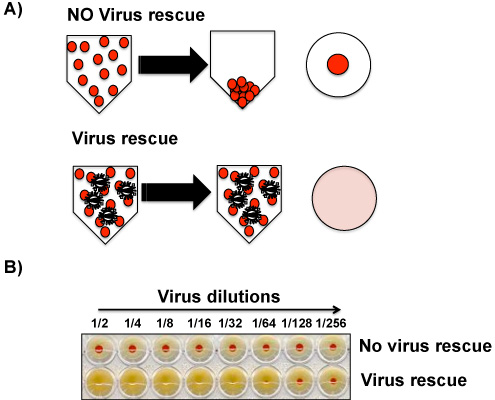
Figura 4. Hemaglutinina ensaio (HA): Hemaglutinação da RBC por partícula do vírus é visível macroscopicamente e é a base para detectar partículas virais em sobrenadante de cultura de tecidos e / ou líquidos alantóide. Embora o ensaio de HA não discrimina entre as partículas virais que são infecciosas e partículas que estão degradadas e não é capaz de infectar as células, o ensaio é um bom indicador da presença de vírus em amostras. A) Ausência (parte superior) da presença (em baixo) do vírus nas amostras biológicas é determinado pela presença de glóbulos vermelhos no fundo do prato ou a sua ausência, respectively. B) Um resultado representante de um ensaio HA sem níveis detectáveis de vírus (superior) ou presença (parte inferior) do vírus é mostrado.
Discussão
Resgate de vírus influenza recombinante de DNA plasmídeo é um processo simples e direta uma vez que o protocolo é realizada rotineiramente no laboratório, mas no início, várias coisas podem dar errado. É imperativo ter boa preparação plasmídeo para gerar o vírus. Manutenção adequada das linhas celulares (293T e MDCK) é crucial para um resgate bem sucedido viral. Tradicionalmente, uma marca genética é inserido em um gene que codifica a gripe-plasmídeo, por mutagênese em silêncio. Introdução desta mu...
Divulgações
Agradecimentos
Os autores querem agradecer aos membros do passado e presente na Adolfo García-Sastre e Peter Palese laboratórios para o desenvolvimento de técnicas de genética e reverter influenza plasmídeos. Pesquisa em laboratórios AG-S é parcialmente financiado pelo CRIP, um Centro de NIAID-financiado de Excelência para Pesquisa e Vigilância da Influenza (HHSN266200700010C) e por doações NIAD R01AI046954, U01AI070469 e P01AI058113. Pesquisa em LM-S laboratório é parcialmente financiado pelo NIAID conceder RO1AI077719.
Materiais
Linhagens de células
293T (número de catálogo CRL-11268) e MDCK (número de catálogo CCL-34) linhas celulares são mantidos em uma incubadora de 37 ° C com 5% de CO 2 em DMEM 10% FBS, PS 1%. Células são formulário disponível a Coleção American Type Culture (ATCC, 10.801 University Boulevard Manassas, VA. 20110-2209 EUA).
Ovos de galinha embrionados
Embrionados ovos de 10 dias de idade de frango pode ser obtido a partir de Charles River Laboratories, Abastecimento aviária Specific Pathogen Fee (SPAFAS) Produtos e Serviços aviária. Franklin Commons, 106 Route 32, North Franklin, CT 06254 EUA. Os ovos são incubados a 37 ° C antes e após a infecção viral. Antes e após a infecção viral, os ovos são candled para determinar a viabilidade dos embriões. É muito importante olhar para os ovos mortos antes e após a infecção viral. Antes da infecção um ovo de mortos pode ser facilmente localizados pela ausência de vasos sanguíneos, bem como a ausência de mobilidade do embrião. Quando candled, embriões vivos movimento. Após a infecção viral um ovo morto (provavelmente relacionado à infecção pelo vírus influenza) vai ser facilmente localizados pela aparência ruim do ovo como visto pelo volume menor e mais sangrenta de líquido alantóico. Infectados de ovos são descartadas em dois sacos autoclaváveis e autoclavada seguintes procedimentos padrão.
Células vermelhas do sangue de galinha (RBC)
Chicken RBC pode ser comprado de Fazendas Truslow, 201 Valley Road, Chestertown, Md 21.620. Armazenar a 4 ° C. Para ensaios de HA, lavar 5 ml da RBC frango com 45 ml de PBS 1X em um tubo de centrífuga de 50 ml. Centrifugar durante 5 minutos a 1000 rpms, RT. Descartar cuidadosamente o sobrenadante e use uma diluição 1:1000 da RBC peletizada em PBS 1X (concentração final de RBC 0,5-1,0%).
Sobrenadantes de cultura de tecidos e fluidos alantóide
Ambos, sobrenadantes de cultura de tecidos e fluidos alantóico podem ser armazenados a 4 ° C por um curto período de tempo. Após a confirmação de resgate de vírus, vírus de sobrenadantes de células ou líquido alantóico são armazenadas a -80 ° C.
Plasmídeos
Todos os plasmídeos são preparadas usando um plasmídeo recomendações maxi fabricante seguinte kit. Todos os plasmídeos são alíquota em concentrações de 1 mg / ml em DDH 2 O e armazenadas a -20 ° C. De curto prazo de armazenamento, o plasmídeo pode ser manter a 4 ° C. A concentração do DNA purificado plasmídeo é determinado por espectrofotometria a 260 nm, com pureza de ser estimada utilizando a proporção nm 260:280. Preparações com 1,8-2,0 nm 260:280 índices são considerados apropriados para fins de resgate de vírus. Além disso, concentração e pureza plasmídeo devem ser confirmados com agarose gel cromatografia. Ambisense PDZ plasmídeos (6) contendo os oito genes da influenza A/PR/8/34 viral (7) são ilustrados na Figura 2.
Vírus
O protocolo descrito de emergência da gripe A/PR/8/34 pode ser realizada sob nível de biossegurança (BSL) 2 condições. Material contaminado, incluindo sobrenadantes de cultura de tecidos e ovos embrionados, devem ser esterilizados antes da eliminação. Resgate de vírus da gripe pode exigir outras condições BSL maior e, portanto, condições especiais / medidas de segurança terão de ser seguidas.
Tecido meios de cultura e soluções
DMEM 10% FBS PS 1%: 445 ml meio modificado Dulbecco Águia (DMEM), 50 ml de soro fetal bovino (FBS), e 5 ml de 100X Penicilina / Estreptomicina (PS). Armazenar a 4 ° C. Essa mídia será usada para manter as células MDCK e 293T, bem como para a transfections. DMEM BA 0,3% a 1% PS: 495,7 ml de DMEM, 4,3 ml de 35% de albumina bovina (BA). Armazenar a 4 ° C. Pouco antes de usar, adicione TPCK tripsina tratada para uma concentração final de 1 mg / ml. Media infecciosas.
Fosfato 10X solução salina tamponada (PBS): 80 g de NaCl, 2 g de KCl, 11,5 g de Na 2 HPO 4 .7 H 2 O, 2 g de KH 2 PO 4. Adicionar DDH 2 O até 1 litro. Ajustar o pH para 7,3. Esterilizar em autoclave. Conservar à temperatura ambiente.
1X PBS: Diluir 1:10 com PBS 10X DDH 2 O. Esterilizar em autoclave e armazenar em temperatura ambiente.
Referências
- Neumann, G., Watanabe, T., Ito, H., Watanabe, S., Goto, H., Gao, P., Hughes, M., Perez, D. R., Donis, R., Hoffmann, E., Hobom, G., Kawaoka, Y. Generation of influenza A viruses entirely from cloned cDNAs. Proc Natl Acad Sci U S A. 96, 9345-9350 (1999).
- Fodor, E., Devenish, L., Engelhardt, O. G., Palese, P., Brownlee, G. G., Garcia-Sastre, A. Rescue of influenza A virus from recombinant DNA. J Virol. 73, 9679-9682 (1999).
- Martinez-Sobrido, L., Garcia-Sastre, A. Recombinant influenza virus vectors. Future Virology. 2, 401-416 (2007).
- Palese, P., Shaw, M. L., Knipe, D. M., Howley, P. H. Orthomyxoviridae. The viruses and their replication. Fields Virology. , 1647-1689 (2006).
- Schickli, J. H., Flandorfer, A., Nakaya, T., Martinez-Sobrido, L., Garcia-Sastre, A., Palese, P. Plasmid-only rescue of influenza A virus vaccine candidates. Philos Trans R Soc Lond B Biol Sci. 356, 1965-1973 (2001).
- Quinlivan, M., Zamarin, D., Garcia-Sastre, A., Cullinane, A., Chambers, T., Palese, P. Attenuation of equine influenza viruses through truncations of the NS1 protein. J Virol. 79, 8431-8439 (2005).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108, 193-199 (1991).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados