Method Article
A Técnica de Janela crânio-fino para Crônica de dois fótons In vivo Imaging da Microglia murino em Modelos de Neuroinflammation
Neste Artigo
Resumo
Nós descrevemos um método para visualizar repetidamente microglia murino e monócitos circulantes In vivo Durante horas, dias ou semanas usando microscopia de dois fótons transcraniana. Demonstramos como preparar uma janela diluído crânio-que permite a observação intermitente de microglia quiescentes que podem ser ativadas por meio de injeção estereotáxica adjacentes do Tat do HIV-1 proteína reguladora.
Resumo
Tradicionalmente, na neurociência, in vivo dois fótons imagem do sistema nervoso central de murinos tem ou envolveu o uso de crânio aberto 1,2 ou diluído crânio-3 preparativos. Enquanto a técnica do crânio aberto é muito versátil, não é ideal para estudar microglia porque é invasivo e pode causar a ativação da microglia. Mesmo que a abordagem crânio-diluído é minimamente invasivo, o re-repetido afinamento do crânio necessárias para imagens crônica aumenta os riscos de lesão tecidual e ativação da microglia e permite um número limitado de sessões de imagem. Aqui apresentamos um método janela crônica crânio-fino para monitoramento microglia murino in vivo durante um período prolongado de tempo usando dois fótons de microscopia. Demonstramos como preparar um estável, acessível, janela diluído crânio-cortical (TSCW) com uma lamela de vidro translúcido apposed que permanece ao longo de três semanas de observação intermitente. Esta preparação é muito mais TSCW imunologicamente inerte com relação à ativação da microglia de craniotomia aberta ou crânio repetidas desbaste e permite um número arbitrário de sessões de imagem durante um período de semanas. Nós preparamos TSCW em CX 3 CR 1 GFP / 4 + camundongos para visualizar microglia com a proteína verde fluorescente melhorada para ≤ 150 M abaixo da superfície pial. Mostramos também que esta preparação pode ser usado em conjunto com injeções cerebral estereotáxica da proteína HIV-1 Tat neurotóxicos, ao lado do TSCW, que é capaz de induzir microgliosis duráveis. Portanto, esse método é extremamente útil para analisar mudanças na morfologia e motilidade microglial ao longo do tempo no cérebro vivo em modelos de HIV Disorder Associated neurocognitivos (de mão) e outras doenças neurodegenerativas com um componente neuroinflamatórias.
Protocolo
1. Preparando o animal for Imaging
- Em nossos experimentos, usamos adulto CX 3 CR 1 camundongos GFP / + que expressam GFP em linhagens de células mononucleares, incluindo microglia. Quatro cepas diferentes de camundongos podem ser usados para atender as necessidades de um projeto específico.
- Anestesiar o rato com uma injeção intraperitoneal de um coquetel de drogas três consistindo de 0,05 mg / kg de fentanil, 5,0 mg / kg midazolam e 0,5 Medetomidine mg / kg. 5 preparação cirúrgica para TSCW começa depois que o animal já não responde a estímulos dolorosos, como como uma pitada de cauda. Durante toda a cirurgia e de imagem, podemos manter o animal em uma almofada de aquecimento para evitar a hipotermia pós-anestésica. Se necessário, uma dose de reforço de um terço da dose original do cocktail anestésico pode ser dada para restaurar o plano anestésico original.
- Cobrir os olhos do animal com uma pomada oftálmica de proteção para manter os olhos úmidos durante a anestesia, que suprime reflexo do animal piscar. Remover os pêlos do couro cabeludo do animal usando uma navalha, tesoura, tesoura, ou métodos químicos. Desinfectar o couro cabeludo usando a 10% de solução de iodo-povidona e álcool 70%. Todos os instrumentos cirúrgicos precisam ser autoclavado, esterilizado com um esterilizador de bolas de gude, ou desinfetados com álcool 70%.
- Faça uma incisão na linha média do couro cabeludo com uma tesoura pequena, começando 4-5 mm caudal ao crânio e avançando para a frente a frente dos olhos. É importante que esta incisão ser longa o suficiente para que a pele não irá interferir com a colagem da chapa de cabeça que é usado para estabilizar a cabeça de rato durante dois fótons de imagem (Figura 1). Identificar a área a ser diluído em um escopo de dissecação. Evitar áreas de interesse localizado directamente sobre suturas cranianas, como o crânio é menos estável nessas áreas e subjacentes grandes vasos e meninges irá interferir com a imagem.
- Aplicar o etanol 100% seguido pela solução de 10% de cloreto férrico com um cotonete estéril para secar as membranas no topo do crânio e raspar-los usando uma pinça fina ou uma lâmina de barbear. A não remoção dos resultados membranas em anexo instável cabeça prato.
- Coloque uma fina camada da cola 910 Permabond em torno das bordas da janela de visualização por baixo da placa de cabeça. Coloque o prato a cabeça coberta com cola sobre a área de interesse no crânio do animal com uma leve pressão (Figura 1). É importante que a placa de cabeça é apenas colado ao osso do crânio. Toda a pele ou membranas que estão presos entre a placa de cabeça e do crânio vai diminuir a estabilidade do vínculo. Aplique uma pequena quantidade de acrilato de volta a janela de visualização usando uma seringa para instantaneamente cola forte o laço. Finalmente, aplique uma pequena quantidade de Loctite 454 para as bordas da janela de visualização para evitar vazamentos.
- Parafuso da placa de cabeça para o titular animal (Figura 1) e verificar a estabilidade da placa de cabeça sob um escopo dissecção por sondagem levemente com um par de fórceps. Não deve haver nenhum movimento do crânio em relação à placa cabeça. Coloque uma gota de solução salina sobre a janela de visualização para garantir que não haja vazamentos.
2. Preparando a janela de Crânio afinado Cortical
- Em preparação para o desbaste do crânio, o crânio seco, utilizando uma combinação de cotonetes estéreis e ar comprimido. Inicialmente fina do crânio com uma broca estéril IRF 007 em uma broca II Microtorque fixada em 4000 rpm. Muito gentilmente, comece diluindo uma área de 2-2,5 mm de diâmetro circular do crânio. Use apenas a luz movimentos arrebatadores quase paralelo ao crânio; usar nenhuma pressão direta descendente. Parar de perfuração a cada 20-30 segundos para remover o pó de osso usando o ar comprimido. Estas pausas na perfuração de permitir que o crânio para esfriar para que não haja danos causados pelo calor induzida ao tecido cerebral subjacente.
- Como a perfuração avança, notar a transição para a camada de osso esponjoso úmido (ou seja, o "díploe"). Uma vez que esta camada é atingido, cuidado extra com a broca.
- Ocasionalmente verificar a espessura do crânio, colocando soro fisiológico sobre a área de desbaste e visualização no âmbito de dissecação. Solução salina fim de permitir a dissipação de calor. Como o crânio é diluído, menor vasculatura se torna visível.
- Use uma MicroBlade estéril dental para alcançar a final de desbaste em solução salina, como o MicroBlade fornece um feedback muito mais tátil sobre a estabilidade do crânio. Isto permite uma preparação muito mais fino do que com a broca sozinho. A partir de nossa experiência, a espessura do crânio ideal é 10-30 mM.
- É importante verificar a espessura do crânio sob epifluorescência várias vezes durante as primeiras tentativas em fazer uma janela de crânio fino. A nitidez ea profundidade da microglia visível e vasculatura dão uma boa indicação de quando a janela está pronta para a imagem latente.
- Quando a janela está pronto, cola um pedaço custom-made retangular de # 0 lamela wi ª uma dimensão inferior a 2 mm de cada lado sobre a janela. Usando uma pipeta de vidro 1,0 milímetros de diâmetro, coloque uma pequena gota de cola de cianoacrilato sobre a área do crânio diluído e cuidadosamente mais abaixo, no pequeno pedaço de lamínula, em seguida, pressione suavemente contra o crânio para espremer excesso da cola. É importante para evitar a formação de bolhas entre o vidro ea cola já que o ar aprisionado fará com que a área sob a tornar-se opticamente opaca. A cola de cianoacrilato é usado porque ele permanece transparente quando seca e também evita óssea e regeneração da membrana mantendo o crânio sob a janela fina e translúcida. Se há alguma cola em cima da tampa de vidro, use o MicroBlade para remover cuidadosamente uma vez a tampa de vidro está no lugar e que a cola está seca.
- Um analgésico (por exemplo, a Buprenorfina 2 mg / kg sub-cutânea) é administrado imediatamente após a cirurgia e re-administrada em qualquer sinal de dor, incluindo relutância em se movimentar, comer ou beber, perda de peso, salivação, piloereção, sons respiratórios, etc
3. Dois fótons de imagem
- Em preparação para dois fótons de imagens, cobrir o TSCW com solução salina e localizar a área de interesse sob epifluorescência (Figura 2). Para habilitar a imagem posterior da área, tirar uma foto com uma câmera fotográfica.
- Por dois fótons de imagens, usamos uma custom-made microscópio de dois fotões 6, com um Ti: Sapphire a laser sintonizado nm 920. Fluorescência é detectada por meio de um tubo fotomultiplicador em todo o campo modo de detecção e um filtro de emissão 580/180. A lente de 20X imersão em água (0,95 NA) é usado durante toda a sessão de imagens. A potência máxima da potência do laser para o objetivo está definido entre 50 e 65 mW.
- Selecione uma área de interesse em camadas cortical I ou II (até 150 M abaixo da superfície pial). Para facilitar a re-imagem, tirar fotos do mesmo campo de visão em 1X, 2X, 3X e zoom digital. Vasos sanguíneos podem servir como pontos de referência para mais facilmente encontrar o mesmo campo de visão durante as sessões de imagem subseqüentes. De acordo com um zoom de 3X, várias pilhas com z-80-90 Z-passos em cada pilha e um passo mM 0,69 podem ser adquiridos a cada 5 minutos até 30 minutos, o que permite uma boa amostragem da morfologia da microglia e comportamento ao longo do tempo ( Figura 3). Entre as aquisições de z-stacks, deve-se verificar o nível de solução salina sobre a TSCW, bem como a profundidade do animal de anestesia.
4. Injeção da neurotoxina HIV-1, Tat
- Primeiro, silanizadas o revestimento interno de uma agulha de calibre 35 e seringa de 10 mL Microvolume para evitar deposição de Tat. Retirar a solução silanizing (Sigmacote) até encher tanto a agulha e seringa. Deixar a solução descansar por 5 minutos em temperatura ambiente. Esvaziar a solução da seringa, retire o êmbolo, e permitir que a seringa ea agulha para secar completamente. Finalmente, lave a seringa ea agulha cuidadosamente com água deionizada.
- Realizar uma pequena craniotomia 0,5 mm de diâmetro ou três milímetros rostral ou lateral para o TSCW onde dois fótons imagens foram obtidas, usando um pouco menor broca e com cuidado afinando o crânio até um par de fórceps com pontas afiadas podem remover a camada diluída de osso-se facilmente. Nós usamos uma seringa de 10 mL Microvolume equipado com agulha de calibre 35 controlado por uma bomba de seringa Ultramicropump III montado em um micromanipulador de 3 eixos e depois alinhando a ponta da agulha para a craniotomia, é cuidadosamente avançados a uma profundidade de 700-900 mM abaixo a superfície pial onde 3 mL Tat 1-72 (ou outros agentes pró-inflamatórios) ou salina (ou veículo de controle) é entregue a 80 nL / min.
5. Alojamento dos animais
- Se o animal está a ser trabalhada várias vezes em um único dia, cobrir a área aberta do crânio com uma mistura de vaselina e pomada oftálmica para evitar desconforto ou danos ao crânio entre as sessões de imagem. Desligue a ponte o apoio da pequena cabeça-placa (ver Figura 1B) e colocar o animal em uma gaiola com o alimento aquecido facilmente acessível e água. Todos os animais devem ser alojados individualmente após a cirurgia em todos os momentos. Uma vez que as sessões de imagem para um animal são completas para um determinado dia, retire cuidadosamente toda a cabeça de chapa e sutura na pele para trás sobre o crânio com # 6 ou menor de sutura. Mais uma vez, abrigam os animais individualmente com alimentos de fácil acesso e água entre os dias experimental. Verifique diário dos animais para todos os sinais de estresse, dor ou infecção.
6. Resultados representante
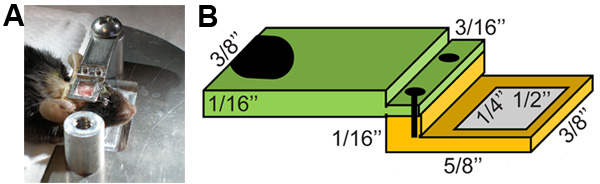
Figura 1. Estabilização do animal para cirurgia e de dois fótons de imagem (A) e design cabeça de chapa (B).
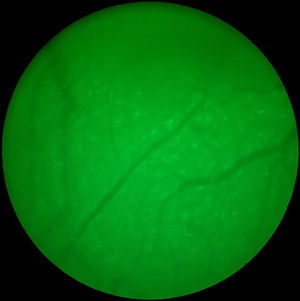
Figura 2. GFP-rotulados microglia visualizado com epifluorescência.
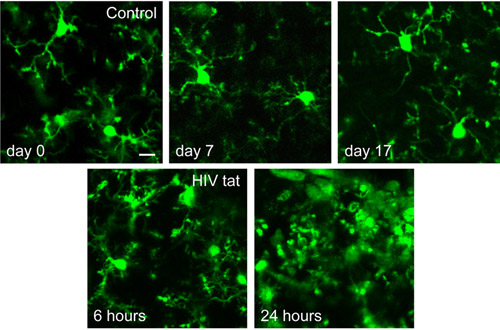
Figura 3. GFP-rotulados microglia visualizado com dois fótons de imagem após a implantação do TSCW, aproximadamente 50 mm abaixo da superfície pial. O single de dois fótons seções tomadas 15-30 minutos após o implante da TSCW (dia 0), bem como 7 e 17 dias depois, demonstrar que as janelas fica clara quando microglia permanecem inativados na ausência de insultos inflamatórios. O z-projeções tomadas 6 e 24 horas pós-injeção da neurotoxina HIV tat exibem impressionante alterações morfológicas da microglia ativada. Barra de escala: 10 mM.
Discussão
Há um consenso crescente de que o substrato real para HIV-1 déficits cognitivos associados (mão) é a destruição da arquitetura sináptica, presumivelmente causado por mediadores pró-inflamatórios liberados a partir de HIV-1 infectados fagócitos mononucleares. Ativação da microglia, células gigantes multinucleadas, e gliose devido à hipertrofia astrocitária são considerados inespecíficos marcas de HIV-1 infecção e inflamação nos 7 CNS. Em contraste, a gravidade da doença neurológica pré-mortem tem sido correlacionada com a perda de complexidade sináptica, bem como ônus de macrófagos na 8,9,10,11 CNS. No entanto, as interações dinâmicas entre microglia, infiltração de macrófagos periféricos e os neurônios de pacientes com HAND simplesmente não pode ser modelada utilizando o processamento estáticos convencionais obtidos a partir de estudos imunocitoquímicos convencionais. Estudos recentes de nosso laboratório sugerem que pelo menos algumas dessas interações entre periférico e central células mononucleares e os neurônios podem ser modelados em parte pela injeção estereotáxica do HIV-1 proteína Tat 1-72 em parênquima cerebral (Lu, Marker, Tremblay, Qi, e Gelbard, dados não publicados). Por isso, decidiu aplicar in vivo de imagens de dois fótons para examinar a interação entre macrófagos derivados de monócitos, micróglia residente cérebro e neurônios, em um modelo animal dócil pequeno para neuroAIDS. Enquanto os preparativos crânio-aberto ou diluído crânio-pagar um exame único de arquitetura cortical por um breve período de tempo (horas), os investigadores interessados no curso de tempo de eventos subaguda não pode usar estas preparações sem artificialmente a ativação da microglia / macrófagos devido à manipulação cirúrgica de a janela calvária. Aqui nós demonstramos uma forma simples de contornar estas limitações colando um pequeno pedaço de lamínula de vidro sobre a área crânio diluído impedindo a regeneração da calvária no TSCW bem como a manutenção translucidez para ≥ 3 semanas. Nós ainda demonstrar que esta técnica nos permite monitorar o comportamento dos monócitos periféricos que entram microvasculatura cerebral, bem como cérebro microglia residente em resposta à injeção estereotáxica de HIV Tat 1-72 no córtex de camundongos heterozigotos para CX 3 CR 1 / GFP ( para identificar as células da linhagem mononuclear). Esta técnica pode ser facilmente adaptado para uso em camundongos com diferentes origens genéticas, por exemplo, que usam rotineiramente heterozigotos CX 3 CR 1 / X GFP Thy-1 YFP 12 camundongos para investigar as interações entre macrófagos derivados de monócitos, micróglia residente cérebro e neurônios em modelos in vivo de neuroinflamação relevantes à mão. Nossa preparação TSCW permite que pesquisadores para estudar interações célula-célula entre a periferia eo SNC que podem ocorrer em períodos de semanas, no qual o animal pode ser repetidamente fotografado antes e após tratamento experimental. Assim, cada animal pode servir como seu próprio controle. Uma ressalva para este modelo TSCW é que as células-alvo sob investigação devem ser geneticamente modificados para expressar melhor as proteínas fluorescentes (eXFP) ou ser rotulados com um corante fluorescente sem violação mecânica da calvária, e que a expressão eXFP deve ser robusta o suficiente para permitir arquitetura celular a ser visualizados após sessões de imagem repetida durante um período de semanas.
Divulgações
Agradecimentos
Agradecemos a Emily A. Kelly para o design da placa cabeça.
Estamos gratos pelo apoio de prêmios NIH para HAG: PO1 MH64570, RO1 MH56838, RO1 MH078989, R21 MH03851 eo apoio generoso do Fundo de Neurologia Pediátrica Geoffrey Waasdorp sem a qual este trabalho não teria sido possível. AKM é financiado pelo NIH (EY019277), Fundação Whitehall, o Alfred P. Sloan Foundation e um prémio de carreira em de Ciências Biomédicas da Burroughs Wellcome Fund. MET é financiado por um de Fonds la recherche en sante du Quebec (FRSQ) prêmio de treinamento pós-doutorado. DFM é um estagiário no Programa de Formação Médica Scientist, financiado pelo NIH T32 e T32 GM07356 AI049815.
Materiais
| Name | Company | Catalog Number | Comments |
| Fentanyl Citrate | Hospira Inc. | ||
| Midazolam hydrochloride | Baxter Internationl Inc. | ||
| Medetomidine hydrocholoride (Domitor) | Pfizer Pharma GmbH | ||
| Heating pads | Beyond Bodi Heat | ||
| Tobramycin and dexamethasone ophthalmic ointment (TobraDex) | Alcon | ||
| Povidone-iodine 10% solution | Betadine Puredue Pharma | ||
| Ferric chloride 10% solution | Ricca Chemical Company | 3120-32 | |
| Methyl cyanoacrylate 910 | Permabond | ||
| Cyanoacrylate 454 | Loctite | ||
| TEETS denture material crosslinking methyl methacrylate | Co-Oral-lte Dental Mfg CO | ||
| Microtorque II handpiece kit | Pearson Assessments | R14-0002 | |
| IRF 007 drill bits | Fine Science Tools | 19008-07 | |
| Norland bendable microblade full radius | Salvin Dental | BLAD-NORLAND-69 | |
| Cyanoacrylate | The Original Superglue | ||
| #0 glass coverslip | Electron Microscopy Sciences | 63750-01 | |
| 10 μl Microvolume syringe | World Precision Instruments, Inc. | ILS010LT | |
| UltraMicroPump III | World Precision Instruments, Inc. | UMP3-1 | |
| 35 gauge NanoFil needle | World Precision Instruments, Inc. | NL35BL-2 | |
| Ball Mill, Carbide bits #1/4 | World Precision Instruments, Inc. | 501860 | |
| Sigmacote | Sigma-Aldrich | SL2-100 | |
| Photomultiplier tube | Hamamatsu Corp. | HC125-02 | |
| Ti:Sapphire laser Mai-Tai | Newport Corp. |
Referências
- Mostany, R., &, P. ortera-C. ailliau, C, A craniotomy surgery procedure for chronic brain imaging. J Vis Exp. 12, (2008).
- Holtmaat, A. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat Protoc. 4, (2009).
- Yang, G. Thinned-skull cranial window technique for long-term imaging of the cortex in live mice. Nature Protoc. 5, 213-21 (2010).
- Jung, S. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Mol Cell Biol. 20, 4106-41 (2000).
- Mrsic-Flogel, T. D. Homeostatic regulation of eye-specific responses in visual cortex during ocular dominance plasticity. Neuron. 54, 961-96 (2007).
- Majewska, A., Yiu, G., &, Y. uste, R, A custom-made two-photon microscope and deconvolution system. Pflugers Arch. 441, 2-3 (2000).
- Sharer, L. R. Pathology of HIV-1 infection of the central nervous system. A review. J Neuropathol Exp Neurol. 51, (1992).
- Everall, I. P., Aliberti, J., &, B. alcerzyk, M, Neuronal density in the superior frontal and temporal gyri does not correlate with the degree of human immunodeficiency virus-associated dementia. Acta Neuropathol (Berl. 88, 538-53 (1994).
- Masliah, E., Banati, R. B., &, Q. uinlan, M, E. Dendritic injury is a pathological substrate for human immunodeficiency virus-related cognitive disorders. Ann Neurol. 42, 963-96 (1997).
- Everall, I. P., Banati, R. B., &, U. pender, B, M. Cortical synaptic density is reduced in mild to moderate human immunodeficiency virus neurocognitive disorder. Brain Pathol. 9, (1999).
- Glass, J. D., Fedor, H., Wesselingh, S. L., &, M. cA. rthur, C, J. Immunocytochemical quantitation of human immunodeficiency virus in the brain: correlations with dementia. Ann Neurol. 38, (1995).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados