É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento axoplasma de nervo ciático do rato
Resumo
Demonstramos um protocolo para o isolamento axoplasma do nervo ciático de ratos adultos com base na dissecação de fascículos do nervo e incubação em meio hipotônico para liberar mielina e lise não-axonal estruturas, seguida de extração dos restantes materiais axônio enriquecido.
Resumo
Isolamento do citoplasma axonal puro (axoplasma) de nervo periférico é fundamental para estudos bioquímicos de muitos processos biológicos. Neste artigo, vamos demonstrar e descrever um protocolo para o isolamento axoplasma do nervo ciático de ratos adultos com base nas seguintes etapas: (1) dissecção dos fascículos do nervo e separação do tecido conjuntivo, (2) de incubação de pequenos segmentos de fascículos nervosos em meio hipotônico a liberação de mielina e lise não-axonal estruturas, e (3) extração do material axônio enriquecido restantes. Caracterização proteômica e bioquímica desta preparação confirmou um alto grau de enriquecimento para componentes axonal.
Protocolo
Este protocolo permite o isolamento axoplasma com minimização de contaminação dos tecidos gliais e vasculares. O método rende aproximadamente 70-100 mg de proteína total por um axoplasma 10/08 ratos Wistar semanas de idade.
1. Dissecar nervo ciático
- Euthanize dois ratos por inalação de CO 2 seguido por deslocamento cervical. Confirmar a morte pela palpação por falta de batimentos cardíacos antes do início dissecção.
- Swab a área de dissecção com etanol 70%.
- Cortar a pele, músculos separar e isolar do nervo isquiático com tesoura e pinça com cuidado, sem danificar os vasos sanguíneos. Dissecar ambos os nervos ciático (cerca de 1,5 cm cada) de cada animal e recolher todos os quatro nervos em um eppendorf com 500 mL PBS 0,2 X + inibidores, conservados no gelo.
- Transferir os segmentos nervosos para pratos de plástico contendo pelo menos 2 mL de PBS + 0,2 X inibidores da protease.
- Remover o epineuro dos nervos usando uma pinça fina no âmbito binocular. Separar os fascículos com muito cuidado até que se tornem nublado e começar a flutuar na superfície da solução. Esta etapa deve ser praticado até que possa ser realizada com rapidez e precisão (não tendo mais de 10 min por nervo).
2. Lavar incubação, e eluição
- Transferência de fascículos separados para um novo tubo Eppendorf com 500 mL de PBS contendo inibidores da protease de 0,2 para a incubação por 2 horas em temperatura ambiente.
- Lavar pelo menos 3 vezes com 1 mL do mesmo tampão, transferindo os fascículos a partir de tubo eppendorf para tubo eppendorf e agitação por 5 min após a transferência.
- Para remover o excesso de líquido colocar os fascículos em um tubo eppendorf novo vazio e depois transferir os fascículos para um tubo eppendorf novo com 300 mL de PBS 1X contendo inibidor da protease para a incubação por 20-30 min em temperatura ambiente.
- Centrifugar 10 min a 10.000 xg, a 4 ° C.
- Leve o sobrenadante e concentração de proteína medida. Esta é a sua preparação axoplasma.
3. Resultados representante
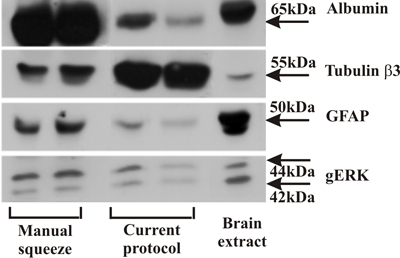
Figura 1. Ocidental axoplasma blot comparando isolados pelo método de aperto manual com amostras axoplasma isolado como mostrado neste protocolo. Observe a redução dos níveis de albumina e GFAP, representando proteína do sangue e contaminações de células gliais, respectivamente. Em contraste, axonal tubulina b3 é enriquecida nesta preparação, o que indica um alto nível de proteínas axonal.
Discussão
Análises bioquímicas e proteômica confirmaram que este procedimento reduz a contaminação de células gliais soro e 3 em relação aos métodos descritos anteriormente para o isolamento por axoplasma espremer mecânica 1. Nós temos usado esse protocolo de isolamento axoplasma para explorar dineína baseado sinalização retrógrada após a lesão do nervo ciático 2, e esperar que ela tenha utilidade na exploração de muitos outros processos no nervo periférico de adultos, incluin...
Divulgações
Materiais
- Ratos Wistar (80-10 semanas)
- PBS 0,2 X e PBS 1X soluções contendo inibidores da protease (Roshe) 2 comprimidos por 50 ml
- Eppendorfs por 1,5 ml
- Pratos de plástico esterilizado 35 milímetros
- Ferramentas de dissecação, incluindo: uma tesoura e uma pinça fina
- Luz binocular e tabela
Anticorpos
Clone de rato anti-GFAP GA-5 foi da Sigma (G6171). Coelho anti-albumina foi de Cedarlane (CLAG5140). Β3 rato anti-tubulina e coelho anti-Gerk eram da Sigma (T2200 e M5670, respectivamente).
Referências
- Hanz, S., Perlson, E., Willis, D., Zheng, J. Q., Massarwa, R., Huerta, J. J., Koltzenburg, M., Kohler, M., van-Minnen, J., Twiss, J. L. Axoplasmic importins enable retrograde injury signaling in lesioned nerve. Neuron. 40, 1095-1104 (2003).
- Michaelevski, I., Medzihradszky, K. F., Lynn, A., Burlingame, A. L., Fainzilber, M. Axonal transport proteomics reveals mobilization of translation machinery to the lesion site in injured sciatic nerve. Mol Cell Proteomics. 9 (5), 976-987 (2010).
- Rishal, I., Michaelevski, I., Rozenbaum, M., Shinder, V., Medzihradszky, K. F., Burlingame, A. L., Fainzilber, M. Axoplasm isolation from peripheral nerve. Dev Neurobiol. 70, 126-133 (2010).
- Twiss, J. L., Fainzilber, M. Ribosomes in axons--scrounging from the neighbors. Trends Cell Biol. 19, 236-243 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados