É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento e Cultura da Avian embrionárias Células Progenitoras Valvular
Neste Artigo
Resumo
Este artigo irá fornecer um método para isolar e cultura de codorna ou frango HH14 - Células de válvulas do endocárdio e HH25 células mesenquimais válvula de amortecimento.
Resumo
Adequada formação e função das válvulas cardíacas embrionárias é fundamental para a progressão de desenvolvimento. O coração embrionário é um tubo em forma de U do endocárdio cercado por miocárdio. O miocárdio secreta cardíaca geléia, um ácido hialurônico rico em matriz gelatinosa, na junção atrioventricular (AV) e via de saída (OFT) lúmen. No estágio HH14 valvulogênese começa quando um subconjunto de células endocárdicas receber sinais do miocárdio, submetidos à transformação do endocárdio mesenquimais (EMT), e invadir a geléia cardíaca. No estágio HH25 as almofadas valvular são totalmente mesenchymalized, e é esta mesênquima que, eventualmente, as formas do aparelho valvar e septal do coração. Compreensão dos mecanismos que iniciam e modulam o processo de diferenciação celular e EMT são importantes por causa de sua conexão com graves defeitos cardíacos congênitos. Neste estudo, apresentamos métodos para isolar pré-EMT endocárdicas e células mesenquimais pós-EMT, que são os dois fenótipos celulares diferentes da almofada prevalvular. Células pré-EMT endocárdica podem ser cultivadas com ou sem o miocárdio. Pós-EMT células mesenquimais almofada AV podem ser cultivadas géis de colágeno dentro mecanicamente restrito ou livre de estresse. Estas 3D em modelos in vitro imitar os principais eventos da morfogênese valvular e são úteis para desconstruir os mecanismos de valvulogênese estágio precoce e tardia.
Protocolo
1. Preparação
- Incubar codorna fértil ou ovos de galinha para a fase 14 - (cerca de 2 dias) ou 25 (cerca de 4,5 dias) em 60% de umidade e 37 ° C.
- Preparar a solução de Earl estéril de salina balanceada (EBSS)
- Adicionar 100 mL EBSS 10X a 600 mL de água 18 mohms
- Adicionar 2,2 g de bicarbonato de sódio
- Ajustar o pH da solução para 7,2
- Levar a solução até 1000 mL
- Esterilizar a solução, passando por um filtro de 0,2 mM
- Prepare meio de cultura estéril M199.
- Adicione 1 pacote de pó para M199 700 mL de água 18 mohms.
- Adicionar 2,2 g de bicarbonato de sódio
- Ajustar o pH da solução para 7,2.
- Adicionar 10 mL (1%) Penicilina-estreptomicina
- Levar a solução até 1000 mL
- Esterilizar a solução, passando por um filtro de 0,2 mM
- Adicionar 1 mL estéreis suplemento Insulin-transferrina-selênio-G 100X
- Adicionar 10 mL (1%) de soro de galinha estéril
- Prepare três géis de colágeno dimensional em uma concentração de colágeno de 1,5 mg / mL. Trabalho anterior em nosso laboratório demonstraram que a concentração de colágeno de mais de 1,5 mg / mL fornece uma matriz que é muito dura biomecanicamente para que as células se movem através. As concentrações de gel de colágeno inferior a 1,5 mg / mL têm fibras colágenas tão poucas que a touceira de células pode rasgar as fibras localmente, produzindo uma ilha de células.
- Adicione o seguinte gelada reagentes a um tubo de centrifugação estéril 15 mL em ordem:
- 3X M199: Volume = volume total necessário / 3
- Estéril 18 mohms água: Volume = volume total necessário (M199 volume + volume de frango de soro + 0,1 M NaOH volume de volume de colágeno +)
- Soro de galinha estéril: Volume = volume total necessário * 0,01
- Colágeno de ratos de cauda I: Volume = (concentração do gel de colágeno * volume total necessário) / concentração de colágeno estoque
- Estéril 0,1 M NaOH: Volume = volume de colágeno * 0,2
Nota: A quantidade de água, 0,1 M NaOH, e colágeno adicionado irá variar dependendo da concentração da solução de colágeno.
- Misturar a solução de colágeno bem com uma pipeta estéril.
- Transferir imediatamente 0,3 mL da solução de colágeno em 1,9 centímetros 2 poços área de crescimento. Esta é a solução de colágeno suficiente para cobrir completamente o bem e para fornecer um gel que é de aproximadamente 3 mm de espessura. A espessura do gel de pelo menos 250 M é necessário para os estudos invasão celular.
- Permitir que a solução de colágeno para gel por pelo menos 1 hora a 37 ° C, 5% CO 2, e 100% de umidade.
- Adicione o seguinte gelada reagentes a um tubo de centrifugação estéril 15 mL em ordem:
2. Pré-EMT isolamento de células Endocárdica e Cultura
- Isolamento de embriões
- Coloque um pedaço de fita de polegada de comprimento de laboratório sobre a extremidade maior do ovo. Este é o lugar onde a célula de ar está localizado. A fita estabiliza a casca de ovo de codorna frágil.
- Delicadamente fure a área gravada do ovo na célula de ar com a ponta da tesoura esterilizada curvas.
- Corte um buraco na parte gravada do ovo que é grande o suficiente para permitir a gema para passar. Iniciar o buraco na punção e cortar para fora em forma de espiral. Certifique-se de cortar a membrana externa, mas evitar perfurar a gema.
- Quando o buraco no casco está completo, visualizar o embrião de codorna. O embrião é, normalmente localizados na parte superior da gema.
- Começará a derramar a gema através do buraco cortado no ovo com uma mão. Segure uma pinça # 55 na outra mão. Como o embrião sai do ovo na parte superior da gema, deslize suavemente as pinças # 55 sob o embrião e removê-lo da gema. Nota: Para ovos de galinha, o isolamento de embriões envolve quebrar o ovo de galinha em uma superfície limpa e nítida quebra o ovo em um prato de 100 milímetros Petri. O embrião deve estar localizado na parte superior da gema. Deslize suavemente # 55 pinças sob o embrião e removê-lo da gema.
- Coloque o embrião em um prato de 100 milímetros de Petri contendo gelada, EBSS estéril.
- Estágio os embriões de acordo com os critérios de Hamburger e Hamilton 1. Embriões no estádio 14 - são palco últimos 13, mas ainda não no estágio 15, com 20-21 somitos e um broto de cauda. Uma característica fundamental do estágio 14 - embriões é o ângulo de cabeça, que é ligeiramente maior do que 90 ° para o corpo.
- Remove os corações de embriões de codorna na fase 14 - com # 55 pinças cortando transversalmente onde o canal AV e OFT fazer contato com a parede torácica. Coloque os corações juntos em um lado da placa de Petri.
- Recolher os corações isolados com uma pipeta de transferência estéril e colocá-los em um 100 milímetros nova placa de Petri cheia de estéril, gelada EBSS.
- Corte o OFTs e canais AV transversalmente dos ventrículos com # 55 pinças.
- Seção dos canais restantes AV e / ou vias de saída (OFTs) longitudinalmente.
- Definir uma pipeta para um volume de 20 uL. Utilize este pipeta para aspirar seis longitudinalmente canais de corte e OFTs AV.
- Expulsar os canais AV e OFTs para o gel de colágeno. Aspirar EBSS qualquer excesso da superfície do gel.
- Use # 55 pinças para orientar os explantes que eles são lisos e assim o lado da luz enfrenta o gel de colágeno. Tente não perfurar o gel de colágeno com a pinça.
- Depois de 2 horas a 37 ° C e 5% CO 2, remova o miocárdio dos explantes com # 55 pinças. As células endocárdicas deve ser deixado para trás na superfície do gel de colágeno. Alternativamente, o miocárdio pode ser deixado no explante. Com a retirada do miocárdio, as células endocárdicas não sofrer com EMT sem intervenção. Com o miocárdio apresentam um subconjunto de células endocárdicas vai se transformar em mesênquima, mas o grau de transformação pode ser modulada com fatores externos. Nota: Mesmo que o miocárdio será deixado ligado, o explante deve ser permitido, pelo menos, duas horas para anexar ao gel antes média é adicionado.
- Adicionar 0,4 mL M199 médio a cada explantes contendo bem.
- Cultura das células a 37 ° C, 5% CO 2, e 100% de umidade.
3. Pós-EMT Almofada AV isolamento de células mesenquimais e Cultura
- Rachar o ovo de galinha em uma superfície limpa e nítida quebrar o ovo em um prato de 100 milímetros Petri. O embrião deve estar localizado na parte superior da gema. Pegue o embrião com # 5 pinças agarrando as membranas que envolvem o embrião e, em seguida, coloque o embrião para uma placa de Petri 100 milímetros enchido com o gelo frio, EBSS estéril.
- Estágio os embriões de acordo com os critérios de Hamburger e Hamilton 1. Características de um embrião de estágio 25 incluem cotovelo distintas e articulações do joelho e pigmentação nos olhos.
- Isolar os corações de todos os embriões HH25 e colocar o coração juntos em um lado da placa de Petri.
- Recolher os corações isolados com uma pipeta de transferência estéril e colocá-los em um 100 milímetros nova placa de Petri cheia de estéril, gelada EBSS.
- Isolar a região da AV todos os corações de uma vez. Coloque o AVs juntos em um lado da placa de Petri. Agite suavemente a região AV para remover todo o sangue, que podem afetar a viabilidade celular.
- Recolher os AVs isolada com uma pipeta de transferência estéril e colocá-los em um 100 milímetros nova placa de Petri cheia de estéril, gelada EBSS.
- Seqüencialmente isolar as almofadas da AV. Certifique-se que não há nenhum presente miocárdio nas almofadas AV.
- Recolher as almofadas isolada com uma pipeta de transferência estéril e colocá-los em um tubo de centrifugação estéril 15 mL.
- Girar as almofadas para o fundo do tubo de centrífuga de 15 xg por 3 minutos.
- Use uma ponta mL estéril 1000 para remover o máximo do sobrenadante EBSS possível, sem perturbar as almofadas.
- Adicionar 1 mL de 0,25% Tripsina-EDTA que foi pré-aquecido a 37 ° C. Permitir que as almofadas para incubar em tripsina até que estejam completamente dissolvidos, que é normalmente cerca de 3-5 minutos.
- Adicionar 100 mL de soro de frango para o tubo de centrifugação para saciar a tripsina.
- Agregar as células a 160 xg por 5 minutos. Remover o sobrenadante com uma estéril, ponta 1.000 mL.
- Ressuspender as células em 2 mL de M199 médio e misture por pipetagem. Tomar 10 mL da suspensão de células de contar com hemocitômetro e determinar o número total de células que foram isolados
- Determinar quantos géis de colágeno será feita com base no número de células isoladas. Células precisam ser banhado a uma densidade de 2 x 10 5 células / mL com um volume de 250 L gel.
- Agregar as células a 160 xg por 5 minutos. Remover o sobrenadante com uma estéril, ponta 1.000 mL.
- Usando o protocolo listados acima, adicione 3X M199, água, soro de galinha, o colágeno, e 0,1 M NaOH, nessa ordem, para o pellet celular. Mix pipetando gentil.
- Adicionar 250 mL para cada 1,9 cm 2 área de crescimento bem.
- Permitir que a solução de colágeno para gel por pelo menos 1 hora a 37 ° C, 5% CO 2, e 100% de umidade.
- Adicionar 0,4 mL de meios de cultura e incubar durante a noite.
- Para continuar a cultivar os géis em condições livre de estresse, liberar os géis dos lados da cultura bem usando uma ponteira estéril 200 mL. Culturas mecanicamente restrito são géis que permanecem ligados para os lados da cultura também.
4. Resultados representante
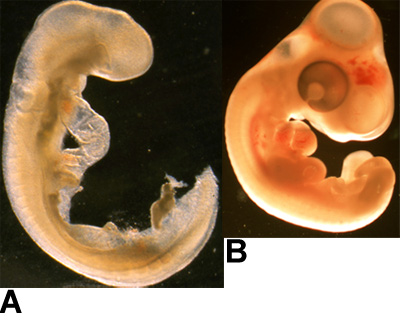
Figura 1:. Exemplos de embriões (A) embrião HH14-codorna, e (B) embrião de galinha HH25 são mostrados aqui.
fig2.jpg "alt =" Figura 2 "/>
Figura 2: HH14 válvula de explantes endocárdica após 2 horas de cultura (A) com o presente do miocárdio, ou (B) com o miocárdio removido..
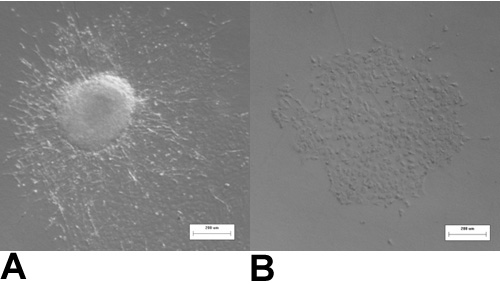
Figura 3:. HH14 válvula de explantes endocárdica (A) Com o presente miocárdio, muitas das células sofrem endocárdica para a transformação mesenquimais e ter um fusiformes fenótipo, mesenquimais após 48 horas de cultura. (B) Quando o miocárdio é removido todas as células manter uma calçada em forma de fenótipo, endocárdio após 48 horas de cultura.

Figura 4:. Cells HH25 células mesenquimais em uma válvula de gel de colágeno são arredondados imediatamente após a semeadura.

Figura 5:. HH25 células mesenquimais em cultura (A) Após 48 horas de cultura em um gel de colágeno restringiu o HH25 células mesenquimais estão começando a se espalhar. (B) HH25 células em um gel de colágeno sem stress 7 dias após a semeadura e 6 dias depois da libertação ter compactado o gel de aproximadamente 50% da área original.
Discussão
O método para isolar células endocárdicas do estágio HH14 - corações originalmente desenvolvido pela Runyan e Markwald fornece um ambiente controlado, in vitro ambiente para estudar os fatores que iniciam e modulam EMT embrionárias 2. HH14 - explantes cultivados endocárdica sem miocárdio não sofrerá EMT sem intervenção biomecânica ou bioquímica. Se o miocárdio é deixado no explante será sinal de um subconjunto de células endocárdicas submeter-se a transforma?...
Divulgações
Agradecimentos
Esta pesquisa é apoiada pela Fundação Hartwell, a American Heart Association (Scientist Desenvolvimento Grant # 0830384N) ea Fundação Leducq: 07CVD04 Mitral.
Materiais
| Name | Company | Catalog Number | Comments |
| Extra fine Bonn scissors, curved | Fine Science Tools | 14085-08 | |
| Dumont tweezers #55 | World Precision Instruments, Inc. | 14099 | |
| Dumont tweezers #5 | World Precision Instruments, Inc. | 14098 | |
| Sterile transfer pipettes | Samco Scientific, Thermo Fisher Scientific | 2041S | |
| 4-well culture plates | Nalge Nunc international | 176740 | |
| Sterile disposable filter units, PES, 0.2 μm pore size membrane | Nalge Nunc international | 566-0020 | |
| Sterile 15 mL centrifuge tubes | Corning | 430828 | |
| Sterile petri dishes, 100 mm x 15 mm | VWR international | 25384-342 | |
| Laboratory tape | VWR international | 89097-920 | |
| Rat-tail collagen I | BD Biosciences | 354236 | |
| 10X Earl’s Balanced Salt Solution | Quality Biological, Inc. | 119-064-131 | |
| M199 powder | Invitrogen | 31100-035 | |
| Penicillin-Streptomycin | Invitrogen | 15140-122 | |
| Insulin-Transferrin-Selenium-G supplement (100X) | Invitrogen | 41400-045 | |
| Chicken serum | Invitrogen | 16110-082 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200-056 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| Sodium hydroxide solution, 1.0 N | Sigma-Aldrich | S2770 | |
| Fertile quail eggs (Coturnix coturnix) | Lake Cumberland Game Bird Farm | ||
| Fertile chicken eggs (Gallus gallus) | Cornell University Poultry Farm |
Referências
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. J Morphol. 88, 49-92 (1951).
- Runyan, R. B., Markwald, R. R. Invasion of mesenchyme into three-dimensional collagen gels: A regional and temporal analysis of interaction in embryonic heart tissue. Developmental Biology. 95, 108-108 (1983).
- Butcher, J. T., Norris, R. A., Hoffman, S., Mjaatvedt, C. H., Markwald, R. R. Periostin promotes atrioventricular mesenchyme matrix invasion and remodeling mediated by integrin signaling through Rho/PI 3-kinase. Developmental Biology. 302, 256-256 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados