É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microscopia intravital da Microcirculação cérebro de camundongo usando uma janela fechada Cranial
Neste Artigo
Resumo
Microscopia intravital para seguir temporal e espacial eventos inflamatória e hemodinâmica na microcirculação pial.
Resumo
Este modelo experimental foi desenhado para avaliar a microcirculação do mouse pial durante aguda e crônica hemodinâmicos, fisiológicos e fisiopatológicos, condições inflamatórias e metabólicas, utilizando em microscopia de fluorescência in vivo. A janela fechada do crânio é colocado sobre o córtex parieto-occipital esquerdo do mouse. Microcirculação local é registrado em tempo real através da janela usando epi e iluminação de fluorescência, e as medições de diâmetros e vasos de glóbulos vermelhos (RBC) velocidades são executadas. RBC velocidade é medida em tempo real, utilizando correlação cruzada e / ou eritrócitos fluorescente etiquetados. Adesão de leucócitos e plaquetas aos navios pial e avaliação de perfusão e derrame vascular são feitos com a ajuda de marcadores de fluorescência rotulados como anticorpos Albumina-FITC e anti-CD45-TXR. Microcirculação podem ser repetidamente vídeo-gravadas durante vários dias. Que usamos para a primeira vez que o cérebro de microscopia intravital fechar a janela para o estudo da microcirculação pial seguir mudanças dinâmicas durante o curso da infecção por Plasmodium berghei ANKA em camundongos e mostram que a expressão da CM está associada a disfunções da microcirculação caracteriza-se por vasoconstrição, diminuição profunda no sangue fluxo e, eventualmente, colapso vascular.
Protocolo
1. Craniotomia
A craniotomia em 8 a 10 semanas de ratos velhos precisa ser feita com antecedência, uma descritos anteriormente, exceto que uma barra de titânio não é colocado na cabeça do animal. A janela crônica crânio é um exame que permite a preparação estável da microcirculação pial mesmo meses depois de ser implantado. Normalmente, realizamos nossos estudos 2-3 semanas após a implantação janela craniana.
2. Microscopia intravital
- Duas e três semanas após a craniotomia, a temperatura do corpo está marcada e, em seguida, o mouse é levemente anestesiados com isoflurano (4% para a indução, 1-2% para manutenção). Anestesia leve é usado para prevenir o estresse animal e desconforto durante o procedimento experimental.
- Os animais são então colocados em posição prona em uma estrutura estereotáxica ea cabeça cuidadosamente protegido usando barras de ouvido. O nível é ajustado com as alavancas esquerda e direita. Temperatura corporal é mantida através de uma almofada de aquecimento. Porque camundongos com malária cerebral desenvolver hipotermia, os ajustes de temperatura precisam ser ajustados para cada animal.
- O deslizamento de capa sobre a janela do crânio é suavemente limpo com um cotonete embebido em óleo mineral e uma imagem panorâmica dos vasos sob a janela é tomado com a ajuda de um microscópio estereoscópico e uma câmera digital (Nikon Coolpix 995, Japão). A imagem é impressa, datada e identificada e será usado como um mapa para as medições do diâmetro do vaso e glóbulos vermelhos (RBC) velocidades.
- O mouse é então transferido para um estágio do microscópio intravital (personalizado Leica-McBain, San Diego, CA). Uma gota de água é colocada na janela cranial aproveitando o bem formado pelo acrílico dental, o foco é ajustado. As medições são realizadas usando uma objetiva de imersão 20X (LUMPFL-WIR, abertura numérica 0.6, Olympus) de água. As mesmas embarcações são seguidos de forma que comparações diretas aos seus níveis de linha de base poderiam ser realizados permitindo mais robustas estatísticas para as populações pequena amostra. As imagens são capturadas com uma câmera digital de baixa luz da câmera de alta velocidade (Hamamatsu C9300-221, Japão), ou câmara analógica pouca luz (Cohu 4815, San Diego, CA) ligado a uma fita de vídeo (JVC, Japan), hora marcada (Vídeo MicroImage sistemas, Boyertown, PA) e um monitor colorido (PELCO, Clovis, CA). A fita está devidamente identificado antes do início da gravação, eo carimbo de tempo permite a identificação dos eventos, documentando o prazo durante o qual tais eventos foram recodificadas.
- A primeira verificação dos vasos é feita para avaliar a qualidade da preparação e, se o sangue está fluindo em todos os vasos. Então, a seleção dos vasos a ser medido é feita e deve incluir vênulas e arteríolas de diferentes diâmetros (em preparações nosso mouse pial, a maioria das embarcações faixa entre 20 e 80μm) e cobre diferentes locais dentro da área exposta pela janela. Arteríolas e vênulas podem ser facilmente diferenciadas, verificando a direção do fluxo sanguíneo nas ramificações do navio (se distribui ou coleta de sangue). Em nossos estudos, as medições são feitas em 12 navios. Localização precisa de cada ponto a ser medida é anotada no quadro da vasculatura pial.
- Para cada local, o diâmetro do vaso é medida usando um dispositivo de corte de imagem (imagem ao cisalhamento, Vista Electronics, San Diego, CA) 2. Uma vez que o local é selecionado, a imagem do navio está alinhado na posição vertical ea imagem é cortado até os extremos opostos estão alinhados ea leitura está documentado. Este valor pode ser traduzido em micrômetros pela calibração anterior para cada ampliação específico usando um micrômetro Stage Retículo Calibração (Edmund Optics Inc., Barrington, NJ).
- Cada ponto é gravado durante pelo menos 30 segundos para o rastreamento de eritrócitos. Para o rastreamento, uma amostra de sangue coletado, e eritrócitos são fluorescente etiquetado com o corante carbocyanine Dil (Molecular Probes, Carlsbad, CA) e infundido através da veia caudal para obter uma concentração em vivo de ~% ,4-,5 3. Em animais infectados com Plasmodium berghei ANKA (PBA) expressando a proteína fluorescente verde (GFP-PBA, uma doação da Pesquisa em Malária e de reagente de referência Resource Center MR4, Manassas, VA; depositado por CJ Janse e Águas AP), não infusão de rotulados célula é necessário. As imagens de vídeo são gravados em 150 frames por segundo. Esta taxa é definida para obter 1-6 imagens de uma célula em um quadro de vídeo para a determinação das velocidades de até 8 mm / s. As imagens de vídeo são digitalizados com um computador pessoal usando o Adobe Premier software 4.0, e os dados de coordenadas xy para cada imagem células são obtidos utilizando SigmaScan Pro 4.0 (SPSS Chicago, IL) 4. Posições célula são determinadas manualmente e não por análise de imagem, dado que o olho de um observador treinado foi mostrado para dar uma boa estimativa da localização do centro de uma célula, queh, em geral, corresponde à localização da fluorescência máxima observada para orientações mais células. Múltiplas determinações de posição e velocidade são feitos para cada célula e em média para obter a velocidade média de RBC.
- Quando as medições de velocidade RBC são realizadas offline, o tempo de observação total para cada rato não exceda 10-15 minutos minimizar os efeitos cardiodepressoras da anestesia.
- Uma vez que o diâmetro dos vasos e medições de velocidade RBC estão disponíveis, o cálculo do fluxo de sangue em cada embarcação pode ser feita usando a fórmula: Q = V x π (D / 2) 2, onde Q = fluxo de sangue, V = RBC velocidade e D = diâmetro do vaso.
- Estes procedimentos podem ser repetidos ao longo do tempo. Por exemplo, no modelo do rato de malária cerebral, realizamos medições diárias, começando no dia 4 de infecção. Os valores obtidos a cada dia para cada rato são normalizados em relação ao dia 0 (pré-infecção), que é considerado 100%.
- Além de diâmetro do vaso e medições de fluxo de sangue, avaliações adicionais podem ser realizados, por exemplo, melhorou a avaliação da perfusão e da análise de rolling de leucócitos e / ou plaquetas e adesão nos vasos pial. Essas medições são realizadas com a ajuda de marcadores fluorescentes marcado. No caso da malária, também podemos detectar parasitas circulantes ou aderentes por meio do uso da cepa PBA que expressa GFP.
- Para avaliação da perfusão usamos uma solução de FITC-albumina marcada (Sigma, St Louis, MO 50μg/mouse), e para quantificar a adesão de leucócitos aos navios pial usamos anticorpos contra o marcador pan-leucócitos CD45 marcado com Texas Red (TXR) ( Invitrogen, Carlsbad, CA 4μg/mouse). Para isso, 25μL da albumina-FITC (2mg/ml) e 20μL de anticorpos anti-CD45-PE (200μg/mL) são misturados e injetados na veia da cauda pré-aquecido. O mouse pode ser fotografada de imediato, no entanto, se as medições de fuga terá albumina-FITC é permitido circular por 15 minutos. Fluorescência verde (518nm) emitida pela albumina-FITC e GFP (PBA-GFP CGV) é capturado e usando ALPHA Vivid: XF100-2 (Omega Optical, Brattleboro, VT), e anti-CD45-TXR fluorescência (615nm) e é encerrado capturados com um padrão Vivid: XF42.
- A albumina marcado com fluorescentes permite uma melhor visualização da rede vascular, incluindo vasos penetrantes, e é particularmente útil em estados de doença como a malária cerebral para verificar se há vasos não-perfundidos ou sub-perfundidos. Também pode ser usado para medir derrame vascular 5.
- O fluorescentes marcado anti-CD45 anticorpos se torna mais fácil identificar e quantificar rolling de leucócitos e adesão aos navios pial. Para evitar distorções na quantificação, quantificamos rolling e aderência nos mesmos pontos pré-definidos para medir o fluxo sanguíneo. Quantificação da adesão de leucócitos é feita pela contagem do número de leucócitos em um comprimento 100μm navio. Rolando é quantificado pela contagem do número de leucócitos viajando a uma velocidade significativamente mais lento do que velocidade do sangue no mesmo comprimento 100μm, durante 30 segundos.
3. Resultados representativos
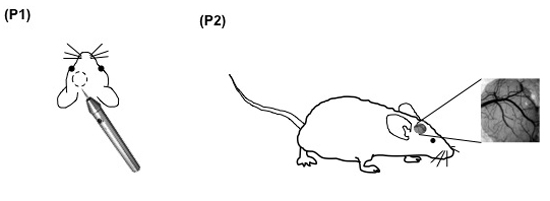
Figura 1. (Passo 2.6) Imagens da rede vascular do mouse pial acessível através da janela do crânio.
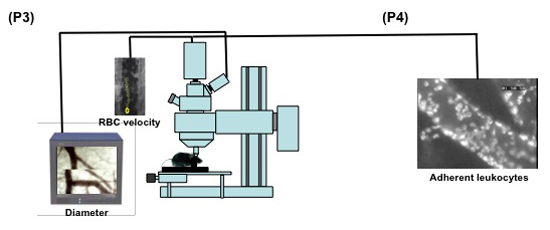
Figura 2. (Passos 3,1-3,5) display esquemática do set up para microscopia intravital da microcirculação do mouse pial. 1: microscópio intravital; 2: 20X objetivo imersão em água; 3: fonte de luz; 4a: digital low-luz da câmera de alta velocidade; 4b: câmera analógica; 5: mouse na moldura estereotáxica; 6: monitor de computador; 7: analógico tosquiador monitor mostrando como o corte da imagem (seta) é feito para medir o diâmetro do vaso.

Figura 3. (Passo 3,6-3,8) Microvascular glóbulos vermelhos medições de velocidade através do rastreamento de celular de alta velocidade gravações de vídeo de fluorescência. Fotos de A a F são imagens sequência de um navio pial, mostrando um RBC único movimento cruzando o campo microscópico delimitado pela câmera. Determinação manual de frame por frame de 15 posições ou mais células cruzando o campo, com sua distância pré-calibrado, permite o cálculo da velocidade média na RBC cada navio com a ajuda de uma planilha do Excel.
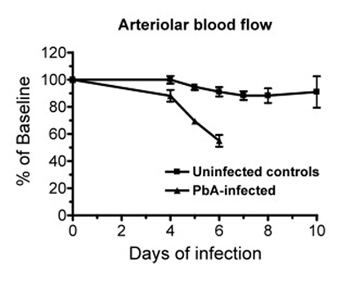
Figura 4. (Passo 3.9) Dados de um experimento representativo mostrando as mudanças no fluxo sanguíneo pial ao longo do tempo em Plasmodium berghei ANKA (PBA) camundongos infectados (n = 5) e em camundongos de controle não infectados (n = 5). Considerando que, em camundongos de controle do fluxo sanguíneo pial é relativamente estável ao longo do tempo, o PBA infectados camundongos mostram uma acentuada diminuição do fluxo sanguíneono momento da evolução da malária cerebral (dia 6). Dados são a média ± SEM.
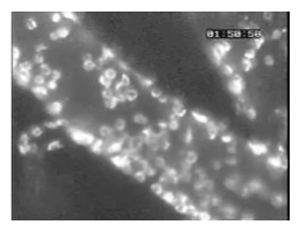
Figura 5. (Passo 4.3) Um grande número de leucócitos aderentes aos navios pial de um mouse infectados com Plasmodium berghei ANKA, como revelado pela coloração com anticorpos anti-CD45-Texas Red fluorescente.
Discussão
O método de microscopia intravital aqui descrito fornece uma ferramenta única e poderosa para a observação detalhada da microcirculação pial no mouse. Ele permite destacar arteríolas e vênulas individuais e medir as mudanças de uma série de parâmetros como diâmetro do vaso, RBC velocidades, o fluxo sanguíneo, a adesão e rolamento de leucócitos, plaquetas e outros elementos do sangue, derrame vascular, pH e pO2 tecidual e potencialmente muitos outros aplicações. O em resposta vascular in viv...
Divulgações
Agradecimentos
Este trabalho foi suportado por concessões R01-HL87290, R01-HL87290-S1 e R01-AI082610 dos Institutos Nacionais da Saúde para LJMC.
Materiais
| Name | Company | Catalog Number | Comments |
| Isoflurane | Baxter Internationl Inc. | FDG9623 | |
| Carbocyanine dye Dil | Molecular Probes, Life Technologies | D306 | |
| Albumin-FITC | Sigma-Aldrich | A9771 | |
| Anti-CD45-TxR Ab | Invitrogen | MCD4517 | |
| P. berghei ANKA-GFP | MR4 | MRA-865 |
Referências
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. J. Vis. Exp. (15), (2008).
- Intaglietta, M., Tompkins, W. R. Microvascular measurements by video image shearing and splitting. Microvasc. Res. 5, 309-312 (1973).
- Briceno, J. C., Cabrales, P., Tsai, A. G., Intaglietta, M. Radial displacement of red blood cells during hemodilution and the effect on arteriolar oxygen profile. Am. J. Physiol. Heart Circ. Physiol. 286, 1223-1228 (2004).
- Bishop, J. J., Nance, P. R., Popel, A. S., Intaglietta, M., Johnson, P. C. Relationship between erythrocyte aggregate size and flow rate in skeletal muscle venules. Am. J. Physiol. Heart Circ. Physiol. 286, H113-120 (2004).
- Baldwin, A. L. Modified hemoglobins produce venular interendothelial gaps and albumin leakage in the rat mesentery. Am. J. Physiol. Heart Circ. Physiol. 277, H650-H659 (1999).
- Cabrales, P., Zanini, G. M., Meays, D., Frangos, J. A., Carvalho, L. J. Murine cerebral malaria is associated with a vasospasm-like microcirculatory dysfunction, and survival upon rescue treatment is markedly increased by nimodipine. Am. J. Pathol. 176 (3), 1306-1315 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados