É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Formadoras de Colônias celular Assay (CFC) para células hematopoiéticas humanas
Neste Artigo
Resumo
O ensaio de células formadoras de colônia (CFC) é um ensaio in vitro em que células progenitoras hematopoéticas formar colônias em meio semi-sólido. Uma combinação de morfologia da colônia, morfologia celular e citometria de fluxo são utilizados para avaliar a capacidade dos progenitores a proliferar e se diferenciar ao longo dos diferentes linhagens hematopoiéticas.
Resumo
Humano-tronco hematopoiéticas / progenitoras células são normalmente obtidas da medula óssea, sangue do cordão umbilical ou sangue periférico e são usados para estudar a hematopoiese e leukemogenesis. Eles têm a capacidade de se diferenciar em linhagens linfóide e mielóide. O ensaio de células formadoras de colônia (CFC) é utilizado para estudar o padrão de proliferação e diferenciação de células progenitoras hematopoéticas por sua capacidade de formar colônias em meio semi-sólido. O número ea morfologia das colônias formadas por um número fixo de células de entrada fornecer informações preliminares sobre a capacidade dos progenitores para se diferenciar e proliferar. As células podem ser colhidas a partir de colônias individuais ou de toda a placa para melhor avaliar os seus números e os estados de diferenciação por citometria de fluxo e avaliação morfológica de Giemsa-manchada slides. Este ensaio é útil para avaliar a diferenciação mielóide, mas não linfóides. O mielóide termo neste contexto é usada em seu sentido mais amplo para abranger linhagens granulocítica, monocítica, eritróide e megacariocítica.
Temos utilizado neste ensaio para avaliar os efeitos de oncogenes na diferenciação de humanos primários células CD34 + derivadas do sangue periférico. Para este fim são as células transduzidas com qualquer construção de controle retroviral ou uma construção expressando o oncogene de interesse, neste caso NUP98-HOXA9. Nós empregamos um vetor retroviral comumente usados, MSCV-IRES-GFP, que expressa um mRNA bicistronic que produz o gene de interesse e um marcador GFP. Células são pré-ativado pelo crescimento na presença de citocinas por dois dias antes de transdução retroviral. Após mais dois dias, as células GFP + são isolados por fluorescência-activated cell sorting (FACS) e misturado com um meio de metilcelulose contendo semi-sólido suplementado com citocinas e incubados até colônias aparecem na superfície, geralmente 14 dias. O número e morfologia das colônias são documentados. Células são então removidas das placas, lavados, contados, e submetido a citometria de fluxo e análise morfológica. Citometria de fluxo com anticorpos específicos para os marcadores de superfície celular, expressas durante a hematopoiese fornece informações sobre a linhagem e maturação. Estudos morfológicos de células individuais sob um microscópio após Wright-Giemsa coloração fornecer informações adicionais em relação a linhagem e maturação. Comparação das células transduzidas com controle de vetores vazios aos transduzidas com um oncogene revela os efeitos do oncogene na diferenciação hematopoiética.
Protocolo
1. PREPARAÇÃO DE REAGENTES
- Prepare estéril soluções estoque de 1000x Fms relacionados tirosina quinase 3 (FLT-3) ligando, estimulante de colônias de granulócitos / macrófagos factor (GM-CSF), fator de células tronco (SCF), trombopoietina (TPO), interleucina (IL) -3 e IL-6 de acordo com instruções do fabricante. Preparar a solução estoque estéril Retronectin (1mg/ml) também de acordo com instruções do fabricante. Dividir estas soluções estoque em pequenas alíquotas e manter a -20 ° C para evitar repetidos de congelamento e descongelamento.
- Prepare FBS 2% em IMDM.
- Prepare IMDM médio completo, com concentrações finais de FBS 20%, 2 mM de glutamina, 100 unidades / ml penicilina / estreptomicina (PS). Adicione o seguinte citocinas imediatamente antes da utilização: 100 ng / ml ligante FLT-3, 20 ng / ml GM-CSF, 100 ng / ml SCF, 100 ng / ml TPO, 50 ng / ml de IL-3, e 100 ng / ml IL-6.
- Prepare BSA 1% em HBSS (Ca e Mg-livre, sem vermelho de fenol) e BSA 2% em D-PBS (Ca e Mg-free). Esterilizar as soluções, passando por filtros de 0,22 mm e seringa de armazenamento a 4 ° C.
- Prepare EDTA 0,02% em HBSS e armazenar a 4 ° C.
- Prepare-GALV pseudotyped retrovírus codificação do DNA de interesse e armazenamento em alíquotas a -80 ° C. Este procedimento está fora do escopo deste artigo, mas é descrita em outra parte (1-3).
Para coloração Giemsa
- Imediatamente antes da utilização, filtrar a solução Wright / Giemsa duas vezes através de 1 mícron papéis de filtro dentro de uma garrafa de vidro limpa.
- Imediatamente antes do uso, prepare Wright / Giemsa tampão pH 6,4, através da mistura de 50 ml da solução filtrada Wright / Giemsa e 200 ml de solução tampão fosfato, pH 6.4 - Giordano fórmula.
- Preparar a solução tampão fosfato, pH 6,0, dissolvendo 27,3 g de KH 2 PO 4 e 4,62 g de Na 2 HPO 4 em 3,5 LH 2 O.
- Prepare metanol a 50% em H 2 O.
2. PROCEDIMENTO
Descongelamento e pré-ativação de células CD34 +
- Descongelar um frasco de congelados células CD34 + rapidamente a 37 ° C agitando até que um pequeno cristal de gelo última é para a esquerda e transferir a suspensão celular (1 ml) para um tubo de 50 ml. Suavemente enxaguar as células restantes do frasco com 1 ml de temperatura ambiente 2% FBS / IMDM e adicioná-lo gota a gota, ao tubo de 50 ml enquanto agita suavemente. Aguarde 3 minutos. Em seguida, adicionar lentamente 2 ml de 2% FBS / IMDM, enquanto misturando suavemente, e espere por 3 minutos. Repita o procedimento, adicionando 2% FBS / IMDM que é o mesmo volume da suspensão diluída de células em intervalos de 3 min, rodando suavemente entre adições, até que o volume final chega a 32 ml.
- Centrifugar a 250 xg por 10 minutos em temperatura ambiente e remover o sobrenadante deixando para trás cerca de 0,5 ml.
- Lave o pellet, suspendendo em 20 ml de 2% FBS / IMDM e centrifugação a 200 xg por 8 minutos em temperatura ambiente.
- Remover o sobrenadante e suspender as células em meio IMDM completa em aproximadamente 0,5 x 10 6 células / ml. Tomar 10 ml da suspensão de células em um microtubo mix, com o mesmo volume de solução de azul de Trypan (0,4%) e contar com um hemocitômetro.
- Diluir as células a 0,1-0,15 X 10 6 células / ml, adicionando médio IMDM completo suplementado com citocinas (ver 1.3)
- Cultura as células em um umidificado 37 ° C incubadora com 5% de CO 2 para 2 dias.
Transdução retroviral por vírus pré-carregamento
- No dia de transdução, contagem de células antes de iniciar a pré-carga de vírus para determinar o número de poços a ser preparada.
- Diluir a solução estoque Retronectin a 25 mg / ml e adicionar 400 mL em cada poço de uma placa de 24 poços de cultura de tecidos não-tratados. Incubar por 2 horas em temperatura ambiente na capa de biossegurança de fluxo laminar para o revestimento de pré-.
- Remover a solução Retronectin e adicionar 400 mL de BSA 2% em D-PBS a cada poço. Incubar por 30 minutos em temperatura ambiente.
- Descongelar soluções estoque de vírus e manter em gelo. Remover a solução BSA, adicionar 0,5 ml da preparação de vírus a cada poço, e centrifugar a 2200 xg, a 4 ° C por 15 minutos.
- Remover o vírus solução de poços e repita o carregamento vírus descrito no 2,10 mais três vezes.
- Enxágüe bem com o frio cada 0,5 ml HBSS (+ Ca e Mg) ou IMDM.
- Recolher o pré-ativado células CD34 + por centrifugação a 200 xg por 8 minutos em temperatura ambiente.
- Volte a suspender as células em 0,1-0,15 x 10 6 células por 1,5 ml em meio IMDM completo com citocinas.
- Adicione 1,5 ml de suspensão celular a cada poço e incubar em um umidificado 37 ° C incubadora com 5% de CO 2 para 2 dias.
Separação de células e recolha de células transduzidas
- Suave mas completamente suspender as células do vírus-carregado acima da placas e filtrar através de um filtro de 50 mm de células CellTrics em um tubo cônico. Tomar 10 ml da suspensão de células em um microtubo mix, com um volume igual de solução de azul de Trypan e contar com um hemocitômetro. Enxágüe bem com cada 0,8 ml de frio 0,02% EDTA / HBSS (Ca e Mg-livre sem vermelho de fenol) e adicionar ao tubo de coleta mesma através de um filtro 50 mm de células CellTrics.
- Centrifugar as células a 200 xg por 8 minutos a 4 ° C e lavar o pellet com frio HBSS (Ca e Mg-livre sem vermelho de fenol) por centrifugação a 200 xg por 8 minutos a 4 ° C.
- Ressuspender o sedimento em 1% BSA / HBSS (Ca e Mg-livre sem vermelho de fenol) para uma concentração de 15 X 10 6 ml / ou um volume mínimo de 0.250 ml para separação de células. Manter as células no gelo no escuro. Prepare um tubo contendo 20% FBS frio / IMDM / Glutamina / PS médio para a coleta das células classificadas. Triagem é realizada no núcleo de alta velocidade Sorter Celular do J. Alvin Siteman Cancer Center, em Washington University School of Medicine utilizando um MoFlo classificador de alta velocidade (Dako, Glostrup, Dinamarca).
CFC ensaio
- Descongelar o número necessário de 3 ml alíquotas de mídia ensaio CFC. Vortex vigorosamente para misturar e deixar os tubos de ficar pelo menos 5 min para que as bolhas existentes a subir para a superfície antes de adicionar células.
- Para obter a concentração de células para cada amostra classificados, dividir o número de células fornecidas pela instalação de classificação pelo volume aproximado de células de suspensão. Tome-vírus 3000 transduzidas, células classificadas em um microtubo estéril contendo frio de 2% FBS / IMDM. Pré-ajustar o volume de 2% FBS / IMDM para que o volume final será de suspensão de aproximadamente 0,3 ml.
- Suspender as células e transferência de toda a 0,3 ml de suspensão celular a uma alíquota de 3 ml de Methocult GF + H4435, que consiste em metilcelulose 1%, 30% FBS, BSA 1%, 10 -4 M 2-mercaptoetanol, 2 mM L-glutamina, 50 ng / ml SCF, 20 ng / ml GM-CSF, 20 ng / ml de IL-3, 20 ng / ml de IL-6, 20 ng / ml G-CSF, e 3 unidades / ml em IMDM eritropoietina. Enriquecido Humanos Metilcelulose Media (R & D Systems), que consiste de metilcelulose 1,3%, FBS 25%, BSA 1%, 5 x 10 -5 M 2-mercaptoetanol, 2 mM L-glutamina, 50 ng / ml SCF, 20 ng / ml GM-CSF, 20 ng / ml de IL-3, 20 ng / ml de IL-6, 20 ng / ml G-CSF, e 3 unidades / ml em IMDM eritropoietina podem ser usados também.
- Vortex vigorosamente para fazer a mistura ascensão e queda total de 3-4 vezes. Deixe o tubo de ficar parado por 3 min.
- Anexar uma agulha calibre 16 blunt-end para uma seringa de 3 ml e elaborar 2,2 ml. Não elaborar grandes bolhas; expulsá-los no início, empurrando para fora um par de vezes. Empurrar para fora 1,1 ml cada em dois 30 prato não tratados mm e espalhar a mistura uniformemente girando.
- Coloque placas duplicadas em um prato de 100 mm, juntamente com um prato de água contendo 3 ml de água estéril. Cultura para 14-17 dias.
- Caracterizar e marcar as colônias de acordo com sua morfologia com um microscópio invertido com ampliação de 40x em uma placa de cultura com uma grelha de pontuação. Para efeitos do nosso ensaio, as colônias são classificadas em três categorias: eritróide pura, mielomonocítica e mistos. Veja as instruções do fabricante de subclassificação colônia mais.
- A placa de ensaio inteiro CFC pode ser digitalizado sem ampliação usando um scanner regular em 600 dpi, e de baixa potência (40x) fotomicrografias das colônias podem ser tomadas através de um microscópio invertido equipado com uma câmera de cor.
- Para posterior análise da diferenciação e proliferação, as células da placa inteira CFC ensaio são recuperados através da suspensão de vários volumes de temperatura ambiente 2% FBS / IMDM. Após centrifugação a 300 xg por 10 min a 4 ° C, as células são ressuspendidas em 2% FBS / IMDM, contados, e quer coradas com anticorpos por citometria de fluxo ou transferidos para slides usando uma centrífuga para Cytospin Giemsa.
Coloração de anticorpos e citometria de fluxo
- Células Centrifugar a 200 xg por 8 min a 4 ° C e ressuspender em soro de rato frio 50% normal em HBSS (Ca e Mg-livre sem vermelho de fenol).
- Coloque cerca de 5 x 10 5 células em 80 mL por tubo (12 x 75 mm de fundo redondo de tubos) e manter em gelo. Adicione a mistura de anticorpos (aproximadamente 20 mL mistura ou solução de controle negativo para anticorpos não-controles) e misturar batendo levemente os tubos. Prepare os tubos de controle de calibração sem anticorpos ou com um anticorpo anti-CD45 para cada fluorocromo. Colocar os tubos no gelo, no escuro e incubar por 20 minutos. Mix batendo levemente tubos após os primeiros 10 minutos. Após a incubação de 20 minutos, encher os tubos com HBSS fria e centrifugação a 200 xg por 8 min a 4 ° C. Ressuspender o sedimento em 0,5% paraformaldeído frio / HBSS.
Seguintes misturas de anticorpos são normalmente utilizados para nossa análise. Para a diferenciação mielóide: CD11b (ficoeritrina conjugada clone ICRF44) / CD33 (allophycocyanin conjugada clone WM53) / CD45 (ficoeritrina-Cy7-congjugated clone HI30). Para a diferenciação eritróide: CD71 (ficoeritrina conjugada clone M-A712) / CD235a (allophycocyanin conjugada clone GA-R2) / CD45 (ficoeritrina-Cy7-congjugated clone HI30). - Citometria de fluxo é realizada no núcleo de alta velocidade Sorter Celular do J. Alvin Siteman Cancer Center, em Washington University School of Medicine em um citômetro de fluxo FACScan atualizado para 5 cores e dois lasers (BD Biosciences) e analisados utilizando CellQuest (BD Biosciences) ou programa FlowJo v7.2.4 (Árvore Star, Inc., Ashland, OR, EUA) software.
Giemsa
- Cerca de 30.000 células recuperado de placas CFC ensaio descrito acima são suspensas em 0,3 ml de 2% FBS / IMDM e transferidos para um slide usando uma centrífuga Cytospin a 1.000 rpm por 10 min em temperatura ambiente.
- Configurar nove navios coloração contendo soluções na seguinte ordem.
- Metanol absoluto
- Wright / Giemsa solução estoque
- Wright / Giemsa tampão, pH 6,4
- Metanol 50% em H 2 O
- H 2 O
- H 2 O
- Tampão fosfato, pH 6,0
- H 2 O
- H 2 O
- Coloque os slides em uma transportadora de slide e mergulho em metanol absoluto (# 1) por 2 min e blot off metanol em excesso.
- Imediatamente, mergulhe a transportadora de slides em Wright / Giemsa solução estoque (# 2) por 5 min.
- Transferência do transportador em Wright / Giemsa, pH 6.4 (# 3) e incubar por 10 min.
- Mergulhe a transportadora duas vezes em metanol a 50% (# 4), 10 vezes em H 2 O (# 5), mais 10 vezes em H 2 O (# 6), e depois 5 vezes em tampão fosfato, pH 6.0 (# 7) .
- Transferência do transportador em H 2 O (# 8) e incubar por 2 min. Repita o lava-H 2 O (# 9).
- Permitir que as lâminas ao ar secar completamente no suporte. Retire cada slide e limpe a parte de trás da lâmina com metanol embebido Kimwipes para remover manchas. Coloque uma gota de Cytoseal 60 e uma tampa de vidro para selar.
- A contagem diferencial de 500 células é realizada para cada slide corados pelo Giemsa usando um microscópio Olympus BX51. As células são divididas em cinco categorias: células primitivas incluem explosões e promielócitos; células mielóides intermediária incluem mielócitos e metamielócitos; células mielóides maduras incluem bandas, neutrófilos segmentados, monócitos e macrófagos, células intermediárias eritróide incluem células com hemoglobinization intermediária e células maduras eritróide incluem células com hemoglobinization completo. Fotomicrografias são tomadas com uma câmera Olympus DP71 com um objetivo de petróleo 60x.
3.0) Os resultados representativos:
- Ensaio CFC: Alguns da população celular de entrada irão proliferar, diferenciar e formam colônias no meio semi-sólido durante o período de incubação de 14-17-dia. Neste experimento, é evidente que a expressão do oncogene NUP98-HOXA9 causou a formação de vermelho proeminente (eritróide colônias) (Figura 1) (3).
- Coloração de anticorpos e citometria de fluxo: imunofenotipagem por citometria de fluxo de células coletadas de placas CFC ensaio fornece informações sobre o estado de diferenciação da população celular. Pelo uso combinado de anticorpos contra certos marcadores de diferenciação, a linhagem eo grau de maturação das células pode ser avaliado. Neste caso CD235a foi utilizado para identificar células eritróides. Conforme mostrado na Figura 2A, NUP98-HOXA9 causou um aumento da percentagem de células CD235a + eritróide, mas o brilho de expressão CD235a por estas células foi diminuído em comparação com controles, indicando inibição da maturação eritróide. Na Figura 2B, células mielóides são identificados em virtude de sua positividade CD33. NUP98-HOXA9 causou uma diminuição no número de células CD33 +, com uma diminuição no brilho da expressão CD11b, consistente com a inibição da maturação mielóide (3). Assim, os resultados mostram que a citometria de fluxo NUP98-HOXA9 causou uma hiperplasia eritróide com a inibição da maturação tanto mielóide e eritróide.
- Coloração Giemsa: análise morfológica de células coletadas de placas CFC ensaio fornece informações sobre a linhagem eo grau de maturação da população celular. As conclusões obtidas morfologicamente podem diferir daqueles obtidos por estudos de citometria de fluxo e, portanto, estes métodos são complementares entre si (3). O experimento é repetido pelo menos 3 vezes, e cada vez que uma contagem diferencial de 500 células é realizada para distinguir cinco categorias de células, como descrito acima. Exemplos dessas células são apontados na Figura 3. Os resultados são tabulados e analisados, a fim de determinar se existem diferenças estatisticamente significativas entre o oncogene-transduzidas amostra e do controle. Neste caso, os resultados mostraram que NUP98-HOXA9 causou um aumento global do números de células, com hiperplasia eritróide e inibição de ambos os eritróide e maturação mielóide (3) (não mostrados).
LEGENDS FIGURA

Figura 1: Os efeitos da NUP98-HOXA9 na morfologia CFC humana.
Humanos primários células CD34 + foram retrovirally transduzidas com qualquer controle de vetores MSCV-IRES-GFP ou vetor expressando NUP98-HOXA9, e as células foram classificadas para a positividade GFP. Mil células foram semeadas em cada uma das duas placas duplicadas para ensaio de CFC eo experimento foi repetido 3 4 tempos independentes. Placas representante sem ampliação (à esquerda) e fotomicrografias de baixa potência do representante colônias eritróides (direita) são mostrados (3).
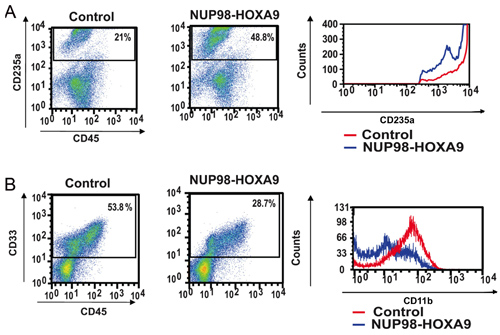
Figura 2: A citometria de fluxo mostra interrupção do humano CD34 + principal diferenciação celular por NUP98-HOXA9.
(A) A citometria de fluxo para a diferenciação eritróide: Células das placas CFC (ver Figura 1) foram colhidos e corados com anticorpos para CD45 e CD235a. O CD235a + portão foi plotado em um (painel direito) histograma para mostrar a expressão de CD235a relação às células controle (B) A citometria de fluxo para a diferenciação mielóide: Células das placas CFC foram colhidos e corados com CD45 e CD33. O CD33 + portão foi plotado em um histograma para mostrar expressão CD11b comparado ao grupo controle (painel direito). As porcentagens de células caindo dentro de cada porta são mostradas (3).
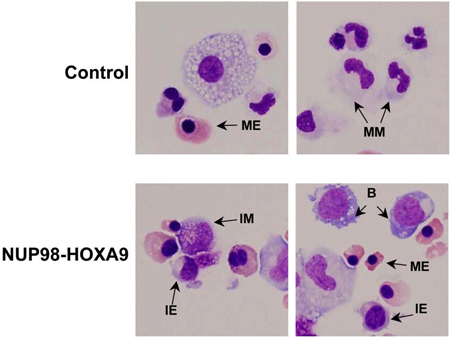
Figura 3: A morfologia mostra rompimento de diferenciação por NUP98-HOXA9 relação ao controle de vetores.
Manchas Cytospin foram preparados a partir de placas CFC e corados com Giemsa. Fotomicrografias foram tiradas de áreas representativas com um objetivo de petróleo 60x. B: explosão; MM: mielóides maduras, IM: intermediário mielóide, ME: eritróide maduro, IE: eritróide intermediária (3).
Discussão
O ensaio de CFC tem sido amplamente utilizado para determinar a proliferação e os padrões de diferenciação de células progenitoras hematopoéticas e estudar os efeitos dos oncogenes (4, 5). Tem a vantagem sobre culturas líquidas de ser um ensaio clonal, de tal forma que as colônias representam a progênie de um único progenitor e podem ser removidos individualmente para análise posterior. A limitação do ensaio CFC é que ele não é adequado para a detecção de células progenitoras imaturas ou mais célula...
Divulgações
Agradecimentos
Materiais
| Name | Company | Catalog Number | Comments |
| IMDM | Life Technologies | 12440 | |
| FBS | Stem Cell Technologies | 06150 | |
| L-Glutamine | Life Technologies | 25030 | |
| Penicillin/Streptomycin (PS) | Life Technologies | 15140 | |
| FLT-3 ligand | PeproTech Inc | 300-19 | |
| GM-CSF | PeproTech Inc | 300-03 | |
| SCF | PeproTech Inc | 300-07 | |
| TPO | PeproTech Inc | 300-18 | |
| IL3 | PeproTech Inc | 200-03 | |
| IL6 | PeproTech Inc | 200-06 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7030 | |
| EDTA | Fisher Scientific | BP118 | |
| Retronectin | Takara Bio Inc | T100A | |
| HBSS | Life Technologies | 14175 | |
| PBS | Life Technologies | 14200 | |
| Trypan Blue solution (0.4%) | Sigma-Aldrich | T8154 | |
| Methocult GF+ H4435 | Stem Cell Technologies | 04445 | |
| Human Methylcellulose Enriched Media | R&D Systems | HSC005 | |
| Wright/ Giemsa stain | Harleco | 64571 | |
| Phosphate Buffer Solution, pH 6.4 - Giordano formula | Ricca Chemical Company | 1450 | |
| Methanol | Fisher Scientific | A412-4 | |
| Cytoseal 60 | Thermo Fisher Scientific, Inc. | 8310 | |
| Normal Mouse Serum | Rockland Immunochemicals | D208 | |
| Anti-Human CD11b phyc–rythrin-conjugated | BD Biosciences | 555388 | |
| Anti-Human CD33 allophycocyanin-conjugated | BD Biosciences | 551378 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| Anti-Human CD71 phyc–rythrin-conjugated | BD Biosciences | 555537 | |
| Anti-Human CD235a allophycocyanin-conjugated | BD Biosciences | 551336 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| 24-well non-treated tissue culture plates | BD Biosciences | 35-1147 | |
| 30 mm non-treated dish | Stem Cell Technologies | 27150 | |
| 100 mm tissue culture dish | Fisher Scientific | 08-757-12 | |
| Gridded scoring dishes | Stem Cell Technologies | 27500 | |
| 15 ml centrifuge tubes | BD Biosciences | 35-2097 | |
| 50 ml centrifuge tubes | BD Biosciences | 35-2070 | |
| Syringes 3 ml | Stem Cell Technologies | 28240 | |
| 16 gauge blunt-end, 1½ inch needle | Stem Cell Technologies | 28110 | |
| 50 μm CellTrics cell filter | Partec | 04-004-2327 | |
| Hemocytometer | Fisher Scientific | 0267110 | |
| TPX sample chambers | Thermo Fisher Scientific, Inc. | A78710018 | |
| Fisherbrand Superfrost/Plus Microscope Slides, Precleaned | Fisher Scientific | 12-550-15 | |
| Shandon filter cards | Thermo Fisher Scientific, Inc. | 5991022 | |
| Shandon cytospin slide holder | Thermo Fisher Scientific, Inc. | 59920063 | |
| Shandon Complete Staining Assembly 100 | Thermo Fisher Scientific, Inc. | 100 | |
| Kimwipes | Kimberly-Clark Corporation | 34155 | |
| 1 μm filter paper | VWR international | 28307-134 | |
| Inverted microscope | Nikon Instruments | Diaphot | |
| Microscope camera | Nikon Instruments | DS-F11 | |
| Microscope | Olympus Corporation | BX51 | |
| Microscope camera | Olympus Corporation | DP71 | |
| Scanner | Microtek | Scanmaker 4 | |
| Vortex mixer | Fisher Scientific | 12-812 | |
| Tissue culture incubator | Sanyo | MCO-18AIC | |
| Cytospin | Shandon, Inc. | Cytospin 2 | |
| Bench-top centrifuge | Eppendorf | 5810-R | |
| Water purification system | Barnstead | Nanopure-Diamond |
Referências
- Takeda, A., Goolsby, C., Yaseen, N. R. NUP98-HOXA9 induces long-term proliferation and blocks differentiation of primary human CD34+ hematopoietic cells. Cancer Res. , 66-6628 (2006).
- Yassin, E. R., Abdul-Nabi, A. M., Takeda, A., Yaseen, N. R. Effects of the NUP98-DDX10 oncogene on primary human CD34+ cells: role of a conserved helicase motif. Leukemia. , (2010).
- Yassin, E. R., Sarma, N. J., Abdul-Nabi, A. M., Dombrowski, J., Han, Y., Takeda, A., Yaseen, N. R. Dissection of the transformation of primary human hematopoietic cells by the oncogene NUP98-HOXA9. PLoS One. 4, e6719-e6719 (2009).
- Nissen-Druey, C., Tichelli, A., Meyer-Monard, S. Human hematopoietic colonies in health and disease. Acta Haematol. 113, 5-96 (2005).
- Pereira, C., Clarke, E., Damen, J. Hematopoietic colony-forming cell assays. Methods Mol Biol. 407, 177-208 (2007).
- Coulombel, L. Identification of hematopoietic stem/progenitor cells: strength and drawbacks of functional assays. Oncogene. 23, 7210-7222 (2004).
- Hogge, D. E., Lansdorp, P. M., Reid, D., Gerhard, B., Eaves, C. J. Enhanced detection, maintenance, and differentiation of primitive human hematopoietic cells in cultures containing murine fibroblasts engineered to produce human steel factor, interleukin-3, and granulocyte colony-stimulating factor. Blood. 88, 3765-3773 (1996).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados