É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um modelo do rato de No Utero Transplante
Neste Artigo
Resumo
O modelo do rato de In utero O transplante é uma ferramenta versátil que pode ser usado para estudar as possíveis aplicações clínicas do transplante de células-tronco e terapia genética no feto. Neste protocolo, apresentamos uma abordagem geral para realizar esta técnica
Resumo
O transplante de células-tronco e vírus no útero tem um tremendo potencial para o tratamento de doenças congênitas no feto humano. Por exemplo, no útero transplante (IUT) de células-tronco hematopoiéticas tem sido usada com sucesso para tratar pacientes com imunodeficiência combinada grave 1,2. Em outras condições, no entanto, IUT foi tentada sem sucesso. 3 Tendo em conta estes resultados mistos, a disponibilidade de um modelo não-humano eficiente para estudar as seqüelas biológicas do transplante de células-tronco e terapia genética é crítico para avançar nesse campo. Nós e outros autores utilizaram o modelo do rato de IUT para estudar os fatores que afetam o enxerto de sucesso no útero transplantado células-tronco hematopoéticas em ambos os camundongos selvagens 4-7 e aqueles com doenças genéticas. 8,9 O ambiente fetal também oferece vantagens consideráveis para o sucesso da terapia genética no útero. Por exemplo, a entrega de 10 adenoviral, adeno-associado viral 10, retroviral 11, e lentivirais 12,13 para o feto, resultou na transdução de múltiplos órgãos distantes do local da injeção de longo prazo da expressão gênica. In utero terapia genética pode ser considerada como uma estratégia possível tratamento para distúrbios de um único gene como a distrofia muscular ea fibrose cística. Outra vantagem potencial do IUT é a capacidade de induzir tolerância imunológica a um antígeno específico. Como pode ser visto em camundongos com hemofilia, a introdução do Fator IX no início de resultados de desenvolvimento da tolerância a essa proteína. 14
Além de seu uso em terapias investigando o potencial humano, o modelo do rato de IUT pode ser uma ferramenta poderosa para estudar questões básicas em biologia celular e de desenvolvimento tronco. Por exemplo, pode-se oferecer várias pequenas moléculas para induzir ou inibir a expressão de genes específicos em estágios definidos gestacional e manipular as vias de desenvolvimento. O impacto dessas alterações pode ser avaliada em vários pontos temporais após o transplante inicial. Além disso, pode-se transplante pluripotentes ou linhagem específica de células progenitoras no ambiente fetal para estudar a diferenciação de células-tronco em um ambiente de acolhimento não irradiados e imperturbável.
O modelo do rato de IUT já proporcionou inúmeros conhecimentos nas áreas de imunologia, biologia celular e de desenvolvimento e tronco. Neste protocolo baseado em vídeo, descrevemos uma abordagem passo-a-passo para realização de IUT em fetos de rato e delinear as etapas críticas e armadilhas potencial desta técnica.
Protocolo
1. Preparação de Pipetas Injection
- Calibrar o puxador de uma pipeta de tal forma que a separação da pipeta de vidro ocorre dentro de 15 segundos (veja as instruções do fabricante em relação à calibração). A pipeta terá um cone, onde se separa.
- Corte a extremidade da pipeta de modo que a distância do início do cone até o fim da pipeta é 1,04 centímetros a 1,05 centímetros. O comprimento da pipeta é inversamente proporcional ao calibre do orifício da pipeta. Estar ciente de que fazer um longo pipeta também resulta em uma menor dica que é mais suscetível à quebra durante a injecção.
- O próximo passo para tornar a pipeta é criar um chanfro lisa afiando a ponta em uma roda de diamante nitidez. No momento de cortar a pipeta para o tamanho apropriado, a pipeta, muitas vezes rompe com um chanfro natural em sua ponta que deve ser usado quando colocar a pipeta na roda. Durante este processo, é importante suavemente o resto da pipeta na roda de afiar e reavaliar periodicamente para certificar-se da pipeta ainda está tocando a roda (como o bisel se torna mais suave, ele vai perder o contato com a roda de afiar).
- Uma vez que o bisel é lisa, a ponta da pipeta deve ser afiada (Figura 1). Elevar a pipeta de tal forma que já não é tocar na roda de amolar, girar no sentido horário por 10-50 graus, e coloque a pipeta de volta na roda girando nitidez ~ 10 segundos. Retirar a pipeta da roda de afiar e agora examinar a borda. Esta etapa geralmente precisa ser repetido com vários pequenos ajustes para criar uma borda afiada. Se a pipeta é colocada em sua borda por muito tempo, é mais propensos a desenvolver uma superfície irregular (Figura 1). Depois de completar um lado, você pode prosseguir para aguçar a extremidade oposta, repetindo os passos acima.
- Use um marcador permanente para desenhar uma linha circunferencial cada quatro milímetros de partida onde o cone da pipeta começa. Estes correspondem a demarcações 5uL de volume.
2. Utero em Transplantes
- Depois de preparar o material injetável (por exemplo, células, vírus, etc) você pode configurar para a injecção. Nós usamos um microinjetor ligado a ar comprimido com as seguintes configurações: (ajustes de pressão: entrada de 60-80 psi, encha 40 psi, injetar 8-12 psi, psi equilíbrio 0, sem soltar, 0 psi, o tempo de injeção de 100 milissegundos).
- Para esterilizar a pipeta de injeção, limpe-o duas vezes com etanol 70% seguido por duas vezes com PBS 1X estéril. Como a ponta da pipeta é muito frágil, não recomendamos autoclavagem as pipetas de injeção.
- Injeções pode ser feito usando lupas 2.5X-3.5X ampliação ou um microscópio de dissecação. Prepare sua área de procedimento com uma manta de aquecimento, iluminação e instrumentos cirúrgicos necessários.
- Anestesiar o rato grávidas (nós utilizamos isoflurano e oxigênio fornecido através de uma unidade de fluxo contínuo anestesia). Posicione o mouse sobre uma almofada de aquecimento na posição supina e apor cada membro com fita adesiva para prender o mouse no lugar.
- Clipe da pele. Então, usando luvas cirúrgicas estéreis, preparação do abdômen, com 10% iodopovidona seguido pelo álcool, e injetar um analgésico tais como buprenorfina.
- Faça uma incisão um centímetro na parte inferior do abdômen (o aspecto mais inferior da incisão deve ser de aproximadamente 1 centímetro superior ao intróito). Inciso da pele e da fáscia. Tenha cuidado para não ferir os órgãos abdominais (intestino e bexiga) que são imediatamente sob a fina camada de fáscia.
- Usando cotonetes, delicadamente esticar a fascia e entregar o útero grávido através da incisão. Contar o número total de fetos pelo primeiro identificar os ovários direito e esquerdo para se certificar de que você visualize todo o útero. Coloque o útero de volta na cavidade abdominal antes de prosseguir para que os fetos permanecem quente, enquanto você se prepara para as injeções.
- Elaborar o volume apropriado de material para o número de fetos planeia administrar a injecção. Enquanto enche a agulha com a sua amostra, é importante para manter a ponta da pipeta submersa para evitar a aspiração a sua amostra no tubo microinjetor. Como as células são geralmente em um pequeno volume, que geralmente colocam em uma pequena de microcentrífuga (ex: 0,5 ml) de tubo ou diretamente em um pedaço de Parafilm para ser capaz de preencher a agulha sem quebrar a ponta da pipeta.
- Pressione cuidadosamente cada feto e identificar a parte do feto que você plano para injetar (fígado, por exemplo, a cavidade peritoneal, perna, etc). Com o polegar eo indicador, é necessário estabilizar o feto dentro da cavidade amniótica para que ela não gira enquanto você estiver realizando a injeção. É importante para manter o feto com firmeza suficiente para estabilizá-lo ainda suavemente o suficiente para evitar danificá-lo.
- Insira cuidadosamente a pipeta através do útero, âmnio e da pele fetal, e para o órgão-alvo. Se a pipeta é afiada, ele deve passar facilmente através destes tecidos. Se a ponta da pipeta é maçante, você wi ll tenting aviso do útero e da membrana amniótica. Injetar o volume desejado em cada feto. É imperativo que os seus movimentos ser estável durante o tempo de inserção, de injeção e retirada da pipeta.
- Uma vez que o volume desejado é injetado, retirar a pipeta com cuidado. Se feito corretamente, material não deve vazar para fora da cavidade amniótica ou útero. Se um grande buraco é criado no âmnio, o que pode-se reconhecer por vazamento de líquido amniótico, em seguida, a sobrevivência está comprometida. Finalmente, para os estudos que envolvem a colheita pós-natal, todos os fetos devem receber injeções tecnicamente perfeito, pois não existe maneira de discernir fetos injetado e uninjected após o nascimento.
- Se você estiver executando injeções no fígado fetal, você pode ocasionalmente ver o sangue na ponta da pipeta, após sua retirada, isto confirma que está na posição correta e não deve afetar a sobrevivência. Se executar injeção intra-peritoneal, o objectivo ligeiramente abaixo do fígado fetal. Para injeções intramusculares, você pode posicionar o feto para identificar o quadril e fêmur e injetar no músculo glúteo. Finalmente, para injeções intraventricular, é fácil ver as suturas coronal para dirigir a pipeta para o destino apropriado. Para estas injecções, pipetas calibre um pouco maior são obrigados a penetrar o crânio, sem quebrar a pipeta.
- Em seguida, coloque cuidadosamente o útero de volta para a cavidade abdominal. Certifique-se que não está torcido sobre si mesmo ou ao redor de seu suprimento vascular. Entregar 1mL de 1X PBS estéril na cavidade peritoneal da mãe para substituir todo o líquido que foi perdido durante o procedimento. Fechar a incisão em 2 camadas com uma sutura absorvível trançado 5-0 (ex: Vicryl). Primeiro fechar a fáscia sem ferir o intestino ou bexiga subjacente, e em seguida, fechar a pele.
- Neste momento, pós-procedimento medicamentos podem ser administrados para analgesia. Retorno cada fêmea injetado para sua própria gaiola individual e colocar a gaiola em um cobertor de aquecimento. Monitorar o mouse até que ele é reto. Coloque cama na gaiola e coloque o mouse em uma área tranquila da instalação do mouse onde não deve ser perturbado (ou seja, sem a limpeza da gaiola) até vários dias após o parto. Minimizando qualquer estresse adicional para o animal irá diminuir as chances de parto prematuro.
- Depois de ter concluído as injeções, limpar a sua pipeta estéril por duas vezes com 1X PBS e uma vez com EtOH 70%.
- Fêmeas injetadas devem ser observados diariamente para garantir que elas estão se recuperando do procedimento sem dificuldade. A incisão deve ser monitorada para o inchaço, inflamação sinais, a separação da ferida, e outros de infecção. Pós-operatório de analgésicos pode ser administrada, conforme necessário.
3. Resultados representativos:
Sobrevivência dos fetos injetado para entrega do termo é o principal fator limitante para alcançar o sucesso com esta técnica. Dependendo do material e injetado a cepa de rato a ser utilizado, as taxas de sobrevivência pode variar. Em geral, as injeções de células hematopoiéticas em camundongos selvagens no E14 deve resultar em pelo menos 50% nascidos vivos filhotes. Maiores taxas de sobrevivência são possíveis, dependendo tanto os aspectos técnicos da injeção, bem como as características dos ratos sendo injetado.
Minimização do trauma no útero e as membranas amnióticas é o aspecto técnico mais importante deste protocolo. Sharp, pipetas de pequeno calibre irá resultar em trauma uterino mínimos durante a injeção. Nós não recomendamos o uso de agulhas de injeção padrão, como o calibre das agulhas pré-fabricadas é muito grande e que resultaria em um grande buraco no útero. Pipetas de injeção mão crafted vidro são os únicos agulhas de pequeno calibre que podem ser utilizados no injeções intra-útero. Cuidadosa e meticulosa técnica cirúrgica, incluindo a manipulação delicada do útero e uma anestesia curta é também crucial para melhores resultados.
Características específicas dos ratos destinatário, como a herança genética, idade gestacional, e tamanho da ninhada também pode afetar a sobrevivência. Certas cepas de camundongos são mais suscetíveis ao trabalho de parto prematuro e perda de gravidez dependendo da sua formação genética. 15 animais transgênicos com defeitos musculares ou neurodegenerativas podem ter uma diminuição da capacidade de entregar os fetos na vagina depois de submetidos a uma laparotomia mediana. 8 Essas fêmeas grávidas pode pedir a entrega por cesariana. Temos também descobriram que a idade gestacional no momento da injeção pode impactar sua viabilidade. Fetos que têm menos de 12 dias embrionárias têm menores taxas de sobrevivência do que os fetos mais velhos. Finalmente, descobrimos que tamanho das ninhadas grandes (> 10 fetos) tendem a ter maiores taxas de morte fetal após a injeção. Atenção para os aspectos técnicos desta técnica e as características específicas dos ratos sendo injetado pode maximizar a sobrevivência dos fetos injetado.
ve_content "> Quando esses métodos são executados corretamente, pode-se esperar que todos os fetos são expostos ao material injetado. Similar à configuração pós-natal, no entanto, a entrega bem sucedida de células ou vírus no útero nem sempre resulta em enxerto de doadores de células ou de genes expressão, respectivamente. enxerto de células-tronco, por exemplo, é dependente de vários factores, tais como a dose e origem das células transplantadas. Da mesma forma, o sucesso de transdução viral é, em parte, determinada pelo tipo do vetor viral utilizado. é preciso entender os inúmeros fatores que a sobrevivência das crias impacto, o enxerto celular e transdução viral para alcançar o sucesso com este protocolo.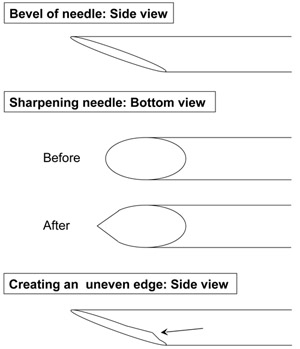
Figura 1. Diagrama mostrando boa nitidez das pipetas de injeção (Passo 1.4)
Discussão
Mais de 50 anos, Billingham, Brent e Medawar utilizado no útero transplante em camundongos para induzir tolerância imunológica a proteínas estranhas. 16 Desde esse tempo, diversas variações desta técnica têm sido usadas para tratar de questões na área de imunologia e biologia de células-tronco.
O protocolo detalhado aqui é um dos métodos mais acessíveis para IUT. O fígado fetal oferece um alvo fácil visualização e fornece acesso para a circulação sist?...
Divulgações
Agradecimentos
Gostaríamos de agradecer as nossas fontes de financiamento: O Instituto da Califórnia de Medicina Regenerativa Clinical Fellow Training Grant (AN), National Science Foundation (MW), Irene Award Perstein (TCM), American College of Surgeons (TCM), Associação Americana de Pediatria Cirúrgica ( TCM), e da March of Dimes (TCM).
Materiais
| Name | Company | Catalog Number | Comments |
| Pipettes | Kimble Chase | 71900-100 | |
| Pipette puller | Sutter Instrument Co. | Model P-30 | |
| Microinjector | Narishige International | IM-300 | |
| Pipette sharpener | Sutter Instrument Co. | Model BV-10 |
Referências
- Flake, A. W. Treatment of X-linked severe combined immunodeficiency by in utero transplantation of paternal bone marrow. N Engl J Med. 335, 1806-1810 (1996).
- Wengler, G. S. In-utero transplantation of parental CD34 haematopoietic progenitor cells in a patient with X-linked severe combined immunodeficiency (SCIDXI). Lancet. 348, 1484-1487 (1996).
- Flake, A. W., Zanjani, E. D. in utero hematopoietic stem cell transplantation: ontogenic opportunities and biologic barriers. Blood. 94, 2179-2191 (1999).
- Merianos, D. J. Maternal alloantibodies induce a postnatal immune response that limits engraftment following in utero hematopoietic cell transplantation in mice. J Clin Invest. 119, 2590-2600 (2009).
- Peranteau, W. H., Endo, M., Adibe, O. O., Flake, A. W. Evidence for an immune barrier after in utero hematopoietic-cell transplantation. Blood. 109, 1331-1333 (2007).
- Kim, H. B., Shaaban, A. F., Yang, E. Y., Liechty, K. W., Flake, A. W. Microchimerism and tolerance after in utero bone marrow transplantation in mice. J Surg Res. 77, 1-5 (1998).
- Durkin, E. T., Jones, K. A., Rajesh, D., Shaaban, A. F. Early chimerism threshold predicts sustained engraftment and NK-cell tolerance in prenatal allogeneic chimeras. Blood. 112, 5245-5253 (2008).
- Mackenzie, T. C., Shaaban, A. F., Radu, A., Flake, A. W. Engraftment of bone marrow and fetal liver cells after in utero transplantation in MDX mice. J Pediatr Surg. 37, 1058-1064 (2002).
- Hayashi, S. Mixed chimerism following in utero hematopoietic stem cell transplantation in murine models of hemoglobinopathy. Exp Hematol. 31, 176-184 (2003).
- Bouchard, S. Long-term transgene expression in cardiac and skeletal muscle following fetal administration of adenoviral or adeno-associated viral vectors in mice. J Gene Med. 5, 941-950 (2003).
- Meza, N. W. Rescue of pyruvate kinase deficiency in mice by gene therapy using the human isoenzyme. Mol Ther. 17, 2000-2009 (2009).
- MacKenzie, T. C. Efficient transduction of liver and muscle after in utero injection of lentiviral vectors with different pseudotypes. Mol Ther. 6, 349-358 (2002).
- MacKenzie, T. C. Transduction of satellite cells after prenatal intramuscular administration of lentiviral vectors. J Gene Med. 7, 50-58 (2005).
- Sabatino, D. E. Persistent expression of hF.IX After tolerance induction by in utero or neonatal administration of AAV-1-F.IX in hemophilia B mice. Mol Ther. 15, 1677-1685 (2007).
- Mellor, A. L., Munn, D. H. Immunology at the maternal-fetal interface: lessons for T cell tolerance and suppression. Annu Rev Immunol. 18, 367-391 (2000).
- Billingham, R. E., Brent, L., Medawar, P. B. Actively acquired tolerance of foreign cells. Nature. 172, 603-606 (1953).
- Endo, M. Gene transfer to ocular stem cells by early gestational intraamniotic injection of lentiviral vector. Mol Ther. 15, 579-587 (2007).
- Waddington, S. N. Long-term transgene expression by administration of a lentivirus-based vector to the fetal circulation of immuno-competent mice. Gene Ther. 10, 1234-1240 (2003).
- Schachtner, S., Buck, C., Bergelson, J., Baldwin, H. Temporally regulated expression patterns following in utero adenovirus-mediated gene transfer. Gene Ther. 6, 1249-1257 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados