É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cultura Slice organotípicas de GFP-expressando embriões de camundongos para imagens em tempo real de crescimento dos nervos periféricos
Neste Artigo
Resumo
Nós apresentamos um método para preparar fatias organotípicas de embriões meados de gestação do rato para a imagem de cultivo e de lapso de tempo de crescimento dos nervos periféricos.
Resumo
Para muitos propósitos, o cultivo de embriões de rato vivo ex como fatias organotípicas é desejável. Por exemplo, nós empregamos uma linha de camundongo transgênico (tauGFP) em que a versão melhorada da proteína verde fluorescente (EGFP) é exclusivamente expressa em todos os neurônios do desenvolvimento do sistema nervoso central e periférico 1, permitindo a possibilidade de ambos os filmes a inervação o membro anterior e manipular esse processo com as técnicas farmacológicas e genéticas 2. O parâmetro mais crítico de sucesso no cultivo de culturas fatia tal é o método pelo qual as fatias são preparadas. Após extensos testes de uma variedade de métodos, descobrimos que um vibratome é o dispositivo melhor possível para cortar os embriões de tal forma que eles rotineiramente resultar em uma cultura que demonstra a viabilidade ao longo de um período de vários dias, e mais importante, se desenvolve em uma época forma específica. Para meados de gestação de embriões, o que inclui a consequência normal de nervos espinhais da medula espinhal e os gânglios da raiz dorsal para as suas metas na periferia e na determinação adequada do tecido ósseo e muscular.
Neste trabalho, apresentamos um método para processamento de embriões de todo dia embrionário (E) E10 a E12 em 300-400 fatias micrômetro para o cultivo em um padrão de cultura de tecidos da incubadora, que pode ser estudado por até dois dias após a preparação fatia. Crítico para o sucesso desta abordagem é o uso de um vibratome a fatia cada embrião agarose-embedded. Isto é seguido pelo cultivo das fatias em cima insere cultura Millicell membrana colocada sobre um pequeno volume de meio, resultando em uma técnica de cultura de interface. Uma maca com uma média de 7 embriões rotineiramente produz pelo menos 14 fatias (2-3 fatias da região forelimb por embrião), que varia um pouco devido à idade dos embriões, bem como para a espessura das fatias. Cerca de 80% das fatias cultivadas mostram crescimento do nervo, que pode ser medido longo de todo o período de 2 cultura. Resultados representativos usando a linha do mouse tauGFP são demonstradas.
Protocolo
Parte 1: Preparando-se para cortar e cultura.
- Prepare 10 cm de placas de cultura de tecido com corte médio (DMEM, 25% 1x HBSS, 25% de soro fetal bovino, a glicose 0,5%, 1 mM de glutamina, 2,5 mM HEPES, pH 7.3) e 3 cm de Millicell-CM cultura 0,4 mícrons insere membrana e manter em estufa a 37 ° C e 5% CO 2.
- Aqueça 4% baixo ponto de fusão de agarose em PBS no microondas e mantê-lo na placa de aquecimento para que fique em aproximadamente 37 ° C.
- Preencher 10 cm de pratos bacteriológica Petri com PBS (140 mM NaCl, 2,7 mM KCl, 10 mM Na 2 HPO 4, 1,8 mm KH 2 PO 4) e colocar no gelo.
- Configurar dispositivo de resfriamento micrótomo ou garantir que bandeja de tampão e de refrigeração elementos são armazenados no freezer para pré-cool-lo.
Parte 2: incorporação de embriões.
- Dissecar os embriões do útero e examiná-las com um microscópio invertido fluorescente para verificar se há expressão GFP.
- Embriões lugar em uma invertida de 10 cm Placa de Petri e orientá-los usando tiras de papel Whatman para remover PBS excessiva.
- Aplicar agarose sobre o embrião para corrigi-lo nesta posição. Deixe agarose solidificar.
- Limitar a área que circunda o embrião, cortando com uma lâmina de barbear.
- Gire o embrião incorporado em seu outro lado.
- Aplicar agarose adicionais sobre tecido embrionário para garantir que o embrião está completamente incorporado.
- Prepare bloco agarose com bordas limpas e montagem em vibratome chuck usando Loctite 406, uma cola especial semelhante ao "Krazy Glue".
Parte 3: Slicing procedimento.
- Configure a bandeja de tampão pré-resfriada eo elemento de refrigeração.
- Insira o chuck com o tecido colado e adicione HBSS 1x (Ca 2 +-Mg 2 + livre HBSS, 10 mM HEPES pH 7,3, 500 U / ml de penicilina / estreptomicina) até coberta.
- Inserir e fixar uma lâmina de micrótomo precleaned (70% etanol).
- Prepare 350-450 fatias mm e transferi-los usando encurtado pipetas de vidro pasteur em placas de cultura de tecidos conservados no gelo.
- Usando uma pinça, retire cuidadosamente cada fatia de agarose e transferência para membranas Millicell cultura. Cerca de 4 fatias podem ser cultivadas em uma membrana em uma placa de cultura de 10 cm de tecido preenchido com 6 mL de meio de cultura.
- Incubar fatias a 37 ° C e 5% CO 2 (médio Cultura: DMEM, 25% 1x HBSS, 25% soro fetal bovino, a glicose 0,5%, 1 mM de glutamina, 2,5 mM HEPES, pH 7.3). Se um time-lapse realiza série de imagens deve-se manter constante o volume de meio. No caso da série programada de imagem para um curto espaço de tempo é suficiente para deixar o meio como ela é. Para períodos de mudanças mais cultura após 12-20 horas são recomendados.
Parte 4: Imaging conseqüência do nervo espinhal ao microscópio.
- Nervos espinhais colocar uma imagem de 10 cm placa de cultura de tecidos, contendo membranas cultura Millicell com fatias, sob um microscópio fluorescente na posição vertical.
- Rótulo a orientação das membranas cultura Millicell no palco microscópio para posicionar corretamente durante o próximo ponto de imagem tempo.
- Imagem conseqüência do nervo espinhal utilizando 4x (abertura numérica [NA] 0,1), 10x (NA 0,3) ou 20x (NA 0.5) objetivos.
A Figura 1 mostra uma série de imagens retratando o crescimento do nervo espinhal, durante 20 horas de cultura com objectivos de 4x e 10x.
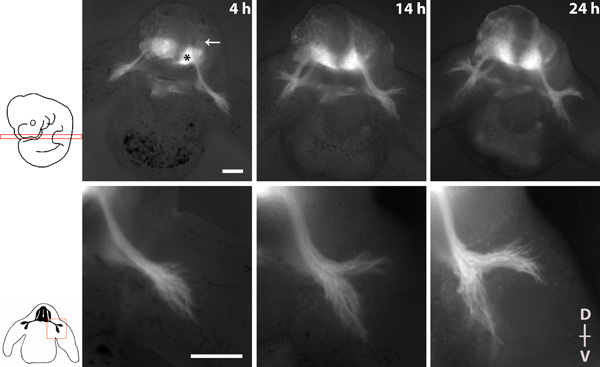
Figura série de imagens de uma conseqüência do nervo espinhal em uma fatia transversal de um embrião tauGPF homozigótica. * = Neurônios motores da medula espinhal ventral, seta = DRG. O dorsal (D)-ventral eixo (V) da fatia é indicado. Scalebars: 200 mM.
Access restricted. Please log in or start a trial to view this content.
Discussão
Em uma extensa comparação de métodos para preparar culturas fatia embrionárias de embriões meados de gestação mouse (E10 - E12), temos observado que um vibratome produz, sem dúvida, os resultados mais confiáveis no que diz respeito a ambos os viabilidade global das culturas e da reprodutibilidade a conseqüência padrões nervosas. Em contraste, as fatias preparadas usando um helicóptero tecido McIlwain 3 mostrou-se completamente inviável. Nós originalmente empregado um método guilhotina
Access restricted. Please log in or start a trial to view this content.
Agradecimentos
Os autores agradecem a fonte original para a idéia de realizar cultura fatia em embriões de ratos 5. Gostaríamos de agradecer Joachim Kirsch ao apoio científico generoso e Degen Anna para agir como nosso gofer durante as filmagens. Este trabalho foi financiado pela Fundação Alemã de Pesquisa (Deutsche Forschungsgemeinschaft: Sonderforschungsbereich 488, Teilprojekt B7/B9) e da Universidade de Heidelberg (Redes de Excelência Cluster Cellular).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| HBSS 10x | GIBCO, by Life Technologies | 14180 | |
| Dissection tools | Fine Science Tools | various | |
| L.M.P. agarose | Invitrogen | 15517-022 | |
| Whatmann paper | Whatman, GE Healthcare | 3030917 | |
| Shortened firepolished pipettes | |||
| DMEM | GIBCO, by Life Technologies | 41966 | |
| FBS | GIBCO, by Life Technologies | 10270-106 | |
| Pen Strep | GIBCO, by Life Technologies | 15140 | |
| L-glutamine 100x | GIBCO, by Life Technologies | 25030 | |
| Vibratome | Microm International | HM 650 V | |
| Fluorescent microscope | Olympus Corporation | BX61WI | |
| analySIS | Soft Imaging System | ||
| Millicell-CM inserts | EMD Millipore | PICMORG 50 | |
| 10 cm culture plates | Greiner Bio-One | 633171 | |
| LOCTITE 406 | Henkel Corp | 142580 | |
| Razor blades | Thermo Fisher Scientific, Inc. | none | |
| Dissecting microscope | Nikon Instruments | SMZ800 | |
| HEPES | Carl Roth Gmbh | 9105.2 | |
| Glucose | Sigma-Aldrich | G7021 | |
| x4 objective | Olympus Corporation | PL series | |
| x10 objective | Olympus Corporation | UPLFL –PH series | |
| Filter | Olympus Corporation | U-MNIBA2 | |
| CCD camera | Soft Imaging System | SIS F-View II | |
| Equipment for heated chamber | Leica Microsystems | CTI-Controller 3700 and incubator S #11531171 |
Referências
- Tucker, K. L., Meyer, M., Barde, Y. A. Neurotrophins are required for nerve growth during development. Nat Neurosci. 4, 29-37 (2001).
- Brachmann, I., Jakubick, V. C., Shaked, M., Unsicker, K., Tucker, K. L. A simple slice culture system for the imaging of nerve development in embryonic mouse. Dev Dyn. 236, 3514-3523 (2007).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of neuroscience methods. 59, 5-9 (1995).
- Katz, L. C. Local circuitry of identified projection neurons in cat visual cortex brain slices. J Neurosci. 7, 1223-1249 (1987).
- Hotary, K. B., Landmesser, L. T., Tosney, K. W. Embryo slices. Methods Cell Biol. 51, 109-124 (1996).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados