Method Article
Nucleofection e Cultura Primária de Neurônios do hipocampo do rato embrionárias e Cortical
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve os passos necessários para dissecar, transfectar via de eletroporação e neurônios do hipocampo e da cultura do mouse cortical. Curto prazo, as culturas podem ser utilizados para estudos sobre crescimento do axônio e orientação, enquanto culturas a longo prazo podem ser usados para estudos de sinaptogênese e análise espinha dendrítica.
Resumo
Neurônios do hipocampo e cortical tem sido amplamente utilizado para o estudo do sistema nervoso central (SNC) de polarização neuronal, axônio / dendrite conseqüência, e formação de sinapses e função. Uma vantagem do cultivo desses neurônios é que eles prontamente polarizar, formando axônios e dendritos distintivo, sobre um substrato bidimensional em densidades muito baixas. Esta propriedade tornou-os extremamente útil para determinar muitos aspectos do desenvolvimento neuronal. Além disso, através do fornecimento condicionado glial para estes neurônios que continuará a desenvolver, formando conexões sinápticas funcionais e sobreviver por vários meses em cultura. Neste protocolo, esboçamos uma técnica para dissecar, cultura e transfectar neurônios do hipocampo e embrionárias de camundongos cortical. Transfecção é realizado por electroporating DNA nos neurônios antes do plaqueamento via nucleofection. Este protocolo tem a vantagem de expressar proteínas de fusão fluorescente-tag no início do desenvolvimento (~ 4-8hrs após o plaqueamento) para estudar a dinâmica e função de proteínas durante a polarização conseqüência axônio, e de ramificação. Também descobrimos que este transfecção único antes do plaqueamento mantém a expressão da proteína fluorescente-tag de fusão em níveis adequados para a imagem latente durante toda a vida do neurônio (> 2 meses em cultura). Assim, esta metodologia é útil para estudar a localização de proteínas e função ao longo do desenvolvimento do SNC, com pouca ou nenhuma perturbação da função neuronal.
Protocolo
1. Preparação de Lamelas e Câmaras
- Preparação de lamelas limpo e câmaras é essencial para culturas saudáveis. Atalhos não deve ser tomado em qualquer uma dessas etapas.
- Lavar as lamelas (redondo 12mm ou 22mm, de vidro alemão - Carolina Marca Assistant) durante a noite em ácido nítrico concentrado (HNO3) em uma jarra de vidro dedicado ou copo.
- Retirar as lamelas de ácido nítrico e lavar extensivamente (5-7x) em água deionizada.
- Separar as lamelas e seco em uma capela de fluxo laminar ou gabinete de biossegurança. Quando seca, esterilizá-las com a luz UV por 30 minutos. Lugar lamínulas esterilizadas em pratos de Petri estéreis para armazenamento. Se os neurônios plaqueamento em lamínulas 12 milímetros diretamente lamínulas lugar em um prato estéreis de 35 mm e prossiga para a Secção 2.
- Câmaras de imagens são construídos por perfuração de um furo 15mm no fundo de pratos de Petri 35 milímetros (remover todas as rebarbas) e anexar as lamelas limpos com uma mistura 3:1 de parafina e vaselina.
- Derreta a parafina / mistura de geléia de petróleo em um tubo cônico dentro de um banho de água fervente. Use um pincel pequeno e revestimento de baixo do prato ao redor do buraco 15mm. Certifique-se manter a parafina agitação / mistura de geléia de petróleo, uma vez que irá separar. Isso geralmente resulta em câmaras coladas com uma maior concentração de vaselina, que se tornará viscoso quando os pratos são colocados na incubadora, resultando em descolamento lamela. A parafina restante / vaselina pode ser armazenado em temperatura ambiente.
- Coloque o prato de cabeça para baixo em uma bandeja plana e coloque a lamínula sobre o buraco. Calor em 80 ° C forno até que a mistura de parafina é derretida (~ 10 minutos). Retire os pratos em uma superfície plana e deixe o jogo mistura de parafina.
- Vire os pratos mais e esterilizar tanto o interior das tampas e os fundos de câmaras com luz UV.
- Lamínulas casaco ou regiões copo de câmaras com 1.0mg/mL Poly-d-lisina (30kDa) em borato tampão (0,1 M de borato de sódio, pH 8,5) por uma hora. Enxágüe 3-5 vezes com grandes quantidades de água grau cultura de tecido deionizada. Certifique-se de remover todos os vestígios de tampão borato. Seco e use imediatamente ou armazenar câmaras / lamínulas para uso posterior. Nós usamos geralmente lamínulas limpo dentro de um mês de preparação.
2. Preparação de Dissection Neuronal e meio de cultura
- Prepare o suporte de dissecção (DM) pela adição de quantidades adequadas de HBSS 10x e HEPES 100X para o tecido de água grau cultura. Armazenar a 4 ° C. Manter em gelo durante a dissecção.
- O dia antes da dissecção preparar o meio de revestimento (PM) e sem soro médio (SFM). PM é composto por Medium Neurobasal, B27 suplemento, 2 mM de glutamina, glicose 0,3%, 37,5 mM NaCl e 5% de soro fetal bovino (FBS). SFM é composto por Medium Neurobasal, B27 suplemento, 2 mM de glutamina, glicose 0,3% e 37,5 mM NaCl.
- Faça apenas o suficiente para a dissecção e armazenar em um cultura de tecidos incubadora durante a noite com a tampa entreaberta para que a temperatura eo teor de CO 2 da equilibra médio. Nós adicionamos glicose extra e aumentar a osmolalidade de aproximadamente 310mOsm com NaCl. Encontramos as culturas fazer melhor em uma osmolaridade mais fisiológica (osmolalidade Neurobasal é tipicamente 205-245mOsm).
3. Preparação da camada cortical Glial Alimentador de longo prazo Culturas
- Se a longo prazo são culturas que estar preparado, realizar esta parte do protocolo de duas a três semanas antes de continuar com as dissecações cortical ou do hipocampo.
- Prepare médio glial (GM) com MEM, a glicose 0,3%, penicilina / estreptomicina e soro de cavalo de 10%.
- Euthanize filhotes P1-P3 do mouse pelo resfriamento em gelo por 5 minutos. Retire cada filhote do gelo e spray com etanol 70%. Rapidamente decapitar com uma tesoura. Remova todo o cérebro a um prato contendo frio DM (passo 2.1).
- Remova os dois hemisférios cerebrais e das meninges. Neocórtex o consumo e remover para um novo prato que não contém mídia. Prepare córtices de 4 cérebros total.
- Picar os córtices com uma lâmina de barbear limpa, estéril mais fino possível e remover o tecido cortado com uma pipeta de plástico para um tubo cônico de 50 mL contendo 12 mL de frio DM. Adicionar tripsina e DNase para concentrações finais de 0,25% (1,5 mL) e 0,1% (1,5 mL), respectivamente. Incubar em banho-maria a 37 ° C por 10 minutos, sob agitação intermitente.
- Remova o tubo que contém o tecido cortical e limpar cuidadosamente com etanol 70% antes de trazer para a capa de cultura de tecidos. Tecido cortical pipeta cima e para baixo com uma pipeta de 10 mL aproximadamente 10-15 vezes, ou até mais pedaços desaparecem.
- Retornar o tubo a 37 ° C em banho-maria por mais 10 minutos, sob agitação intermitente.
- Limpe cuidadosamente o tubo com etanol 70% e trazê-lo de volta para a capa de cultura de tecidos. Pipeta o tecido cortical cima e para baixo com um m 5L pipeta cerca de 10-15 vezes, ou até que os pedaços desaparecem.
- Adicionar 15 mL de GM quente e centrifugar a 200xg (1000rpm) por 10 minutos.
- Elimine o sobrenadante, ressuspender as células peletizada em 20 mL de GM fresco e contar com um hemocitômetro. Placa 5 7.5x10 6 células em 15 mL de GM por 75 centímetros balão 2.
- Depois de um dia e cada 2-3 dias subseqüentes na cultura, desalojar células soltas batendo o frasco contra a sua mão. Remova a mídia, juntamente com as células desalojadas e substituir com 15 mL de GM fresco.
- Glia pode ser colhida após 1-2 semanas de crescimento nos frascos, quando eles estão prestes 70-100% confluentes. Para preparar lamínulas individuais revestidos com glia, lugar de ácido nítrico 6 limpos e esterilizados 25 milímetros lamínulas redondas em um prato de 10cm, e coloque 3 pontos da mistura 3:1 de parafina / vaselina em cada lamela em um padrão triangular com um pequeno pincel . Tratar pratos aberto com luz UV por 30 minutos. Brasão as lamelas com 0,1 mg / mL Poly-d-lisina (30kDa) em tampão borato de uma hora, depois lave bastante (3-5x) com água estéril grau de cultura de tecidos deionizada e deixar secar.
- Retirar o balão da glia, contendo a partir de incubadora, descartar a médio e enxágüe com 5 mL de pré-aquecido tripsina / EDTA. Remover a solução de tripsina / EDTA do frasco e pipeta de 3 mL de frescos pré-aquecido tripsina / EDTA para o balão. Incubar o balão durante 1 minuto a 37 ° C antes de adicionar 5 mL de GM para parar o tripsinização.
- Remova o frasco da glia por repetidas pipetagens 10-15 vezes, e depois transferir os meios de comunicação a um tubo de 15 mL cônico. Centrifugar a 200xg (1000rpm) por 8 minutos. Remover o sobrenadante e adicionar 10 mL de GM, contagem de células, e placa de 5x10 5 células em 12,5 mL de GM por 10 centímetros prato contendo as lamelas.
- Troca o meio com frescos pré-aquecido GM a cada 2-3 dias. O dia antes da dissecção neurônio, remova a GM e substituir com SFM (seção 2.2). Utilize este SFM glial-condicionado no passo 4,12 quando a inundação culturas corticais ou hipocampais.
4. Dissecação cortical e / ou hipocampo e Eletroporação
- Remover quantidades apropriadas de soluções nucleofection (Lonza), combinar e à temperatura ambiente antes de iniciar a dissecação. Como a solução Nucleofection tem uma duração limitada quando combinado, só combinar a quantidade necessária para cada preparação (100 mL por transfecção).
- Euthanize um rato grávidas em E15.5 com CO 2 (dia de plug é E0.5) e remover o útero de uma placa de Petri de 10 cm. Remover fetos e decapitar em frio DM (seção 2.1).
- Remova todo o cérebro em um prato separado de DM frio e com uma agulha de tungstênio dobrado, remova os dois neocórtices. Remove as meninges com micropinças e córtices lugar em novo prato da DM frio. Com uma tesoura pequena íris ou Wecker, remova o córtex ou hipocampo e coloque em um tubo de 1,5 mL cheio Eppendorf com 1,0 mL de frio DM. Manter este tubo em gelo.
- Depois de dissecar todos os córtices ou hipocampo, adicione 110 mL de tripsina 2,5% para o tubo Eppendorf contendo o tubo de tecido e coloque em uma incubadora de 37 ° C por 20 minutos.
- Remover o sobrenadante e lavar córtices ou hipocampo com 1,0 mL PM (seção 2.2) invertendo suavemente o tubo Eppendorf. Repetir a lavagem duas vezes, deixando 1 mL da PM no tubo.
- Triturar os pedaços 15 vezes com uma pipeta P1000, e remover as células sobrenadante / para um novo tubo de 15 mL cônico contendo 4 mL de PM, deixando qualquer pedaços que permanecem no tubo de Eppendorf.
- Girar o tubo de 15 ml em 20xg (350 rpm) por 7 minutos com o freio. Desprezar o sobrenadante e adicionar 100 mL de pré-misturado, a solução nucleofection temperatura ambiente (Lonza) para cada transfecção. Triturar 5 vezes com um movimento suave para cima e para baixo da pipeta P1000.
- Remover 100 mL da solução de mistura nucleofection / célula a cada tubo Eppendorf novo e adicionar a quantidade adequada de DNA. Por muito tempo as culturas termo geralmente usamos 1-2μg de DNA por transfecção. No entanto, este etiquetas apenas uma pequena proporção <10% dos neurônios na cultura. Geralmente usamos 5-10μg de DNA por transfecção se querem maior eficiência de transfecção para a cultura de curto prazo. Temos utilizado até um total de 40μg de DNA, quando transfecting com dois plasmídeos diferentes. Plasmídeos são armazenadas em tampão TE a 1μg / mL.
- Adicionar suspensão de células / DNA para a cubeta (Lonza) e electroporate as células do Nucleofector (Lonza), usando o programa O-005 (neurônios do SNC Mouse).
- Trabalhando rapidamente, adicionar 500 mL da PM pré-aquecido e equilibrado para a cuvete e remoção da solução / células para um novo tubo de 1,5 mL Eppendorf. Adicionar PM suficiente para trazer o volume de cada transfecção a 1,0 mL. Contar as células com um hemocitômetro e placa em 3-5x10 3 células / cm 2 para as culturas jovens, ou 5-10x10 3 células / cm 2 para o longo prazo culturas.
- De curto prazo culturas, inundar a placas de cultura de 35mm com 2,0 mL de aquecido, CO 2-SFM equilibrada após uma hora de galvanização. Se estiver usando lamínulas, nós removemos a metade da PM e substituí-lo com SFM, em seguida, repita mais duas vezes. Nem as câmaras cheias de imagens ou lavar os resultados lamínulas em um teor muito baixo de soro (<0,5%). Curto prazo culturas não precisa ser cultivada com uma camada de alimentação glial e não precisam ser re-alimentados.
- A longo prazo culturas, nós removemos uma lamela glia coberto com três pontos de parafina / vaselina e invertê-lo em cima do buraco 15 milímetros no prato de 35 mm, uma hora após o início do cultivo. Dois mililitros do SFM condicionado do prato glial é então adicionado à câmara de imagem. Para alimentar as culturas de longo prazo, nós removemos um terço do SFM cada 2-3 dias e substituí-lo com frescos, pré-aquecido e CO 2-SFM equilibrada.
5. Resultados representativos:
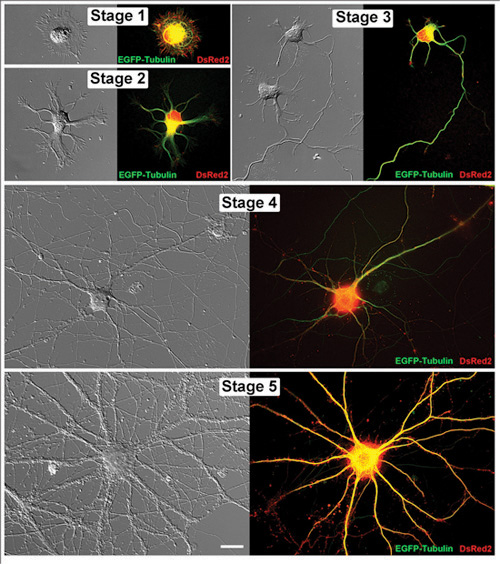
Figura 1. Viva os neurônios do hipocampo em fases sucessivas de desenvolvimento. Emparelhados imagens de representante vivo neurônios do hipocampo são mostrados como tanto uma imagem de contraste de interferência diferencial e uma micrografia correspondente fluorescente. Cada uma dessas células tem sido transfectadas com EGFP-tubulina e DsRed2 em vetores pCAX. Os neurônios foram fotografadas no dia seguinte in vitro (DIV): Fase 1 (1DIV), Stage 2 (1DIV), Fase 3 (2DIV), Fase 4 (11DIV) e Stage 5 (32DIV). Barra de escala é 20Hm.
Discussão
Este protocolo para cultivo embrionário neurônios do hipocampo do rato e cortical foi desenvolvido como uma modificação do protocolo de Banker, que usa 1,2 neurônios de rato. Nós temos usado esse protocolo para mouse cultura e neurônios hamster bem 3,4,5,6,7. Este protocolo funciona igualmente bem para ambos os neurônios do hipocampo e neocortical e é semelhante a um protocolo publicado pela Meberg e Miller 8. Geralmente, nós usamos os neurônios do hipocampo para o longo prazo de cultura, porque eles estão bem caracterizadas e um sistema modelo mais estabelecida. Além disso, são susceptíveis de conter uma população mais homogênea de neurônios do neocórtex. No entanto, os neurônios neocorticais cultivadas usando este protocolo também sobrevivem e se diferenciam de forma semelhante (dados não publicados). Nós usam rotineiramente os neurônios do hipocampo e neocortical para a cultura de curto prazo. Dissecção do neocórtex também resulta em neurônios substancialmente mais (1.5x10 6 neurônios por par de córtices) do que a dissecação do hipocampo (2.5x10 5 neurônios por par de hipocampo), o que torna uma melhor escolha do material para secar Ocidental, por exemplo.
Como acontece com qualquer cultura primária, é essencial para minimizar o tempo que leva desde a morte do animal para o revestimento das células. Ele geralmente leva 10-20 dissecções para se tornar consistentemente rápido em dissecção e revestimento. Além disso, ao trabalhar com o Nucleofector Lonza, é fundamental para trabalhar com rapidez durante o processo de eletroporação, como a viabilidade dos neurônios diminui rapidamente se forem deixados no buffer nucleofection.
Grande parte da nossa imagem é realizado com microscopia de fluorescência interna reflectância total (TIRFM). Este tipo de microscopia só é capaz de imagem várias centenas de nanômetros além da lamela. Portanto, as áreas dos neurônios que freqüentemente imagem, o cone de crescimento axonal e espinhas dendríticas, devem ser respeitados diretamente para a lamela. Assim, usamos as culturas de baixa densidade que exigem alimentação glial de longo prazo de cultura. Temos usado as culturas de maior densidade (> 2x10 4 células / cm 2), sem camadas de alimentação glial, a longo prazo culturas e descobriram que eles sobrevivem muito bem com a alimentação pouco. No entanto, as espinhas dendríticas desses neurônios são muitas vezes muito longe do substrato para a imagem em TIRFM, embora possam ser facilmente detectados com ampla microscopia de campo ou microscopia confocal.
Na maioria dos nossos estudos, transfectar neurônios antes do plaqueamento, e ter imaginado proteínas fluorescentes marcado por até três meses em cultura. Esta expressão de longo prazo de proteínas fluorescentes marcado nos dá confiança de que, ao utilizar baixas concentrações de DNA (1-2μg) que não estão produzindo artefatos superexpressão nos neurônios. No entanto, este procedimento também pode ser usado para estudar a superexpressão de proteínas se grandes quantidades de DNA são utilizadas (10-20μg). Os plasmídeos que usamos para transfecção neurônios geralmente contêm proteínas de fusão EGFP ou mCherry, embora também rótulo do citoplasma neuronal com DsRed2 ou EGFP sozinho. Esta técnica funciona bem eletroporação com um número de vetores. Nós preferimos plasmídeos que contêm um promotor de β-actina com um enhancer CMV e β-globina cauda poli-A (pCAGGs ou pCAX plasmídeos) 9, devido aos níveis relativamente altos de expressão, eo fato de que eles são bem tolerados pelos neurônios tanto na cultura de curto e longo prazo. Geralmente, as proteínas começam a se expressar dentro de cerca de 4 horas de revestimento e alcançar níveis suficientes para a imagem latente dentro de 10-24hs 10. Temos utilizado com sucesso CMV-promotor-driven plasmídeos em curto prazo culturas, mas descobriram que eles podem causar altos níveis de superexpressão que matam neurônios em longo prazo de cultura. No entanto, temos verificado que o condicionamento glial de culturas de baixa densidade ajuda na sobrevivência de neurônios transfectadas com CMV-promotor plasmídeos impulsionado, em comparação com maior densidade (não-glial alimentados) culturas.
Divulgações
Agradecimentos
Todos os procedimentos foram aprovados pela Universidade de Wisconsin Comissão do Animal Care e estavam em acordo com as diretrizes do NIH. Agradecemos ao Dr. Katherine Kalil para o uso generoso do seu dispositivo Nucleofector. Agradecemos também aos membros do laboratório de Dent para comentários sobre o protocolo. Este trabalho foi suportado por concessões do NIH R01-NS064014, Dana Foundation e Fundação para Whitehall EWD
Christopher Viesselmann, Jason Ballweg e Derek Lumbard contribuíram igualmente para este papel.
Materiais
* A maioria dos reagentes que nós armazenamos a -80 ° C podem ser armazenadas a -20 ° C também. Armazenando-os a -80 ° C aumenta sua vida útil e os resultados em culturas pouco mais consistente.
Referências
- Goslin, K., Asmussen, H., Banker, G., Goslin, K., Banker, G. Chapter 13. Culturing Nerve Cells. , 339-370 (1998).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Dent, E. W., Callaway, J. L., Szebenyi, G., Baas, P. W., Kalil, K. Reorganization and movement of microtubules in axonal growth cones and developing interstitial branches. J Neurosci. 19, 8894-8908 (1999).
- Dent, E. W., Kalil, K. Dynamic imaging of neuronal cytoskeleton. Methods Enzymol. 361, 390-407 (2003).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nat Cell Biol. 9, 1347-1359 (2007).
- Hu, X., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-dependent dynamic microtubule invasion of dendritic spines. J Neurosci. 28, 13094-13105 (2008).
- Lebrand, C. Critical role of Ena/VASP proteins for filopodia formation in neurons and in function downstream of netrin-1. Neuron. 42, 37-49 (2004).
- Meberg, P. J., Miller, M. W., Hollenbeck, P. J., Bamburg, J. R. Chapter 7. Neurons: Methods and Applications for the Cell Biologist. , 112-129 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Zeitelhofer, M. High-efficiency transfection of mammalian neurons via nucleofection. Nat Protoc. 2, 1692-1704 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados