É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Dispositivo microfluídicos para Recriando um microambiente do tumor
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Nós apresentamos o procedimento para a fabricação e operação de um dispositivo micro que recria heterogêneos microambientes tumorais In vitro. A variabilidade na apoptose dentro do tecido do tumor foi quantificada usando manchas fluorescentes e do coeficiente de difusão eficaz da doxorrubicina droga quimioterapêutica para o tecido do tumor foi avaliada.
Resumo
Desenvolvemos um dispositivo de microfluidos, que imita a entrega e depuração sistémica da droga a heterogéneos tridimensionais tecidos tumorais in vitro. Nutrientes fornecidos pela vasculatura não cheguem a todas as partes de tumores, dando origem a microambientes heterogéneos constituídos por tipos de células viáveis, quiescentes e necróticas. Muitos medicamentos contra o câncer não conseguem penetrar eficazmente e tratar todos os tipos de células por causa dessa heterogeneidade. As monocamadas de células cancerosas não imitam esta heterogeneidade, tornando-o difícil de testar drogas de cancro com um modelo in vitro apropriado. Nossos dispositivos microfluídicos foram fabricados fora do PDMS utilizando litografia macia. Esferóides multicelulares de tumores, formadas pelo método de gota suspensa, foram inseridos e constrangidos em câmaras rectangulares sobre o dispositivo e mantida com perfusão contínua meio de um dos lados. A forma rectangular das câmaras do dispositivo criado gradientes lineares dentro do tecido. Manchas fluorescentes foram utilizados para quantificar thvariabilidade e na apoptose dentro do tecido. Tumores do dispositivo foram tratados com a droga quimioterapêutica fluorescente doxorrubicina, microscopia de lapso de tempo foi usado para controlar a sua difusão para o tecido, e o coeficiente de difusão eficaz foi estimada. O método de gota pendente permitiu rápida formação de esferóides uniformes de várias linhas de células cancerosas. O dispositivo activado crescimento de esferóides por até 3 dias. As células na proximidade do fluxo médio foram minimamente apoptótica e aqueles longe do canal foram mais apoptótica, o que precisamente imitando regiões em tumores adjacentes a vasos sanguíneos. O valor estimado do coeficiente de difusão doxorrubicina concordou com um valor previamente relatada em câncer de mama humano. Porque a penetração e retenção de drogas em tumores sólidos afecta a sua eficácia, acreditamos que este dispositivo é uma importante ferramenta na compreensão do comportamento de drogas, e desenvolvimento de terapias do cancro novos.
Protocolo
1. Fabricação de dispositivos
Replicação de características microfluídicos em materiais elastoméricos baseou-se no método descrito por Duffy et al. 1
- Elastómero Mix (polidimetilsiloxano; PDMS) e agente de cura a partir do kit de elastómero de silicone (Dow Corning, Midland, MI) numa proporção em peso 9:1 e derramar sobre o mestre para formar uma camada de 4 mm de espessura. Degas para remover as bolhas de ar e cura a mistura a 60 ° C durante 5 horas. Peel curado PDMS do molde para se obter um selo de características de fluxo do elastómero.
- Faça furos para entradas e saídas através de um 1,5 milímetros biópsia com punch (Miltex, York, PA) montado em uma furadeira. Retire todos os restos.
- Submeta o lado características do carimbo e uma lâmina de vidro limpa para plasma de oxigênio por 8 minutos em um etcher plasma de oxigênio. Trazer as superfícies tratadas imediatamente em contacto para formar uma ligação entre eles. Manter o conjunto a 60 ° C em um aquecedor de corrediça, pelo menos, 5 horass para fortalecer o vínculo.
- Ligue 0,032 "ID tubagem de PTFE (Cole Parmer, Vernon Hills, IL) para as entradas e saídas que utilizam uma interface de luer lock macho ligado a conectores luer lock fêmea farpado conectores (Qosina, Edgewood, NY).
- Defina-se a montagem de fluxo, utilizando válvulas desligado e um Y-conector (Upchurch Científica, Oak Harbor, WA; Figura 1). Montar o dispositivo para o microscópio. Anexar seringas para tubulação usando 20G 1,5 "agulhas (BD Bioscience, Rockville, MD).
2. Formação de esferóides uniformes
Esferóides foram formados pelo método de gota suspensa 2,3.
- Tripsinizar células sob um capuz estéreis de cultura de células.
- Centrifugar as células tripsinizadas a 2000 rpm durante 5 minutos e ressuspender em 6 ml de meio fresco. Dilui-se a solução-mãe a uma concentração final desejada (Tabela 1).
- Retire a tampa de uma placa de 48 poços e colocá-lo de cabeça para baixo no sterilized capô. Regiões circulares correspondentes a cada poço são aparentes na tampa. Encher cada poço da placa com 1 ml de água esterilizada para manter a humidade. Colocar uma gota de 20 ul da solução diluída de células em cada região circular utilizando uma micropipeta. Inverter cuidadosamente a tampa e colocá-lo sobre a placa assim, assegurar que as gotas não tocar as bordas das cavidades.
- Incubar a placa de poço a 37 ° C durante um número especificado de dias (Tabela 1). Um esferóide vai formar em cada gota em suspensão.
3. Introdução de esferóides no dispositivo
Consultar a Figura 1 e na Tabela 2 para esta secção.
- Esteriliza-se o dispositivo, através de lavagem com etanol a 70% introduzido através da entrada do fluxo. Posteriormente, lavar com PBS seguido de tampão HEPES meio de cultura celular. Deixar a seringa médio F S ligado ao tubo.
- Desenhar 2-3 esferóides em P seringa S, toque seringa para remover as bolhas de ar, eanexar à entrada do dispositivo de embalagem.
- Abrir válvula de entrada V Pin e Fin V perto. Abrir a válvula de saída Pout V e V Fout perto. Segurar a seringa de embalagem vertical com a agulha a apontar para baixo; observar como esferóides se depositam no fundo da seringa para dentro do conector luer lock da agulha. Empurrar o êmbolo da seringa de embalagem e esferóides relógio entrar no tubo e fluir para dentro do dispositivo. Uma vez que apenas a válvula de saída da embalagem é aberta, um esferóide vai entrar na câmara do dispositivo e ser retido por mensagens na parte de trás (Fig. 2).
- Fechar válvula de entrada V Pin e saída da válvula Pout V. F montar a seringa S sobre uma bomba de seringa. Abrir a válvula V Fin e válvula V Fout. Meio de fluxo para o dispositivo de 3 ul / min.
4. Introdução do agente de detecção de apoptose (CaspGLOW)
Após a embalagem câmaras com esferóides, para permitir o equilíbrio up a 24 horas para estabelecer gradientes de nutrientes e microambientes, antes de introduzir a apoptose ou a detecção de agentes terapêuticos. Uma vez que os tecidos em câmaras estão em contacto com as paredes impenetráveis de topo e de fundo, não existem gradientes de nutrientes ao longo da espessura (0,15 mm) do tecido. Após 24 horas de incubação, todas as camadas de células ao longo da espessura do tecido é, portanto, equivalente a heterogeneidade e é apenas numa direcção para longe do canal de fluxo.
- Desligue V Fin, parar a bomba de seringa, remover a seringa S F a partir da bomba e substituí-la por uma seringa com meio contendo 0,25 ul / ml de Red CaspGLOW activa da caspase-3 marcador (Red-DEVD-FMK; Biovision, Mountain View, CA).
- Manualmente lave de 0,7 ml desta solução por meio do dispositivo para assegurar o deslocamento do meio velho. Montar a seringa sobre a bomba, reiniciar o fluxo, e aberto Fin V. Ao longo de um período de 5-8 horas, a apoptose detecção difunde agente em tele tecido e fluoresce em regiões mais brilhantes apoptóticas. Agente apoptose detectar a esta concentração é mantida em todas as soluções de fluxo posteriores para dentro do dispositivo.
Nota:
- Heterogeneidade do tecido pode ser confirmada através da obtenção de perfis de intensidade de fluorescência linear como descrito na Secção 6. Os perfis devem mostrar gradientes espaciais na apoptose, o que confirma que o tecido é heterogénea em relação à viabilidade celular.
- CaspGLOW Verde Activo marcador Caspase-3 (Fluoresceína-DEVD-FMK; Biovision) também pode ser usado para detectar a apoptose. Este marcador contém o fluoróforo verde fluoresceína em vez do fluoróforo vermelho rodamina.
5. Introdução do agente terapêutico
- Seguir o procedimento em passos 4,1-4,2 para introduzir 10 mM de cloridrato de doxorrubicina (Dox, Sigma-Aldrich, St. Louis, MO) contendo agente de detecção de apoptose.
- Continuar o fluxo do therapesolução agente UTIC por um período fixo de tempo. Válvula de corte Fin V e desligar a bomba de seringa. Substituir o tratamento com uma seringa seringa meio fresco contendo a apoptose detecção do agente. Permitir o fluxo de meio fresco durante 24 -36 horas, enquanto monitorando continuamente o tecido sob um microscópio.
6. Time-lapse Microscopia e Estimativa dos coeficientes de difusividade de drogas
Para a obtenção de dados de fluorescência mais limpas, adquirir todas as imagens, concentrando-se o microscópio sobre as camadas inferiores de tecidos. Como não existem gradientes de nutrientes na direção vertical (ver Seção 4), as camadas inferiores de células são bons representantes de todas as outras camadas acima.
- O processo de aquisição de toda foi automatizado através de um script personalizado em IPLab (BD Bioscience, Rockville, MD). Adquirir imagens de luz transmitida e fluorescência do esferóide embalado com uma ampliação de 10x a cada 30 minutos (Fig. 3A). Acquire uma imagem da fluorescência de fundo antes da introdução de Dox. Para acomodar o grande tamanho da câmara (1000 um x 300 mm), adquirem duas imagens adjacentes e telha los juntos 4.
- Para a estimativa dos coeficientes de difusividade matemático de drogas, o primeiro passo é o de gerar perfis de intensidade médias lineares de fluorescência usando ImageJ Dox. Seleccionar uma região rectangular de interesse (ROI) que engloba o tecido dentro da câmara. Usar o comando Perfil Plot para gerar um perfil de intensidade média como uma função da distância a partir do canal de fluxo. Repita o procedimento para até 3 pontos de tempo diferentes.
- Obter uma imagem de fundo de fluorescência antes da introdução Dox para medir a autofluorescência do tecido. Subtraia a média da intensidade de fluorescência de fundo a partir dos perfis de intensidade obtidos e normalizar cada perfil com a intensidade máxima correspondente para obter
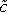 (X, t) (fig. 3B).
(X, t) (fig. 3B). - O próximo passo é avaliar o coeficiente de difusão eficaz da D Dox no tecido do tumor. Dox difusão pode ser representada pela seguinte equação 5

onde erfc é a função de erro complementar, x é a distância para o tecido a partir do canal, e t é o tempo após a introdução de Dox (consulte a fig. 3). Use o seguinte esquema iterativo em cada ponto de tempo considerado:- Acho um valor para D
- Calcule lado direito da equação em cada posição x
- Calcular a soma dos erros quadráticos (residual) entre os dois lados
- Modificar D para minimizar o resíduo
- Calcular a média dos valores óptimos de D obtidos em cada ponto temporal para estimar o coeficiente de difusão médio eficaz de Dox no tecido.
7. Resultados representativos:
Os dispositivos microfluídicos desde 1mm x 0,3 milímetros x 0,15 milímetros opticamente câmaras cultura acessível para o crescimento de tridimensional do tecido tumoral. Esferóides tumorais multicelulares foram levados para estas câmaras e foram mantidas por dois postes de filtro na parte de trás. O método de gota pendente permitiu rápida formação de esferóides de tamanho consistente e forma a partir de várias linhas celulares. Esferóides foram cultivadas com sucesso no dispositivo por até 3 dias. Crescimento nas câmaras foi associada com uma alteração reprodutível da microambientes dentro esferóides. A apoptose nas células ocorreu menos na proximidade do canal de fluxo e mais elevado para os tecidos. O dispositivo foi utilizado para estimar o coeficiente de difusão da doxorrubicina em tecido tumoral. O valor obtido de 8,75 x 10 -7 cm 2 s -1 concorda com o valor de 9,1 x 10 -7 cm 2 s -1 relatado anteriormente 6 em cancro da mama humano.
| Linha Celular | Concentração celular necessária | Tempo de Incubação |
| LS174T | 300 células / microlitro | 2-3 dias |
| T47D | 750 células / microlitro | 3-4 dias |
| MDA-MB-231 | 150 células / microlitro | 5-6 dias |
Tabela 1. Parâmetros para Spheroids gota suspensa
| Parte | Descrição |
| S F | Seringa fluxo |
| S P | Embalagem Seringa |
| V Fin | Válvula de admissão de fluxo |
| V Pin | Vedação da válvula de admissão |
| V Fout | Válvula de saída de fluxo |
| Pout V | Embalagem válvula de saída |
Tabela 2. Seringas e Válvulas em Configuração de Fluxo

Figura 1 Esquema do fluxo de configuração V Fin e Fout V:. Entrada de fluxo e válvulas de saída, sendo o pino V e V Pout: entrada de Embalagens e válvulas de saída; F S e S P: Fluxo e seringas de embalagem. A seringa de embalagem e acondicionamento de entrada e válvulas de saída são usados quando um esferóide é levado para dentro da câmara. A seringa e de fluxo de entrada e válvulas de saída de fluxo são utilizados para fluir médio subsequentemente.
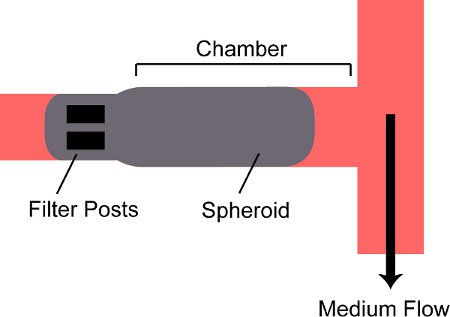
A Figura 2. Esquema de um esferóide preso em uma câmara no dispositivo. Um esferóide é vertido para dentro da câmara do dispositivo e é bloqueado por dois pos filtrots na parte de trás da câmara.

Figura 3. Doxorrubicina difusão em tecido tumoral no dispositivo. A. Fusão imagem transmitida e luz fluorescente vermelha de tecido, indicando a localização e a concentração de doxorubicina (a vermelho). Barra de escala representa 250 ^ m. B. perfil de intensidade de fluorescência linear Normalized doxorrubicina.
Discussão
A vasculatura em tumores é escassa e mal desenvolvidos 7,8. Existem regiões localizadas longe (> 100 um) a partir de vasos sanguíneos que são inacessíveis aos nutrientes e medicamentos fornecidos embora o 9 vasculatura. O microambiente heterogénea resultante contribui para a eficácia limitada de muitos agentes quimioterapêuticos 10. O dispositivo micro desenvolvido aqui recria um microambiente do tumor heterogéneo caracterizado por proliferação, as células quiescentes e ap...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pelo Instituto Nacional de Saúde concessão # 1R01CA120825-01A1, a Pesquisa Colaborativa Biomédica (CBR) Programa da Universidade de Massachusetts Amherst, e da Bolsa de Isenberg para Bhushan J. Toley. Agradecemos a valiosa contribuição de Tiago Schafer, o cinegrafista, narrador e editor deste vídeo.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
|---|---|---|---|
| Kit de elastômero de silicone | Adhesives Ellsworth | 184 Sil Elast Kit | |
| Miltex biópsia com punch | MedexSupply | MTX-33-31AA | 1,5 milímetros |
| Tubo de PTFE | Cole Parmer | EW-06417-31 | 0,032 ID " |
| Luer lock macho conector | Qosina | 65111 | |
| Conector fêmea luer bloqueio farpado | Qosina | 11556 | |
| Válvula de bloqueio | Idex Saúde e Ciência | P-721 | |
| Y-conector | Idex Saúde e Ciência | P-513 | |
| 20G 1,5 "agulhas | BD Bioscience | 305176 | |
| Tripsina-EDTA | Invitrogen | 25300-054 | |
| HEPES | Sigma | H-4034 | |
| CaspGLOW Fluoresceína | Biovision | K183-25 | |
| CaspGLOW Vermelho | Biovision | K193-25 | |
| Cloridrato de doxorrubicina | Sigma | 44583 | |
| LS174T | ATCC | CCL-188 | Cólon humano linha de células de carcinoma |
| T47D | ATCC | HTB-133 | Linha celular humana Carcinoma Ductal |
| MDA-MB-231 | ATCC | HTB-26 | Linha de células de adenocarcinoma mamário humano |
Referências
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Anal. Chem. 70, 4974-4984 (1998).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol. Bioeng. 83, 173-180 (2003).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods. Mol. Med. 140, 141-151 (2007).
- Kasinskas, R. W., Forbes, N. S. Salmonella typhimurium specifically chemotax and proliferate in heterogeneous tumor tissue in vitro. Biotechnol. Bioeng. 94, 710-721 (2006).
- Walsh, C. L. A multipurpose microfluidic device designed to mimic microenvironment gradients and develop targeted cancer therapeutics. Lab. Chip. 9, 545-554 (2009).
- Lankelma, J., Fernandez Luque, R., Dekker, H., Schinkel, W., Pinedo, H. M. A mathematical model of drug transport in human breast cancer. Microvasc. Res. 59, 149-161 (2000).
- Less, J. R., Skalak, T. C., Sevick, E. M., Jain, R. K. Microvascular architecture in a mammary carcinoma: branching patterns and vessel dimensions. Cancer. Res. 51, 265-273 (1991).
- Brown, J. M., Giaccia, A. J. The unique physiology of solid tumors: opportunities (and problems) for cancer therapy. Cancer. Res. 58, 1408-1416 (1998).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. Br. J. Cancer. 9, 539-549 (1955).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nat. Rev. Cancer. 6, 583-592 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados