É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem Alterar Forma Celular em Viver Drosophila Os embriões
Neste Artigo
Resumo
Desenvolvimento precoce da mosca da fruta, Drosophila melanogaster, é caracterizada por uma série de alterações nas células forma que são adequados para abordagens de imagem. Este artigo irá descrever as ferramentas básicas e métodos necessários para geração de imagens ao vivo confocal de embriões Drosophila, e incidirá sobre uma mudança a forma da célula chamada celularização.
Resumo
O desenvolvimento de Drosophila melanogaster embrião passa por uma série de alterações nas células de forma que são altamente suscetíveis a viver de imagem confocal. Alterações nas células forma no fly são análogas àquelas em organismos superiores, e eles dirigem morfogênese do tecido. Assim, em muitos casos, seu estudo tem implicações diretas para a compreensão de doenças humanas (Tabela 1) 1-5. Na escala sub-celular, essas mudanças forma da célula são o produto de actividades que vão desde a expressão do gene de transdução de sinal, polaridade celular, a remodelação do citoesqueleto e do tráfico de membrana. Portanto, o embrião Drosophila fornece não só o contexto para avaliar mudanças no formato da célula como eles se relacionam com a morfogênese do tecido, mas também oferece um ambiente completamente fisiológica para estudar as atividades sub-celular que as células forma.
O protocolo aqui descrito foi concebido para uma mudança de imagem forma específica de células chamado celularização. Celularização é um processo de crescimento dramático da membrana plasmática, e em última análise, converte o embrião sincicial no blastoderma celular. Ou seja, a interfase do ciclo mitótico 14, a membrana plasmática invagina simultaneamente em torno de cada um dos núcleos ~ 6000 corticalmente ancorado para gerar uma folha de células epiteliais primárias. Contador para sugestões anteriores, celularização não é impulsionado por Miosina-2 contratilidade 6, mas em vez disso é alimentado em grande parte por exocitose da membrana interna das lojas 7. Assim, celularização é um excelente sistema para estudar o tráfico de membrana celular durante as mudanças de forma que necessitam de invaginação da membrana plasmática ou de expansão, tais como citocinese ou transversal dos túbulos (túbulos T) morfogênese no músculo.
Note que este protocolo é facilmente aplicado à imagem de outras alterações de células forma no embrião da mosca, e só requer pequenas adaptações, como mudar o estágio de colheita de embriões, ou usar "cola embrião" para montar o embrião de uma orientação específica (Tabela 1) 19/08. Em todos os casos, o fluxo de trabalho é basicamente o mesmo (Figura 1). Métodos padronizados para a clonagem ea transgenia Drosophila são usados para preparar ações mosca de estábulo que expressam uma proteína de interesse, fundida a proteína verde fluorescente (GFP) ou suas variantes, e estas moscas fornecer uma fonte renovável de embriões. Alternativamente, as proteínas fluorescentes / sondas são introduzidas diretamente em embriões de voar através de injeção direta micro-técnicas 9-10. Então, dependendo do evento de desenvolvimento e mudança de células forma a ser trabalhada, os embriões são recolhidos e encenado pela morfologia em um microscópio de dissecação e, finalmente, posicionados e montados de lapso de tempo imagem em um microscópio confocal.
Protocolo
1. Montar Copas de colheita de embriões
- Corte fora o fundo de um copo 100 mL Tri-milho, com uma lâmina de barbear, tornando a borda mais suave possível. Os copos são mais fáceis de lidar se você também aparar as três cantos fora do topo, embora isso não seja absolutamente necessário.
- Corte um quadrado de tela de arame (6 cm x 6 cm). Em um prato pré-aquecido quente, dentro de uma camada de fumaça capô, a praça de malha de arame em cima de um pedaço de pesados folha de alumínio. Empurre a borda inferior do corte do copo firmemente na malha quente. Aguarde alguns segundos e levantar a taça com a malha agora anexado. Se a folha também varas, apenas retire-a.
- Resfriar o copo durante a noite. Retire o excesso com uma tesoura de malha, e areia de desconto em qualquer arestas com uma lixa de grão fino.
2. Faça placas de Agar Suco de Maçã
- Num balão 6L, combine BD 100 g Agar Bacto e água destilada 3L. Autoclave do ágar por 30 minutos na configuração de escape lento.
- Num balão 2L com uma barra de agitação, combine 100 g de sacarose, 1L de suco de maçã, e 6 g de ácido p-hidroxibenzóico. Aquecer a solução à ebulição, agitando em um prato quente. Não deixe ferver por mais 2 minutos. Permitir a mistura de suco de maçã para esfriar e adicione com barra de agitação para o agar. Misturar completamente.
- Permitir que a solução combinada para esfriar em banho-maria a 60 ° C antes de verter em 60x15 milímetros pratos petri. Alternativamente, uma bomba peristáltica pode ser usada para dispensar o ágar. Permitir que as placas para esfriar a temperatura ambiente por pelo menos 4 horas. Pilha em Rubbermaid recipientes com uma camada de papel toalha molhada e armazenar a 4 ° C.
Notas:
- No outono ou no inverno, pode ser necessário adicionar um adicional de 100 mL de água para o ágar.
- A marca de placas de Petri é importante! Apenas os pratos BD Falcon encaixar os copos Tri-milho. Informações sobre pedidos específicos podem ser encontrados na tabela de Materiais abaixo.
3. Adicionar Flies GFP para as Copas de colheita de embriões
- Expandir ações GFP de acordo com as suas necessidades de coleta através da criação de garrafas de moscas cerca de duas semanas antes da imagem. Um frasco de moscas geralmente é mais do que suficiente para encher um copo de colheita de embriões com um mínimo de 50 fêmeas e 30 machos. Para melhor postura, moscas devem ser recém-eclosed (ou seja, menos de 5 dias pós-eclosão).
- Faça uma levedura colar enchendo um copo pequeno, com partes iguais Red Star fermento biológico seco e água destilada, e mexa até que o fermento é dissolvido. A pasta deve aproximar a consistência de manteiga de amendoim molhado. Mais fermento ou água pode ser adicionada para alterar a consistência. Colar de levedura pode ser usada por vários dias, e deve ser armazenado, coberto, a 4 ° C.
- Depois que o colar fermento está pronto, retire as placas de suco de maçã de 4 ° C de armazenamento. Streak a maçã suco de placas com a pasta de levedura, e permitir-lhes para aquecer a 22-25 ° C, o que incentivará postura.
- Dobre um papel de filtro circular no meio, depois ao meio novamente. Guarnição para 8-9 cm de diâmetro, e fazer as dobras de acordeão no quarto de círculo. Desdobrar o círculo, invertê-lo, e insira-o em um copo de coleta até tocar na malha. Certifique-se que o papel está seguro no copo para que ela não cair e esmagar as moscas. O papel de filtro é opcional, mas fornece um ambiente acolhedor para o acasalamento, e mantém a umidade no copo.
- Etiqueta com o nome de um copo de ações e data. Transferência das moscas da garrafa para o copo de coleta agitando a garrafa invertida sobre o cálice, e cobrir imediatamente o copo com um prato preparado suco de maçã. Fixe a placa para o copo com um elástico. Conjunto de copos de lado malha para cima em uma área com luz direta. Certifique-se que nenhuma sombra cair sobre o copo, como as moscas não estava bem no escuro.
- Mudar a placa de suco de maçã, se necessário. Duas horas de colecções, à temperatura ambiente, funcionam bem para celularização imagem.
4. Prepare uma Câmara de montagem
- Para preparar uma câmara de montagem para os embriões, corte um pedaço de fita dupla face 2-3 cm de comprimento e coloque-o em um slide, alinhando o eixo longitudinal da fita e slides. Corte um segundo 2-3 cm longo pedaço de fita dupla face e camada em cima do outro pedaço de fita, certificando-se de suas bordas estão alinhadas.
- Usando uma lâmina de barbear, fazer dois cortes de aproximadamente 3 mm no centro da fita e perpendicular ao longo eixo da lâmina. Remova a fita entre os cortes para fazer um canal. Pipeta uma gota de óleo Halocarbon 27 para o canal. Este canal é onde os embriões serão montadas.
Notas:
- Somente o ½ polegada Scotch fita dupla face é a espessura certa para acomodar os embriões.
- Oil Halocarbon 27 é oxigênio permeável, e assim permite a troca de oxigénio, evitando a desidratação do embrião. Devido ao seu índice de refração, Halocarbon Oil 27 é também ideal para o estadiamentoe imagem embriões.
5. Embriões Dechorionate
- Para coletar e embriões dechorionate, despeje o suficiente lixívia 50% para a placa de ágar suco de maçã para submergir completamente toda a superfície. Usando um microscópio de dissecação, como o Discovery Zeiss V8 com luz transmitida, para assistir os embriões para liberação dos seus córion. Assim que o córion solta e libera a partir de alguns embriões (30-60 segundos), despeje água sanitária e embriões em um coador de celular.
- Lavar embriões no filtro imediatamente e vigorosamente com água destilada a partir de uma garrafa de esguicho. Dab filtro em papel toalha. Se qualquer rosa é visto na toalha após dabbing, continue lavando os embriões com água.
- Use um pincel úmido para transferência de embriões 10-50 para um prato limpo suco de maçã (sem colar levedura). Pavio fora da água com a borda rasgada de uma toalha de papel e cobrir imediatamente os embriões com uma pequena quantidade de óleo Halocarbon 27.
Notas:
- Não use água sanitária Clorox. Em vez disso, use uma marca, como Bleach Austin A-1 comercial, que é
- Excesso de branqueamento ou lavagem insuficiente resultará em embriões com mushy celularização irregular.
6. Embriões palco e Monte
- Usando o microscópio de dissecação com luz transmitida, siga as orientações morfológicas de 20 a Bownes estágio embriões no prato. Utilizando uma pinça, a transferência de 5 mitótica ciclo de 11 ou 12 embriões, correspondendo a Bownes estágio 4, para o canal da câmara de montagem. Organizar embriões em uma linha, com os lados dorsal e ventral lado visível e lateral para baixo. Embriões são facilmente dispostos em esta orientação em petróleo sozinho. Não embriões multidão em conjunto, como eles vão privar os seus vizinhos de oxigênio uma vez que a lamínula é aplicado abaixo. (Deixar aproximadamente metade de um comprimento de embriões entre eles).
- Lay uma borda de uma tampa de 25x25 milímetros deslizar sobre a fita dupla face em um lado do canal. Soltar o deslizamento de capa a capa do canal. Se o ar é pego por baixo, aplique uma pequena quantidade de óleo Halocarbon 27 na borda da lamínula. Ação capilar vai puxar o óleo no canal e empurrar para fora do ar.
Notas:
- Outro recurso excelente para os embriões de preparo é o seguinte: Campos-Ortega, JA e Hartenstein, V. (1985). O desenvolvimento embrionário de Drosophila melanogaster. Springer-Verlag, de Berlim. Embora este livro não é mais publicado, cópias usadas são regularmente disponíveis no Amazon.com.
- Sempre usar o Halocarbon 27 Oil com moderação. Isso fará com que a montagem mais fácil. Ele também irá prevenir acidentais oozing do óleo para a objetiva do microscópio nas etapas seguintes de imagem.
7. Embriões imagem
- Como você continuar aqui, naturalmente, ser ditada pela mudança a forma da célula que você é imagem, ea pergunta que você está abordando. Para qualquer mudança de forma, coloque a sua câmara de montagem de cada um microscópio vertical ou invertida, encontrar o seu embriões por luz transmitida, e depois mudar para imagem confocal se concentrar em uma região de interesse. Aderir às melhores práticas para microscopia confocal, tais como os discutidos na MicroscopyU Nikon ( http://www.microscopyu.com/articles/confocal ). Ser particularmente rigoroso em embriões expondo sua vida como potência do laser menos possível, para evitar fotobranqueamento e fototoxicidade.
- Para celularização, nós imagem em um microscópio a laser 710 confocal Zeiss, usando um C-Apochromat 40x/1.2 W objetivo Corr. Este microscópio é instalado numa sala com temperatura controlada, com temperaturas variando entre 18-20 ° C. Enquanto o controle de temperatura não é absolutamente necessário, é melhor para o microscópio e torna a imagem mais consistente. Nós imagem regularmente em um único plano, perto do meio do embrião, a seguir a invaginações da membrana plasmática em secção transversal (Figura 2). Para simplesmente seguindo a dinâmica invaginação, 30-60 segundos de intervalo são suficientes para lapso de tempo de imagem, e os embriões devem suportar imagem para> 90 minutos sem sinais óbvios de privação de oxigênio.
- Depois de adquirir as imagens, eles podem ser analisados usando qualquer número de pacotes de análise de imagem, incluindo freeware dos Institutos Nacionais de Saúde, chamado ImageJ ( http://rsbweb.nih.gov/ij ). Os dados podem ser apresentados como filmes (Movie 1), seqüências (Figura 2), ou kymographs 21.
Nota:
- A água de imersão C Apochromat-40x/1.2 W Corr objetivo é bem adequada para imagens perto do embrião mid-section, devido à sua abertura, o que limita as aberrações para imagens de tecidos profundos em amostras aquosas, e dá alta resolução e alto sinal fluorescente. Além disso, este objectivotem uma distância muito longa de trabalho (220 mm). No entanto, os objectivos de imersão outras de água ou glicerina terá um bom desempenho, principalmente se a mudança de forma de células de interesse podem ser fotografada perto da superfície do embrião.
8. Método Alternativo: Embriões Monte com a "cola-embrião"
- Para a imagem mudar de forma uma célula que não celularização, pode ser necessário montar embriões em uma orientação específica que não é facilmente mantidos em petróleo sozinho. Para fazer isso, use um método alternativo de montagem ao descrito anteriormente. Comece por fazer "embrião-cola", combinando 20 cm de fita dupla-face com 250 mL de heptano em frasco de cintilação. Coloque o frasco de cintilação em um nutator ou plataforma rotativa, e misture durante a noite.
- Mergulhe uma ponteira amarela na cola do embrião, e então traçar a ponta ao longo de um slide, deixando um rastro de cola. Enquanto o heptano está evaporando, alinhar a sua encenado embriões na orientação necessária em um bloco de ágar. (Lembre-se que a superfície do embrião a ser trabalhada deve estar voltado para o ágar. Por exemplo, para a imagem mudar a forma da célula durante a formação do sulco ventral, montagem embriões com o seu lado ventral de frente para o ágar).
- Inverter o slide com cola, e pressione suavemente a trilha de cola contra os embriões no bloco de ágar. Agora inverta a lâmina novamente. Os embriões vai ser preso na orientação adequada. Adicionar duas camadas de fita dupla face em ambos os lados dos embriões, cobri-los com óleo Halocarbon 27, e aplicar uma lamela. Prosseguir com a imagem, como descrito acima.
9. Resultados representativos:
Se os embriões são saudáveis ea imagem é ótima, então celularização deve tomar 50-60 minutos, e as invaginações da membrana plasmática deve ingresso quase 40 microns. No entanto, se os embriões são over-branqueada de oxigênio, privado ou danificado por fototoxicidade, então invaginação será lento ou parar, em particular na área trabalhada. Tal deterioração da saúde do embrião muitas vezes resulta em desenvolvimento alteradas, e um fracasso para eclodir as larvas. Assim, por um rigoroso teste para a saúde do embrião após ensaio de imagem, mantenha o seu slides em uma câmara úmida para incubação e assistir no dia seguinte.
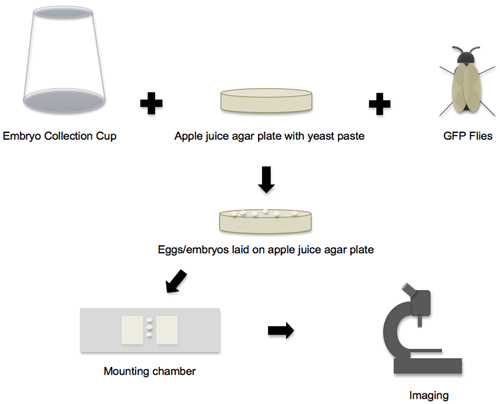
Figura 1. Fluxo de trabalho de colheita de embriões a imagem. O fluxo de trabalho do protocolo pode ser dividido em quatro fases principais. Na primeira fase, todos os suprimentos e componentes individuais estão preparados, e em seguida voa o copo de colheita de embriões, maçã placa de ágar suco e GFP são colocados juntos para criar o ambiente embrião-laying. Na segunda fase, os ovos e embriões que são colocadas nas placas de ágar suco de maçã são coletados. Na terceira fase, os embriões são removidos da placa, encenado e transferidos para a câmara de montagem. Na quarta fase, os embriões montados são gravadas em um microscópio confocal.
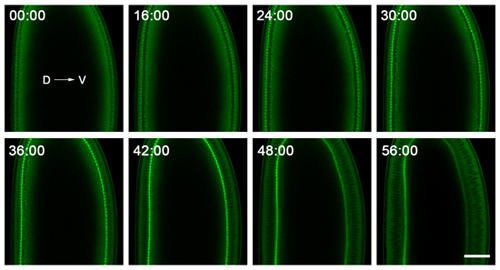
Figura 2. Dados representativos de lapso de tempo de imagem de celularização. Embriões são montados com dorsal (D) e ventral (V) os lados claramente visível, e são gravadas perto de seu meio para seguir as invaginações da membrana plasmática no cross-section. O embrião mostrado aqui expressa uma GFP-Miosina-2 sonda 6, que se concentra nas pontas das invaginações da membrana plasmática. Assim, acompanhando o ingresso desta frente ao longo do tempo dá a velocidade com que a membrana plasmática invagina. O ponto de tempo 0:00 minutos corresponde ao início celularização. Logo após o ponto de 56:00 minutos do tempo, a gastrulação inicia no lado ventral do embrião. Bar é de 40 microns.
Filme 1. Representante do filme de lapso de tempo de imagem de celularização. Este filme corresponde a Figura 2. Para gravar todo o processo de celularização, imagem iniciados no ciclo mitótico, antes 13, a captura de regressão sulco pseudocleavage, e continuou até a gastrulação movimentos foram vistos no lado ventral do embrião. As imagens foram coletadas em intervalos de um minuto. As intensidades foram aumentadas pós-aquisição para torná-lo mais fácil ver os movimentos gastrulação.
Clique aqui para filme
| Eventos de desenvolvimento e de tempo * | Célula muda de forma relacionada com | Um link para a doença ou a saúde humana | Referências recentes, com imagens ao vivo |
| Pseudo-clivagem formação de sulco (4; 90 minutos pf) | Citocinese | Poliploidia e câncer de progressão 1 | Mavrakis et al., 2009 8 Cao et al., 2010 9 |
| Celularização (5; 130 pf minutos) | Citocinese | Poliploidia e câncer de progressão 1 | Cao et al., 2008 10 Sokac & Wieschaus, 2008 11 |
| Formação de sulco ventral; invaginação Mesoderma (6; 180 minutos pf) | Constrição apical; transição epitelial-mesenquimal | Câncer de metástase 2 | Fox & Peifer, 2007 12 Martin et al., 2009 13 |
| Extensão Germband (7; 195 pf minutos) | Extensão convergente | Defeitos do tubo neural 3 | Bertet et al., 2004 14 Blankenship et al., 2006 15 |
| Tracheogenesis (11; 320 pf minutos) | Formação do tubo epitelial e ramificação | Angiogênese 4 | Caussinus et al., 2008 16 Gervais & Casanova, 2010 17 |
| Fechamento dorsal (14; 620 minutos pf) | Constrição apical | Cicatrização de feridas 5 | Gorfinkiel et al., 2009 18 Solon et al., 2009 19 |
Tabela 1. Exemplos de mudanças no formato da célula fotografada em embriões de mosca viva
* O número Bownes estágio e do tempo pós-fertilização (PF), quando cada evento começa, são listados de acordo com Campos-Ortega, 1985.
| Fly estoque | Rótulos | Referência original |
| Spider-GFP (95-1) | Membrana plasmática | Morin et al., 2001 22 |
| Resille-GFP (117-2) | Membrana plasmática | Morin et al., 2001 22 |
| GAP43-Vênus | Membrana plasmática | Mavrakis et al., 2009 8 |
| Spaghetti Squash-GFP (Sqh-GFP) | Miosina-2 | Royou et al., 2002 6 |
| E-caderina-GFP (Ecad-GFP) | Junções célula-célula | Oda et al., 2001 23 |
| GFP-Moesin | F-actina | Kiehart et al., 2000 24 |
| Utrophin-Vênus (Venus-Utro) | F-actina | Sokac et al., Resultados não publicados |
Tabela 2. Stocks úteis para imagens mudam de forma celular em embriões voar
Discussão
O protocolo aqui descrito permitirá a criação de imagens, ao vivo confocal de uma série de mudanças no formato da célula do embrião voar em desenvolvimento. GFP ações para geração de imagens pode ser preparado por um laboratório individual (Tabela 2), mas muitas dessas populações também estão à disposição do público de centros como Bloomington Drosophila stock Centro da Universidade de Indiana ( http://flystocks.bio.indiana.edu ) e Flytrap Centr...
Divulgações
Agradecimentos
Agradecemos Eric Wieschaus, que forneceu a base sobre a qual este protocolo foi desenvolvido. Nosso trabalho é apoiado por uma Verna & Marrs McLean Departamento de Bioquímica e Biologia Molecular Start-up Award, Baylor College of Medicine.
Materiais
| Name | Company | Catalog Number | Comments |
| Slides | Fisher Scientific | 12-550-343 | |
| Cover slips 25x25 | Fisher Scientific | 1 2-524C | |
| Squirt bottles (H2O) | Fisher Scientific | 02-897-11 | |
| 50 ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Bulbs for small pipets, 1 mL | Fisher Scientific | 03-448-21 | |
| Scintillation vials with caps | VWR international | 66021-533 | |
| Tri-Corn Beakers, 100 mL | Electron Microscopy Sciences | 60970 | |
| BD Falcon Petri dish 60x15mm | Fisher Scientific | 08757 100B | |
| BD Falcon Cell strainer | Fisher Scientific | 08-771-2 | |
| Yellow pipet tips | Rainin | L200 | |
| Stainless steel mesh, 304, 12x24 | Small Parts, Inc. | CX-0150-F-01 | |
| Glass 5¾ inch Pasteur Pipets | Fisher Scientific | 13-678-20B | |
| P4 Filter paper | Fisher Scientific | 09-803-6F | |
| Rubber bands | Office Max | A620645 | |
| Scotch double-sided tape, ½ inch | Office Max | A8137DM-2 | |
| Robert Simmons Expression paint brushes E85 round #2 | Jerry’s Artarama | 56460 | |
| Dumont #5 Forceps High Precision Inox | Electron Microscopy Sciences | 72701-DZ | |
| Razor blades | VWR international | 55411-050 | |
| Halocarbon Oil 27 | Sigma-Aldrich | H 8773 | |
| Heptane | Fisher Scientific | H360-1 | |
| BD Bacto Agar | VWR international | 90000-760 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| p-Hydroxybenzoic acid | Sigma-Aldrich | H5501 | |
| Red Star Active Dry Yeast | LeSaffre | 15700 | |
| Paper towels, C-fold | Kleenex | ||
| Heavy duty aluminum foil | Reynolds Wrap | ||
| Bleach | Austin’s A-1 Commercial | ||
| 100% Apple juice | Ocean Spray or Tree Top |
Referências
- Sagona, A. P., Stenmark, H. Cytokinesis and cancer. FEBS Lett. 584, 2652-2661 (2010).
- Baum, B., Settleman, J., Quinlan, M. P. Transitions between epithelial and mesenchymal states in development and disease. Semin Cell Dev Biol. 19, 294-308 (2008).
- Kibar, Z., Capra, V., Gros, P. Toward understanding the genetic basis of neural tube defects. Clin Genet. 71, 295-310 (2007).
- Jazwinska, A., Ribeiro, C., Affolter, M. Epithelial tube morphogenesis during Drosophila tracheal development requires Piopio, a luminal ZP protein. Nat Cell Biol. 5, 895-901 (2003).
- Martin, P., Parkhurst, S. M. Parallels between tissue repair and embryo morphogenesis. Development. 131, 3021-3034 (2004).
- Royou, A., Field, C., Sisson, J. C., Sullivan, W., Karess, R. Reassessing the role and dynamics of nonmuscle myosin II during furrow formation in early Drosophila embryos. Mol Biol Cell. 15, 838-850 (2004).
- Lecuit, T., Wieschaus, E. Polarized insertion of new membrane from a cytoplasmic reservoir during cleavage of the Drosophila embryo. J Cell Biol. 150, 849-860 (2000).
- Mavrakis, M., Rikhy, R., Lippincott-Schwartz, J. Plasma membrane polarity and compartmentalization are established before cellularization in the fly embryo. Dev Cell. 16, 93-104 (2009).
- Cao, J., Crest, J., Fasulo, B., Sullivan, W. Cortical Actin Dynamics Facilitate Early-Stage Centrosome Separation. Curr Biol. , (2010).
- Cao, J., Albertson, R., Riggs, B., Field, C. M., Sullivan, W. N. u. f. a Rab11 effector, maintains cytokinetic furrow integrity by promoting local actin polymerization. J Cell Biol. 182, 301-313 (2008).
- Sokac, A. M., Wieschaus, E. Local actin-dependent endocytosis is zygotically controlled to initiate Drosophila cellularization. Dev Cell. 14, 775-786 (2008).
- Fox, D. T., Peifer, M. Abelson kinase (Abl) and RhoGEF2 regulate actin organization during cell constriction in Drosophila. Development. 134, 567-578 (2007).
- Martin, A. C., Kaschube, M., Wieschaus, E. F. Pulsed contractions of an actin-myosin network drive apical constriction. Nature. 457, 495-499 (2009).
- Bertet, C., Sulak, L., Lecuit, T. Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation. Nature. 429, 667-671 (2004).
- Blankenship, J. T., Backovic, S. T., Sanny, J. S., Weitz, O., Zallen, J. A. Multicellular rosette formation links planar cell polarity to tissue morphogenesis. Dev Cell. 11, 459-470 (2006).
- Caussinus, E., Colombelli, J., Affolter, M. Tip-cell migration controls stalk-cell intercalation during Drosophila tracheal tube elongation. Curr Biol. 18, 1727-1734 (2008).
- Gervais, L., Casanova, J. In vivo coupling of cell elongation and lumen formation in a single cell. Curr Biol. 20, 359-366 (2010).
- Gorfinkiel, N., Blanchard, G. B., Adams, R. J., Arias, M. a. r. t. i. n. e. z., A, . Mechanical control of global cell behaviour during dorsal closure in Drosophila. Development. 136, 1889-1898 (2009).
- Solon, J., Kaya-Copur, A., Colombelli, J., Brunner, D. Pulsed forces timed by a ratchet-like mechanism drive directed tissue movement during dorsal closure. Cell. 137, 1331-1342 (2009).
- Bownes, M. A photographic study of development in the living embryo of Drosophila melanogaster. J Embryol Exp Morphol. 33, 789-801 (1975).
- Sokac, A. M., Wieschaus, E. Zygotically controlled F-actin establishes cortical compartments to stabilize furrows during Drosophila cellularization. J Cell Sci. 121, 1815-1824 (2008).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. Proc Natl Acad Sci U S A. 98, 15050-15055 (2001).
- Oda, H., Tsukita, S. Real-time imaging of cell-cell adherens junctions reveals that Drosophila mesoderm invagination begins with two phases of apical constriction of cells. J Cell Sci. 114, 493-501 (2001).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149, 471-490 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados