É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Dissecção e coloração de Drosophila Larval Ovários
Neste Artigo
Resumo
Como nichos e células-tronco se formam durante o desenvolvimento é uma questão importante com implicações práticas. No Drosophila Ovário, células-tronco germinativas e somáticas nichos sua forma durante o desenvolvimento larval. Este vídeo demonstra como dissecar, mancha e montar gônadas femininas do final de terceiro ínstar (LL3) Drosophila.
Resumo
Muitos órgãos depende de células-tronco para o seu desenvolvimento durante a embriogênese e para a manutenção ou reparação durante a vida adulta. Compreensão de como as células-tronco forma, e como eles interagem com seu ambiente é crucial para a compreensão da homeostase, desenvolvimento e doença. O ovário da mosca da fruta Drosophila melanogaster tem servido como um modelo influente para a interação de células-tronco germinativas (GSCS) com suas células somáticas de apoio (nicho) 1, 2. O local conhecido do nicho e as GSCS, aliada à capacidade de manipular geneticamente eles, tem permitido aos pesquisadores elucidar uma série de interações entre células-tronco e seus nichos 3-12.
Apesar da riqueza de informações sobre mecanismos de controle de manutenção GSC e diferenciação, relativamente pouco se sabe sobre como GSCS e seus nichos de forma somática durante o desenvolvimento. Cerca de 18 nichos somáticas, cujos componentes incluem celulares filamento terminal e as células da tampa (Figura 1), formam-se durante o terceiro instar larval 13-17. GSCS originam de células germinativas primordiais (PGCs). PGCs proliferam no início fases de larva, mas após a formação do nicho um subgrupo de PGCs torna-se GSCS 7, 16, 18, 19. Juntas, as células somáticas e de nicho a GSCS fazer uma unidade funcional que produz ovos durante toda a vida do organismo.
Muitas perguntas sobre a formação da unidade GSC permanecem sem resposta. Processos tais como a coordenação entre as células precursoras de nichos e de precursores de células-tronco, ou a geração de assimetria dentro PGCs como eles se tornam GSCS, pode ser melhor estudados na larva. No entanto, um estudo metódico do desenvolvimento larval ovário é fisicamente desafiador. Primeira, os ovários das larvas são pequenas. Mesmo em final de estágios larvais são apenas 100μm de diâmetro. Além disso, os ovários são transparentes e estão embutidos em um corpo de gordura branca. Aqui nós descrevemos um protocolo passo a passo para isolar ovários de final do terceiro instar as larvas Drosophila (LL3), seguido por coloração com anticorpos fluorescentes. Nós oferecemos algumas soluções técnicas para problemas como a localização dos ovários, coloração e lavagem de tecidos que não afundam, e certificando-se que os anticorpos penetrar no tecido. Este protocolo pode ser aplicado a fases anteriores larval e testículos larval também.
Protocolo
1. Postura de ovos
- Cinco dias antes da dissecação: permitir que as fêmeas põem ovos acoplado a por 2-4 horas em alimentos frescos suplementados com levedura. Para obter larvas sincronizados e bem desenvolvidas, é importante não ter superlotadas cultivadas (cerca de 30 ovos / frasco 25mm). Tipicamente, 7-16 fêmeas são usados por frasco, dependendo de quão bem eles estabelecem.
2. Seleção de larvas
- Prepare um prato de vidro de 9 dissecar bem cheio com meio de Ringer (NaCl 128mm, 2mM KCl, CaCl 2 1,8 mm, 4mm MgCl 2, 35.5mM sacarose, pH Hepes 5mM 6.9).
- Prepare filtros célula em uma placa de seis poços contendo meio de Ringer e colocá-lo no gelo. Alternativamente, usamos moldes feitos especialmente equipado com uma tela de náilon.
- Escolha larvas cronometrado de paredes finas frasco utilizando uma pinça biológicos (fórceps) e colocá-los no prato contendo o toque de dissecação.
- Transferência de uma larva fêmea para um poço limpo. Podemos distinguir fêmeas de machos por suas gônadas. Testículos são facilmente identificados como grandes formas ovais claro embutido no terço posterior da gordura corporal. Ovários femininos, localizada na mesma parte da gordura corporal, pode ser identificado como um muito menor, claro, esferas rodada.
3. Dissecção da larva
- Segure a larva para baixo apenas posterior ao cérebro com uma pinça e retire a cabeça com um segundo par de fórceps.
- Coloque a parte restante posterior no lado dorsal, com a traquéia virada para baixo.
- Segure a larva pelos espiráculos posterior com um par de fórceps e empurrá-lo para dentro lentamente enquanto o outro par está deslizando a cutícula posteriormente até cerca de metade da gordura corporal larval emerge.
- Segure firmemente a extremidade posterior e usar o outro par de pinças para prender vagamente a cutícula. Cuidado e lentamente afastar o fim posterior de modo que a cutícula eo slide intestino ligado através da abertura. No final deste processo, a gordura corporal deve ser completamente separado do intestino e da cutícula. Desligue o intestino da parte anterior do corpo de gordura. Para fazer a coloração e montagem fácil, é importante que a gordura corporal permanecerá intacto.
- Wet uma pipeta pastagens cuidadosamente com média de Ringer, de preferência a partir de um poço que contém larvas dissecadas. Isso ajuda a cobrir a pipeta e impede que a gordura corporal a partir aderindo a ela. Use a pipeta de pastagem para transferir o corpo gordo em meio ao gelo Ringer frio no coador de celular.
4. Fixação e coloração
Todas as etapas são realizadas em temperatura ambiente, exceto para a incubação com o anticorpo em primeiro lugar, a 4 ° C.
- Incubar a gordura corporal em formol 5% em meio Ringer. por 20 minutos com agitação suave.
- Lavar por 5 minutos com PBT de 1% (1% Triton x-100 em PBS). Repita este passo para 10 minutos e uma terceira vez por 45 minutos. 1% Triton X-100 é necessária para perfurar o ovário larval e permitir que os anticorpos para penetrá-la.
- Bloco com PBTB 0,3% (0,3% Triton x-100 e BSA 1% em PBS) por 1 hora com agitação suave
- Incube com o anticorpo desejado 1 ª diluída em PBTB 0,3% durante a noite a 4 ° C com agitação suave. Esta etapa é normalmente realizada em 0,2 ml em tubos de um rolo.
- Transferência de gordura corporal de volta para filtros celular.
- Lavar 3 vezes, 30 minutos cada, com PBTB 0,3% com agitação suave.
- Bloco com PBTB 0,3% suplementada com 5% de soro normal de burro por 1 hora com agitação suave.
- Incube com um anticorpo secundário apropriado diluído (de acordo com a especificação do fabricante) na solução de bloqueio (0,3% PBTB suplementado com soro burro de 5% em PBT 0,3%) por 2 horas com agitação suave. Se o anticorpo é fluorescente, incubar no escuro a partir deste ponto em diante. Esta etapa é normalmente realizada em 0,2 ml em tubos de um rolo.
- Lavar 3 vezes durante 30 minutos cada, com PBT de 0,3% com agitação suave.
5. Montagem
- Transferir a gordura corporal para um tubo eppendorf limpo. Com muito cuidado remova todos os líquidos longe e cobrir imediatamente com a mídia Vectashield montagem. Nós usamos rotineiramente vectashield uma vez que não endurecer enquanto os ovários estão sendo separada do corpo de gordura.
Amostras podem ser armazenadas em meios de montagem a 4 ° C por até uma semana. - Corte a extremidade de uma ponta de pipeta e usá-lo para transferir cuidadosamente a gordura corporal, com volume mínimo de meios de montagem (cerca de 30 mL de uma tampa de deslizamento, 30 milímetros) em uma lâmina de microscópio.
- Use dois retentores de pinos de níquel chapeados, segurando 0,1 mm de diâmetro pinos para difundir a gordura corporal. Os ovários estão localizados no terço posterior do corpo de gordura. A gordura corporal que os rodeia é geralmente em forma de "flor". Isso ajuda a identificar a localização dos ovários. Dissecar as "flores" do resto da gordura corporal e descartar o último.
- Remover o surro de gordura corporalINANCIAMENTO da gônada cruzando os dois pinos com cuidado em torno dela. Coloque o gônadas isoladas no slide longe do resíduo de gordura corporal.
- Cubra com uma lamínula e vedação com unha polonês.
- Visualize diretamente usando um microscópio confocal. Amostras podem ser armazenadas a 4 ° C por até três semanas.
6. Resultados representante
Temos utilizado o protocolo acima de seguir o estabelecimento de linhagens celulares diversas dentro do ovário somáticas, incluindo GSCS e seus nichos de somática. Para isso, use anticorpos específicos e marcadores para distinguir entre os diferentes tipos de células na gônada em desenvolvimento. Aqui nós mostramos um exemplo de dois ovários LL3 corados com diferentes combinações de anticorpos. Figura 1A destaques filamento terminal e as células da tampa (verde), que juntos formam as células somáticas do nicho. Figura 1B, mostra as células Misturadas (ICs, magenta), que contactam directamente as células germinativas (azul).
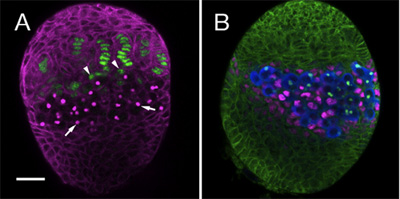
Figura 1. LL3 ovários. (A) anticorpo monoclonal 1B1 (magenta) define células somáticas e manchas do fusoma, uma organela intracelular dentro PGCs (setas). A armadilha enhancer hh-lacZ (anti β-galactosidase, verde) é expressa em filamentos terminais. Na base das células somáticas de filamentos de tampa (pontas de seta) podem ser observados. (B) anticorpo 1B1 (verde) descreve todas as células somáticas no ovário. Anti-Vasa (azul) todos os rótulos PGCs. PGCs contactar directamente as células Misturadas (ICs, anti-jam tráfego magenta). Bar (para A e B) é de 20 mM.
Discussão
Este vídeo demonstra um isolamento e protocolo de coloração da final do terceiro instar larval ovários. Para executar este protocolo rotineiramente e de forma confiável, a atenção deve ser dada aos seguintes pontos:
- Para as larvas sincronizados e bem desenvolvida, a superlotação deve ser evitada.
- Para evitar a perda dos ovários pequenos translúcido, certifique-se de dissecar a gordura corporal intacta. Isso também irá ajudar a localizar os ovários na fase de montagem, particularmente...
Divulgações
Agradecimentos
IM é apoiado pela Marie Curie conceder re-integração. Este trabalho foi financiado pelo Fundo de Ciência Israel não Grant. 1146-1108, pelo e Helen Kimmel Martin Institute for Stem Cell Research no Instituto Weizmann de Ciência ea Fundação Charitable Leir.
Materiais
| Name | Company | Catalog Number | Comments |
| NaCl | JT Baker | ||
| Kcl | Merck & Co., Inc. | ||
| CaCl2 | Sigma-Aldrich | ||
| MgCl2 | Merck & Co., Inc. | ||
| Sucrose | JT Baker | ||
| Hepes | Sigma-Aldrich | ||
| PBS | Sigma-Aldrich | ||
| Triton X-100 | Sigma-Aldrich | ||
| Albumin Bovine Fraction V | MP Biomedicals | 160069 | |
| Dumont biology tweezers 5 dumstar polished | Fine Science Tools | 11295-10 | |
| Nickel plated pin holder | Fine Science Tools | 26018-17 | |
| s.s minutien pins 0.1mm diam, 10mm long | Fine Science Tools | 26002-10 | |
| 9 well plates 85X100 mm, 22mm o.d.x7mm deep | Corning | 7220-85 | |
| Stereo Microscope MZ 16.5 with a standard transmitted light base TL ST | Leica Microsystems | ||
| 6 well plates | Costar | 3516 | |
| Slides | Menzel-Glaser | 798 | |
| Cover slips | Corning | 2940-223 | |
| Mounting media | Vectashield | H-1200 | |
| Cell strainer | Falcon BD | FAL352350 | |
| 1B1 antibody | Developmental Studies Hybridoma Bank | ||
| Anti-Traffic Jam | Laboratory of Dr. Dorothea Godt | ||
| Anti-Vasa | Laboratory of Dr. Ruth Lehmann | ||
| Anti β-Galactosidase | Cappel | ||
| Secondary Antibodies | Jackson ImmunoResearch |
Referências
- Fuller, M. T., Spradling, A. C. Male and female Drosophila germline stem cells: two versions of immortality. Science. 316, 402-404 (2007).
- Li, L., Xie, T. Stem cell niche: structure and function. Annual review of cell and developmental biology. 21, 605-631 (2005).
- Chen, D., McKearin, D. Gene circuitry controlling a stem cell niche. Curr Biol. 15, 179-184 (2005).
- Kai, T., Spradling, A. An empty Drosophila stem cell niche reactivates the proliferation of ectopic cells. Proceedings of the National Academy of Sciences of the United States of America. 100, 4633-4638 (2003).
- Kai, T., Spradling, A. Differentiating germ cells can revert into functional stem cells in Drosophila melanogaster ovaries. Nature. 428, 564-569 (2004).
- Lopez-Onieva, L., Fernandez-Minan, A., Gonzalez-Reyes, A. Jak/Stat signalling in niche support cells regulates dpp transcription to control germline stem cell maintenance in the Drosophila ovary. Development. 135, 533-540 (2008).
- Song, X., Zhu, C. H., Doan, C., Xie, T. Germline stem cells anchored by adherens junctions in the Drosophila ovary niches. Science. 296, 1855-1857 (2002).
- Tazuke, S. I. A germline-specific gap junction protein required for survival of differentiating early germ cells. Development. 129, 2529-2539 (2002).
- Xie, T., Spradling, A. C. decapentaplegic is essential for the maintenance and division of germline stem cells in the Drosophila ovary. Cell. 94, 251-260 (1998).
- Xie, T., Spradling, A. C. A niche maintaining germ line stem cells in the Drosophila ovary. Science. , 290-328 (2000).
- Guo, Z., Wang, Z. The glypican Dally is required in the niche for the maintenance of germline stem cells and short-range BMP signaling in the Drosophila ovary. Development. 136, 3627-3635 (2009).
- Wang, X., Harris, R. E., Bayston, L. J., Ashe, H. L. Type IV collagens regulate BMP signalling in Drosophila. Nature. 455, 72-77 (2008).
- Godt, D., Laski, F. A. Mechanisms of cell rearrangement and cell recruitment in Drosophila ovary morphogenesis and the requirement of bric a brac. Development. 121, 173-187 (1995).
- Sahut-Barnola, I., Godt, D., Laski, F. A., Couderc, J. L. Drosophila ovary morphogenesis: analysis of terminal filament formation and identification of a gene required for this process. Developmental biology. 170, 127-135 (1995).
- Song, X., Call, G. B., Kirilly, D., Xie, T. Notch signaling controls germline stem cell niche formation in the Drosophila ovary. 134, 1071-1080 (2007).
- Zhu, C. H., Xie, T. Clonal expansion of ovarian germline stem cells during niche formation in Drosophila. Development. 130, 2579-2588 (2003).
- Ward, E. J. Stem cells signal to the niche through the Notch pathway in the Drosophila ovary. Curr Biol. 16, 2352-2358 (2006).
- Gilboa, L., Lehmann, R. Repression of primordial germ cell differentiation parallels germ line stem cell maintenance. Curr Biol. 14, 981-986 (2004).
- Gilboa, L., Lehmann, R. Soma-germline interactions coordinate homeostasis and growth in the Drosophila gonad. Nature. 443, 97-100 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados