É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Estudando Trajetórias celular Rolamento no Patterns Receptor Asymmetric
Neste Artigo
Resumo
Nós descrevemos um protocolo de observar e analisar as trajetórias de células rolando no assimétrica receptor-padrão substratos. Os dados resultantes são úteis para a engenharia de receptor-padrão substratos para a etiqueta livre de separação de células e análise.
Resumo
Deslocamento lateral de células ortogonais a um fluxo fluxo rolando sobre os padrões assimétricos receptor apresenta uma oportunidade para o desenvolvimento de novos dispositivos para a etiqueta livre de separação e análise de células 1. Tais dispositivos podem utilizar deslocamento lateral para separação de fluxo contínuo, ou padrões de receptores que modulam a adesão ao distinguir entre fenótipos celulares diferentes ou níveis de expressão do receptor. Compreensão da natureza das trajetórias de células rolando no receptor-padrão substratos é necessária para a engenharia dos substratos e desenho de tais dispositivos.
Aqui, nós demonstramos um protocolo para o estudo de trajetórias de células rolando sobre os padrões de receptor assimétrica que suporte adesão celular rolando 2. Bem definida, M escala padrões de P-selectina receptores foram fabricados utilizando a impressão em microcontact revestidas de ouro slides que foram incorporados em uma câmara de fluxo. HL60 células que expressam o ligante PSGL-1 3 foram fluiu através de um campo de linhas de estampados e visualizadas em um microscópio de campo invertido brilhante. As células laminadas e monitorados ao longo das bordas inclinadas dos padrões, resultando em um deslocamento lateral. Cada célula tipicamente enrolada por uma certa distância ao longo das bordas padrão (definido como o comprimento de rastreamento borda), individual a partir da borda, e recolocado a um padrão de downstream. Embora essa separação torna difícil acompanhar toda a trajetória de uma célula de entrada até a saída da câmara de fluxo, de partículas de rastreamento de software foi utilizado para analisar e produzir as trajetórias de rolamento das células durante o tempo em que eles estavam se movendo em um único receptor com estampas de linha. As trajetórias foram então analisados para obter distribuições de velocidades de rolamento de células e os comprimentos borda de rastreamento para cada célula de padrões diferentes.
Este protocolo é útil para a quantificação de células trajetórias rolando sobre os padrões de receptor e relacionando estes parâmetros de engenharia para como padrão e ângulo de tensão de cisalhamento. Esses dados serão úteis para o design de dispositivos microfluídicos para a etiqueta livre de separação de células e análise.
Protocolo
1. HL60 célula rolando
1.1. Fabricação de Patterned Substratos.
- Utilizando a impressão microcontact (μCP) 4-7 para fazer alternando monocamadas auto-organizadas (SAMs) de moléculas de PEG nas lâminas de vidro revestidas de ouro: Fabricar microcontact impressão PDMS (polidimetilsiloxano) selos que definiu os padrões de receptor com ângulo de inclinação de α = 10 ° por um SU-8 processo de moldagem. Limpe a superfície de ouro com a solução de piranha (3:1 mistura de ácido sulfúrico a 30% de peróxido de hidrogênio) por 20 minutos e depois enxaguar a superfície com água abundante DI de 24,5 ° C antes do uso. Tinta do carimbo PDMS com solução de PEG 5mM em etanol. Seque o selo no ar por 20 minutos. Gentilmente colocou o selo na superfície de ouro por 40 segundos e verifique se há um bom contato entre a superfície do ouro e do carimbo. Sem excesso de pressão é necessária. Enxaguar a superfície com o etanol e seque-o sob um fluxo de N 2.
- Incubar o substrato dentro da P-selectina solução (15 mg / mL em DPBS), utilizando uma câmara de perfusão (Ciências Microscopia Eletrônica) durante 3 horas a 24,5 ° C para o padrão de áreas remanescentes com a P-selectina. Enxaguar a superfície com DPBS copiosa.
- Aterrar a superfície com BSA (1 mg / mL em DPBS) por 1 h para bloquear interacções não específicas. Enxaguar a superfície com DPBS copiosa.
1.2. Célula do Rolling Experimentos em uma Câmara de Fluxo.
- Fluxo de uma suspensão de células HL60 (~ 10 5 células / mL) sobre as superfícies estampados em uma câmara de fluxo retangular (Glycotech, Inc; largura w = 1,0 cm, comprimento = 6 cm, altura h = 0,0127 centímetros) de 24,5 ° C. Use uma bomba de seringa (Instrumentos de Precisão Mundial, SP230IW) para gerar fluxo de 75 mL / min, com tensão de cisalhamento correspondente cerca de 0,5 dyn / cm 2 (~ 0,05 Pa). Calcular tensão de cisalhamento τ usando a equação de fluxo de Poiseuille plano τ = 6μQ/wh 2, onde μ é a viscosidade cinemática (0,001002 Pa s), Q é a taxa de fluxo volumétrico, w é largura da câmara de fluxo, e h é a altura do câmara de fluxo.
- Use um microscópio invertido (Nikon TE2000-U) com uma câmera montada (Andor ixon 885) para gravar as células HL60 rolando interações com adesivo P-selectina substratos usando um 4 × objetivo, normalmente a uma taxa de 1 quadro por segundo para as durações de 300 s. Realizar três experimentos independentes, para cada magnitude tensão de cisalhamento e ângulo de inclinação padrão. Apresentar dados como média e desvio padrão dos valores médios obtidos para cada experimento.
- Análise de Dados.
Analisar as seqüências de imagens por um programa personalizado Matlab (Mathworks, Inc.) que utilizaram uma partícula de rastreamento 8 freeware para gerar faixas ao longo das bordas da linha padronizada. Faixas estendendo até o fim de uma banda de P-selectina são selecionados e equipado com dois segmentos de reta - um alinhado com o fluxo, a outra alinhada com a borda padrão. Estes dois segmentos são então usadas para calcular o comprimento de rastreamento borda, rolando velocidade na borda, e rolando de velocidade na região simples.
2. Resultados representativos:
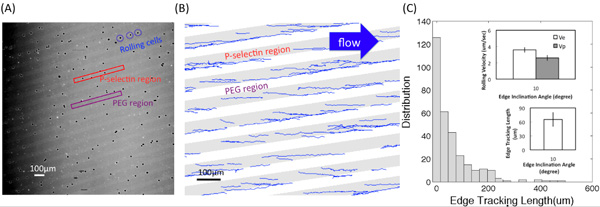
Figura (A) mostra uma das imagens de microscopia convertido a partir do vídeo de HL60 interações rolando com adesivo P-selectina substratos usando um objetivo × 4. Regiões claras e escuras correspondem a P-selectina receptor e regiões PEG, respectivamente. Figura (B) mostra as faixas obtidas utilizando um programa Matlab personalizada. O ângulo de inclinação borda foi de 10 ° ea tensão de cisalhamento foi de 0,5 dyn / cm 2. O comprimento de rastreamento de ponta, e l, o deslocamento, d, e as velocidades de rolamento na borda e no interior das bandas, e V e V p, respectivamente, estão descritas na Figura (C-1). Figura (C-2) mostra a distribuição (o número de células gravadas) de comprimento rastreamento borda. Inserções mostram o valor médio de l e e da velocidade de rolamento na ponta (V e) e no interior das bandas (V p) no ângulo de inclinação α = 10 ° ea magnitude de estresse fluido de corte em torno de 0,5 dyn / cm 2. Barras de erro representam um desvio padrão, onde n = 3 experimentos replicar (3 superfícies replicar) para cada condição.
Discussão
Nós descrevemos um protocolo para examinar células trajetórias rolando no assimétrica receptor-padrão superfícies fabricados utilizando a impressão microcontact 2. As imagens do microscópio óptico da superfície modelada mostrando claro contraste entre PEG e P-selectina áreas podem ser usados para confirmar se a impressão é bem sucedida. Sharp, bordas retas pode ser observado quando a estampagem é feita assim. Duro pressionando do selo pode resultar em deformação do selo que limita a prec...
Divulgações
Agradecimentos
Este projecto foi apoiado pelo Centro Deshpande para a Inovação Tecnológica no MIT (RK e JMK) ea concessão de CARREIRA NSF 0952493 para RK através do programa de Química e Biológica Separações. Agradecemos ao Instituto de Nanotecnologias Soldier (ISN) ea Microsystems Technology Laboratory (MTL) no MIT para utilização de suas instalações.
Materiais
| Name | Company | Catalog Number | Comments |
| Human promyelocytic leukemia cells | ATCC | CCL-240 | HL60 cells |
| Gold-coated glass slides | EMF | TA134 | Gold slides |
| (1-Mercaptoundec-11-yl)tetra(ethylene glycol) | Sigma-Aldrich | 674508 | PEG |
| Recombinant human P-selectin | R&D Systems | ADP3-050 | P-selectin |
| Bovine serum albumin | Rockland Immunochemicals | BSA-50 | BSA |
| Dulbecco’s phosphate buffered saline | Mediatech, Inc. | 21-030 | DPBS |
| Sulfuric acid | Sigma-Aldrich | 339741 | |
| Hydrogen peroxide | Sigma-Aldrich | 316989 |
Referências
- Karnik, R., Hong, S., Zhang, H., Mei, Y., Anderson, D. G., Karp, J. M., Langer, R. Nanomechanical control of cell rolling in two dimensions through surface Patterning of receptors. Nano Lett. 8 (4), 1153-1158 (2008).
- Lee, C. H., Bose, S., Van Vliet, K. J., Karp, J. M., Karnik, R. Examining Lateral Displacement of HL60 Cells Rolling on Asymmetric P-selectin Patterns. Langmuir. 27 (1), 240-249 (2011).
- Norman, K. E., Moore, K. L., McEver, R. P., Ley, K. Leukocyte rolling in-vivo is mediated by p-selectin glycoprotein ligand-1. Blood. 86 (12), 4417-4421 (1995).
- Bernard, A., Delamarche, E., Schmid, H., Michel, B., Bosshard, H. R., Biebuyck, H. Printing patterns of proteins. Langmuir. 14 (9), 2225-2229 (1998).
- James, C. D., Davis, R. C., Kam, L., Craighead, H. G., Isaacson, M., Turner, J. N., Shain, W. Patterned protein layers on solid substrates by thin stamp microcontact printing. Langmuir. 14 (4), 741-744 (1998).
- Mrksich, M., Whitesides, G. M. Using self-assembled monolayers to understand the interactions of man-made surfaces with proteins and cells. Annual Review of Biophysics and Biomolecular Structure. 25, 55-78 (1996).
- Tan, J. L., Tien, J., Chen, C. S. Microcontact printing of proteins on mixed self-assembled monolayers. Langmuir. 18 (2), 519-523 (2002).
- Lee, D., King, M. R. Microcontact Printing of P-Selectin Increases the Rate of Neutrophil Recruitment Under Shear Flow. Biotechnology Progress. 24 (5), 1052-1059 .
- Greenberg, A. W., Hammer, D. A. Cell separation mediated by differential rolling adhesion. Biotechnol. Bioeng. 73 (2), 111-124 (2001).
- Higuchi, A., Tsukamoto, Y. Cell separation of hepatocytes and fibroblasts through surface-modified polyurethane membranes. J. Biomed. Mater. Res. Part A. 71A (3), 470-479 (2004).
- Alexeev, A., Verberg, R., Balazs, A. C. Patterned surfaces segregate compliant microcapsules. Langmuir. 23 (3), 983-987 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados