Method Article
Visualização de MG53 mediada Repair Membrana Celular Usando In vivo E In vitro Sistemas
Resumo
Aqui descritos são protocolos utilizados para visualizar o processo dinâmico de MG53 mediada por reparação de membrana celular em animais inteiros e em nível celular. Estes métodos podem ser aplicados para investigar a biologia das células do plasma resealing membrana e medicina regenerativa.
Resumo
Reparação de lesão aguda para a membrana celular é um processo elementar de fisiologia celular normal, e com defeito de reparo de membrana tem sido associada a muitas doenças degenerativas humanas. A recente descoberta de MG53 como um componente chave da máquina resealing membrana permite um melhor entendimento molecular da biologia básica de reparação tecidual, bem como para potenciais aplicações translacional em medicina regenerativa. Aqui detalhamos os protocolos experimentais para explorar a função in vivo de MG53 no reparo de lesão muscular, utilizando protocolos de exercício em esteira em modelos de mouse, para testar a capacidade de reparação ex vivo de membrana, medindo entrada corante em fibras musculares isoladas, e para monitorar o processo dinâmico de MG53 mediada tráfico vesícula e reparação da membrana celular em células de cultura de células vivas usando microscopia confocal.
Protocolo
1. Corrida em esteira para revelar a extensão da lesão muscular em ratos
- Estabelecer o ângulo da superfície esteira para uso durante o protocolo de execução. Geralmente, uma plana ou um ângulo entre 7 ° e 15 ° graus para baixo ou para cima é usado. Algumas esteiras têm em aparelho essencial para ajustar a inclinação, enquanto outros exigem a esteira para ser elevado através de outros meios.
- Coloque uma bandeja ou uma almofada de laboratório azul debaixo da esteira antes de colocar os animais na esteira para coletar os resíduos dos animais durante o protocolo de execução.
- Antes de ratos em execução devem ser aclimatados ao ambiente da esteira. Este envolve a colocação dos animais na esteira por 15 minutos com a rede elétrica fora eo motor de acionamento por correia em mas o cinto não em movimento (ou seja, com a velocidade fixada em 0 m / s).
- Ligue a rede elétrica motivacional. A intensidade ea freqüência dos pulsos utilizados geralmente podem ser controlados em esteiras, mas varia de um fabricante para outro. Geralmente, a intensidade máxima não é necessária para motivar os ratos para correr enquanto uma alta freqüência (pelo menos uma vez a cada dois segundos) vai melhorar a adesão.
- Ativar o cinto de esteira para iniciar o protocolo de execução. Uma velocidade inicial de aproximadamente 5 metros / min deve ser usado para um período de aquecimento para os ratos. A velocidade da esteira pode ser acelerado lentamente, normalmente adicionando 1-2 metros / min para cada minuto após o início da esteira.
- Cumprimento dos animais na maioria dos protocolos pode ser melhorada através da realização de uma série de corridas curtas (5 minutos) a uma velocidade de aquecimento de 3 a 10 dias antes da execução experimental começa.
- Um exercício de exaustão aguda geralmente envolvem o aumento da velocidade da esteira com o tempo até uma velocidade máxima (geralmente <30 m / m) é alcançado e mantido até que os ratos mostram sinais de esgotamento. Critérios para julgar a exaustão variar, mas geralmente incluem um rato passar mais de metade do tempo na rede elétrica ou 5 segundos consecutivos na rede elétrica sem retornar para a superfície da esteira. Depois de um mouse individuais está esgotado, pode ser retirado da esteira eo tempo total de execução pode ser gravado.
- Mudando o ângulo da esteira pode ser usada em ensaios aguda a correr para aumentar a carga de exercício (com um ângulo para cima) ou para induzir danos contrações excêntricas (com um ângulo de descida) que rasgam as membranas sarcolemmal de fibras musculares 1. Evans corante azul pode ser injetado em animais antes de tais procedimentos para uso como corante histológico para identificar fibras musculares danificadas 2,3.
- Treinamento de resistência execução protocolos proporcionam uma carga de exercício para o animal durante um período de tempo prolongado (até meses) a fim de produzir o remodelamento do músculo ou o sistema cardiovascular. Warm up procedimento é o mesmo que acima (passo 1.5) no entanto a velocidade máxima é geralmente mais baixos e os tempos de execução pode ser muito longo (> 1 hora).
- Após a conclusão da execução dos camundongos podem ser devolvidos aos seus gaiolas. Esteiras geralmente tornam-se muito sujo, enquanto os ratos estão sendo executados, principalmente por meio de protocolos de comprimento. É necessário limpar a esteira, geralmente com um spray de etanol 70%, após cada uso.
2. Ex Assay Vivo da Capacidade de Membrana de reparo de fibras musculares isoladas após UV laser-Damage
- Dissecar a camada superficial do músculo flexor brevis (FDB) do pé mouse. Primeiro, corte a pele da sola aberta na linha mediana, enquanto tomando cuidado para não danificar o músculo por baixo, em seguida, faça cortes horizontais e remover a pele. O tendão do apartamento branco de FDB músculo (tendão proximal) pode ser visto ligado ao osso calcâneo. Sem rodeios separar o tendão por fórceps e separarão os próximos tendão ao local de fixação, agarre o tendão livre por fórceps e puxe-o suavemente para separar os FDB dos tecidos adjacentes ao cortar qualquer tecido conjuntivo que permanecem conectados. Ao ver o ramo tendões distais à dígitos individuais do FDB pode ser removido por corte onde estes tendões se conectar à camada mais profunda do músculo.
- Coloque o feixe muscular FDB em 1 ml de solução de colagenase pré-aquecido a 37 ° C em um tubo Eppendorf 1,5 ml, tape o tubo em uma orientação horizontal em um 37 ° C e agitar agitador orbital a 200 rpm por 65 min. Tempos de incubação pode ter de ser ajustada para assegurar uma digestão suficiente, o que é indicado por uma aparência desgastada e cor pálida do músculo.
- Transferir cuidadosamente o pacote FDB digerido em um tubo de centrífuga de 1,5 l contendo 600 mL ~ de 2,5 Tyrode + Ca 2 através de um uma ponta da pipeta ml com uma extremidade de corte que tem um diâmetro suficiente para permitir que o feixe digerida facilmente passar sem interrupções. Suavemente virar o tubo para agitar as fibras soltas do pacote.
- Cortar uma ponta de pipeta 30 mL de modo que o diameter é apenas ligeiramente menor do que o feixe muscular (entre 15-20 m de diâmetro) Use a pipeta suavemente para desenhar o pacote para a pipeta e depois empurrá-lo de volta para a solução.. Repita esse processo até que a maioria das fibras são dissociados do pacote.
- Mix de fibras disassociated bem suavemente girando o tubo, tomar quantidade desejada e solte um prato fundo de vidro T delta. O volume de carga vai variar de acordo com a eficiência do isolamento e do número de fibras úteis que são necessárias em um prato para um protocolo particular. As fibras remanescentes podem ser armazenados no tubo a 4 ° C por aproximadamente seis horas para estudos adicionais.
- Permitir que o prato se sentar sem ser perturbado por 5 minutos. Isto permite que as fibras de aderir ao fundo de vidro do prato.
- Coloque o prato de vidro em um fundo de microscopia confocal equipado com um laser UV. Observe as fibras em microscopia de fase em> aumento de 100X para verificar a presença de um padrão de estriação normal e uma haste, em linha reta como a forma.
- Adicionar FM1-43 ou corantes FM4-64 styrylpyridinium 4 a solução para uma concentração final de 2,5 mM 5.
- Para induzir a danos para a posição de fibra-lo na janela de imagem para que a fibra é orientada em um ângulo de 45 ° a partir do canto superior esquerdo do campo de visão para o canto inferior direito (Figura 1). Irradiar uma área de 5x5 pixel (aproximadamente 0.9μmx0.9μm) da membrana plasmática usando um laser UV (80 mW ou mais, 351/364 nm) para definir potência máxima por 5 segundos. A região irradiada deve dividir a membrana plasmática, ou seja, metade da caixa de 5x5 deve ser no interior da fibra, enquanto o restante deve ser fora da fibra (Figura 1).
- Capturar imagens de entrada corante na fibra em intervalos de 5 segundos cada por até 5 minutos.
- Repita o passo 2.8 para não mais de 3 fibras por prato, como o corante fluorescente será eventualmente endocytosed na fibra e complicar qualquer análise de dados. Depois de 3 fibras um novo prato deve ser preparado a partir do passo 2.5.
- Analisar os dados, calculando a mudança na intensidade de fluorescência (ΔF / F 0) entre cada quadro capturado para medir a quantidade de entrada corante. Isto requer a medição da fluorescência média de uma área de aproximadamente 200 mM 2, utilizando o software de análise, como o ImageJ publicamente disponíveis (http://rsbweb.nih.gov/ij/). Para a comparação entre as fibras, o seguinte cálculo deve ser feito para cada quadro: ΔF / F 0, onde F 0 é a fluorescência média da região de interesse no primeiro quadro capturado (t = 0; antes da lesão), e ΔF é a mudança de fluorescência de cada quadro subseqüente (FF 0).
3. Ao vivo imagens de células Confocal para monitorar o processo dinâmico de Reparação Membrana Celular
- Micropipetas foram feitas a partir PYREX capilares. O capilar foi colocado em um extrator micropipeta e puxado por pré-definidos do programa (calor = 695; Pull = 50; Vel .= 55; Time = 250).
- Micropipeta foi anexado a um micromanipulador de 3 eixos (xyz).
- Células são transfectadas com DNA plasmidial usando métodos normais em um prato fundo de vidro delta T. Meios de comunicação devem ser transferidos para 2,5 Ca 2 + tampão Tyrode antes dos experimentos começar.
- Pratos de vidro contendo células transfectadas foram colocados em um microscópio confocal de varredura a laser com o objectivo de imersão 1.3NA óleo de 40X.
- O dano live-celular aguda foi realizada através da inserção da micropipeta na membrana celular e então rapidamente retirar a micropipeta para fora da célula 3,6. Consecutivos imagens de células vivas foram obtidas em um intervalo de 1,54 s / frame.
- Para o ensaio interrupção induzida membrana saponina, saponina 0,005% (Sigma) em 2,5 mm Ca 2 + tampão Tyrode foi perfundidos por um sistema de perfusão de fluxo por gravidade custom-montados 7. A taxa de perfusão é de aproximadamente 1 ml / min ea ponta de perfusão deve ser colocado diretamente acima da célula que está sendo fotografada.
4. Resultados representativos:
Um filme representante da esteira rolante do mouse pode ser feita durante as filmagens. O filme vai ilustrar a capacidade reduzida de funcionamento do mg53 / - ratos, devido aos danos ao músculo esquelético.
A extensão dos danos causados pelo protocolo de danos UV laser detalhado acima depende da capacidade de reparação da membrana da fibra analisada. Esta capacidade é afetada pelo genótipo do mouse a partir do qual a fibra foi isolado, condições extracelular, e quaisquer alterações a expressão da proteína (transfecção ou infecção). A fibra tipo normal selvagens permitirá leve a moderada entrada corante (Figura 2a). Fibra muscular derivado do mg53 / - ratos com capacidade comprometida membrana reparação irá exibir a entrada mais significativa de corante na fibra (Figura 2b).
Os resultados típicos de translocação de microeletrodos mostram lesão de MG53 contendo vesiculos para o local da lesão. Figura 3a e 3b mostram GFP-MG53 C2C12 transfectadas miotubos danificado pela inserção da micropipeta na membrana celular. Na célula antes que os danos micropipeta, GFP-MG53 é localizado em ambos os membrana plasmática e citoplasma 3. Após a penetração micropipeta, GFP-MG53 vesículas contendo mudou para sites de dano (como indicado pela seta). Figura 3c mostra um GFP-MG53 C2C12 transfectadas mioblastos tratados com 0,005% de saponina, um detergente que podem permeabilizar a membrana plasmática. Após tratamento saponina, GFP-MG53 translocado do citosol para a membrana celular.
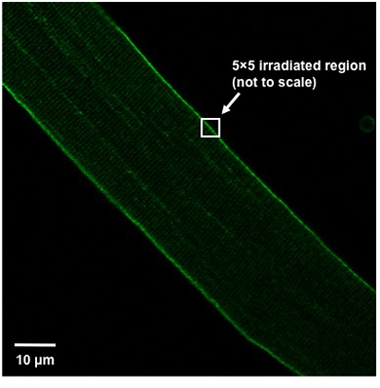
Weisleder, et al. Figura 1. Alinhamento das fibras e definição região lesão. Orientação adequada da fibra muscular isolada dentro do campo de visão e definição da região ferimentos mostrados.
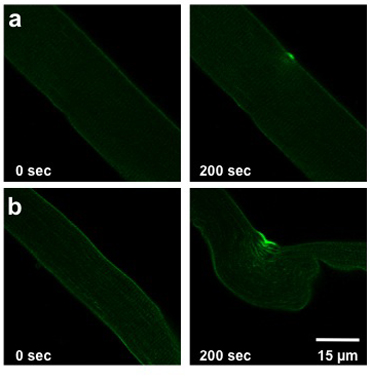
Weisleder, et al. Figura 2. Danos a laser UV de fibras FDB. Imagens mostram fibras antes da lesão (0 sec, à esquerda) e em 200 lesões pós sec (direita). Fibras de um camundongo de tipo selvagem (a) mostram ferimentos leves. Fibras de ratos com a reparação da membrana comprometida (b) permitir que mais tinta para entrar.
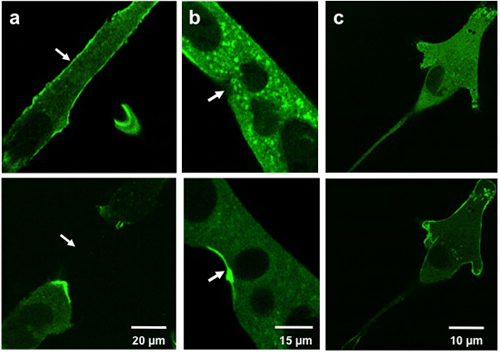
Weisleder, et al. Figura 3. Microeletrodos e saponina danos às células em cultura. Imagens mostram miotubos C2C12 (a, b) e um mioblastos C2C12 (c) antes da lesão (acima) e lesão pós (em baixo). Células ferido com um microeletrodo (a, b) mostram MG53 translocação para sites lesão (setas). Células tratadas com saponina (c) mostram MG53 translocação para a membrana celular.
Discussão
Esteira rolante é uma metodologia útil no fornecimento de uma carga de exercícios para os animais tratados. Como uma metodologia para medir a função muscular ou da capacidade de resistência é uma abordagem notoriamente barulhentos que é difícil de executar de uma forma consistentemente reprodutíveis 8. Em geral, os tempos até a exaustão pode ser usado como um ponto final para resolver diferenças importantes entre os grupos experimentais, tais como aquelas entre algumas linhas e camundongos knockout rato do tipo selvagem 9. Manipulações experimentais que produzem diferença mais sutil, como alguns ensaios farmacêuticos, não pode resolver as diferenças acima do ruído associado a essa técnica. A fim de maximizar a reprodutibilidade ea sensibilidade destas técnicas é importante para manter as condições para uma sessão para outra de muito perto. A hora do dia os animais são exercidas, bem como as condições de aquecimento período utilizado, são fatores importantes e devem permanecer consistentes de julgamento para julgamento.
Efeitos estirpe pode ter impacto significativo sobre o projeto de protocolos de esteira como certas cepas de camundongos pode funcionar por muito mais tempo na esteira do que outras linhagens e respondem diferentemente ao exercício de resistência 10. Como orientação geral, muitos ratos será capaz de executar 200-300 metros no total, em um estudo de exaustão com constante aumento na velocidade da esteira (5 velocidade m / m inicial com 1 m / m adicionado por cada minuto após o início). Para um exercício de resistência dos ratos pode ser executado entre 9 a 12 m / m por 30 minutos 2 ou 3 vezes por semana. No entanto, estudos individuais geralmente requerem alguma otimização do protocolo para corresponder às necessidades individuais experimental.
O procedimento de danos UV laser tem demonstrado ser um método eficaz para medir a capacidade de reparação da membrana das fibras musculares esqueléticas 3,6,11. Um componente vital para o sucesso desses experimentos é a utilização de fibras musculares que exibem apenas uma linha reta, a aparência da haste em forma com um padrão regular de estrias e um sarcolema lisa que não aparece enrugada. Se outras fibras musculares são selecionados dano à membrana pode já estar presente nestas fibras e interpretação dos resultados desses experimentos pode ser complicado. Também é importante que a orientação da fibra e definição da região irradiada os definidos na Figura 1. Isto proporciona uma lesão de tamanho reprodutível, permitindo a comparação entre as fibras. Se a região definida de lesão está completamente dentro da fibra, uma lesão interna será criado ao invés de interromper o sarcolema. Além disso, o valor calculado para ΔF / F 0 é muito sensível para a região de interesse selecionada para a medição de fluorescência média. Uma área de aproximadamente 200μm 2, adjacentes, e incluindo o local da lesão, é adequado. Ao contrário da região definida por lesão, esta área deve estar completamente dentro da fibra. Se você incluir espaço fora da fibra, resultando em branco a área vai aumentar ΔF / F 0 em fibras com entrada pouco de corante, reduzindo ΔF / F 0 em fibras com um fenótipo mais grave. Isso diminui a sensibilidade do ensaio, fazendo comparação entre as fibras mais difícil.
Para o ensaio danos micropipeta, o ângulo entre o micropipeta e prato fundo de vidro deve ser de aproximadamente 45 graus, a fim de efetivamente dano à membrana celular. As células foram escolhidos por danos micropipeta devem ser bem colocado no fundo do prato e células arredondadas não deve ser usado desde muito provavelmente eles vão separar após micropipeta cutucando. Experimentos permeabilzation saponina são menos exigentes tecnicamente e relativamente rápido para executar comparação com micropipeta ensaios de penetração. No entanto, há várias limitações a danos saponina, incluindo a apenas uma célula pode ser usado por prato desde saponina será difusa e danos outras células que prato.
Divulgações
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
|---|---|---|---|
| Esteira de roedores | Columbus Instruments Exer 06/03 ou equivalente | ||
| Etanol 70% | ISC Bioexpress | ||
| Instrumentos de dissecação, incluindo fórceps de ponta fina, tesoura primavera | Precision Instruments mundo | ||
| Colagenase tipo 2 mg / ml I | Sigma | ||
| 0 Ca 2 + tampão Tyrode (140 mM NaCl, 5 mM KCl, 10 mM HEPES, 2 mM MgCl 2, pH 7,2, 290 mOsm) | Sigma | ||
| 2.5mm Ca 2 + tampão Tyrode (140 mM NaCl, 2,5 mM CaCl 2, 5 mM KCl, 10 mM HEPES, 2 mM MgCl 2, pH 7,2, 290 mOsm) | Sigma | ||
| Temperatura controlável agitador orbital | New Brunswick ou equivalente | ||
| Delta Dish TPG | Fisher Scientific | 1207133 | |
| LSM microscópio confocal 510 com uma empresa de laser UV 80 mW ou microscópio confocal equivalente | Zeiss | ||
| FM1-43-64 ou FM4 corantes | Invitrogen | ||
| Borosilicato Tamanho Capilares 0,8-1,0 X 100 mm | PYREX | Peça n º 9530-2 | |
| Micropipeta extrator | Sutter Instruments | modelo P-97 | |
| 3 micromanipulador eixo | Narishige | MHW-3 | |
| Radiance 2100 microscópio de varredura a laser confocal ou microscópio equivalente | BioRad | MHW-3 | |
| Saponina | Sigma | 47036 |
Referências
- Armstrong, R. B., Ogilvie, R. W., Schwane, J. A. Eccentric exercise-induced injury to rat skeletal muscle. J Appl Physiol. 54, 80-93 (1983).
- Hamer, P. W., McGeachie, J. M., Davies, M. J., Grounds, M. D. Evans Blue Dye as an in vivo marker of myofibre damage: optimising parameters for detecting initial myofibre membrane permeability. J Anat. 200, 69-79 (2002).
- Cai, C. MG53 nucleates assembly of cell membrane repair machinery. Nat Cell Biol. 11, 56-64 (2009).
- Cochilla, A. J., Angleson, J. K., Betz, W. J. Monitoring secretory membrane with FM1-43 fluorescence. Annu Rev Neurosci. 22, 1-10 (1999).
- McNeil, P. L., Miyake, K., Vogel, S. S. The endomembrane requirement for cell surface repair. Proc Natl Acad Sci U S A. 100, 4592-4597 (2003).
- Cai, C. Membrane repair defects in muscular dystrophy are linked to altered interaction between MG53, caveolin-3, and dysferlin. J Biol Chem. 284, 15894-15902 (2009).
- Wang, X. Cardioprotection of ischemia/reperfusion injury by cholesterol-dependent MG53-mediated membrane repair. Circ Res. 107, 76-83 (2010).
- Knab, A. M. Repeatability of exercise behaviors in mice. Physiol Behav. 98, 433-440 (2009).
- Zhao, X. Enhanced resistance to fatigue and altered calcium handling properties of sarcalumenin knockout mice. Physiol Genomics. 23, 72-78 (2005).
- Massett, M. P., Berk, B. C. Strain-dependent differences in responses to exercise training in inbred and hybrid mice. Am J Physiol Regul Integr Comp Physiol. 288, 1006-1013 (2005).
- Bansal, D. Defective membrane repair in dysferlin-deficient muscular dystrophy. Nature. 423, 168-172 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados