É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Trichuris Muris Infecção: Um Modelo de imunidade do tipo 2 e inflamação no intestino
Neste Artigo
Resumo
Trichuris Muris infecção intestinal é um modelo de imunidade Th2 onde os ratos resistentes ao gerar uma resposta protetora Th2 e camundongos suscetíveis de gerar uma resposta Th1 patológico.
Resumo
Trichuris Muris é um patógeno natural de ratos e é biologicamente e antigenicamente semelhante a espécies de Trichuris que infectam seres humanos e animais 1. Ovos infectantes são dadas por gavagem oral, escotilha no intestino delgado distal, invadem as células epiteliais intestinais (CIEM) que revestem as criptas do ceco e cólon proximal e sobre a maturação dos vermes liberam os ovos no ambiente 1. Este modelo é uma ferramenta poderosa para analisar os fatores que a ativação de células CD4 controle + T helper (Th), bem como alterações no epitélio intestinal. A resposta imune que ocorre em cepas resistentes puras, tais como C57BL / 6 e BALB / c, é caracterizada por citocinas Th2 polarizada (IL-4, IL-5 e IL-13) e expulsão de vermes enquanto Th1 associado citocinas (IL -12, IL-18, IFN-γ) promover infecções crônicas em AKR geneticamente suscetíveis / mice J 2-6. Citocinas Th2 promover mudanças fisiológicas no microambiente intestinal incluindo rotatividade de IECs, a diferenciação de células caliciformes, recrutamento e alterações na permeabilidade epitelial e contração do músculo liso, as quais têm sido implicados na expulsão verme 15/07. Aqui detalhamos um protocolo para a propagação de ovos de Trichuris Muris que pode ser usado em experimentos posteriores. Nós também fornecemos uma colheita de amostra experimental com sugestões para análise pós-infecção. Globalmente, este protocolo irá fornecer aos pesquisadores as ferramentas básicas para realizar uma Trichuris Muris modelo de infecção do mouse que podem ser utilizados para tratar questões relativas à propensão Th no trato gastrointestinal, bem como as funções efectoras imunes de IECs.
Protocolo
1. Propagação ovos de Trichuris Muris
- Para gerar novos lotes de ovos de Trichuris Muris, 20-30 infectar camundongos imunodeficientes (ex. NOD.Cg-Prkdc scid Il2rg tm1Wjl / SzJ (NSG) ou 129S6/SvEvTac-Rag2 tm1Fwa (RAG2 - / -)) ou camundongos geneticamente suscetíveis ( por exemplo. AKR / J), que são de 6-8 semanas de idade com cerca de 300 ovos de Trichuris Muris por gavagem oral.
- Depois de 32-35 dias sacrifício dos camundongos por asfixia CO 2.
- Expor o lado ventral do mouse e molhar o abdômen com álcool 70%.
- Forceps usando agarrar a pele abdominal e fazer uma pequena incisão com uma tesoura. Cortar a pele para expor o conteúdo abdominal.
- Identificar o ceco eo intestino proximal grande, e removê-los.
- Coloque o ceco e intestino grosso proximal em um prato de 10 centímetros de petri contendo Modified Dulbecco Eagle Medium (DMEM) com 500 U / ml de penicilina e estreptomicina 500 mg / ml (P / S). Corte o ceco aberta para expor a luz e os vermes. Utilizando uma pinça ceco lugar num copo de tampão fosfato (PBS) e agitar suavemente para remover as fezes.
- Retorno ceco para placa de Petri e usando uma pinça curva suave (Roboz RS-5047) puxe para fora worms e colocá-los em um poço de uma placa de 6 bem contendo 5 ml de DMEM + P / S.
- Repita esse processo para todos os ratos.
- Coloque seis placa bem em um recipiente Tupperware com uma toalha de papel úmida para manter a humidade e incubar a 37 ° C por 4 horas.
- Após 4 horas remover worms usando uma pinça curva suave e os dividiram em dois novos poços da placa contendo 6 bem DMEM 5mL + P / S. Colheita o conteúdo do poço original e colocar em um tubo falcon 15 ml. Tubo giratório a 3000 rpm e remover e sobrenadante reserva como antígeno 4 h (pode ser usado para reestimulação celular após PBS diálise, onde os rendimentos de proteínas típicos são 10-20 mg por 20 ratos) e ressuspender ovos contendo sedimento em água de torneira autoclavada.
- Coloque a placa de 6 bem para trás a 37 ° C durante a noite. Remova e descarte a worms. Colher o conteúdo das cavidades em um tubo falcon e girar a 3000 rpm por 5 min. Remover o sobrenadante e reserva como antígeno durante a noite (pode ser usado para Trichuris Ag ELISAs isotipo específico de anticorpos após a PBS diálise, onde os rendimentos de proteínas típicos são 10-20 mg por 20 ratos) e ovos contendo ressuspender sedimento em água de torneira autoclavada.
- Combine 4 horas e ovos noite e filtrar os ovos pela peneira 70μm para remover quaisquer restos de vermes em seguida, transferir para um balão de 75 cm 2. Manter frasco num lugar escuro coberto por papel alumínio por 6 semanas à temperatura ambiente (RT).
- Lave os ovos em água de torneira autoclavada e ressuspender em 50 ovos viáveis em 50 ul. Para fazer isso, os ovos centrífuga a 3000 rpm por 5 min e ressuspender em ~ 50ml água de torneira esterilizada. Remover 50 ovos mL e colocar em uma lâmina de vidro. Usando a ampliação de 40x contar o número de ovos embrionados viável na mL 50. Diluir os ovos para dar 50 ovos viáveis em 50 ul. Para imagens de ovos viáveis consulte o estudo de Kopper e Mansfield 16.
2. Infecção aguda experimental de camundongos com Trichuris Muris ovos (200 ovos / mouse)
- Ovos cuidadosamente ressuspender e remover volume suficiente para tratar o número de ratos X 2 (por exemplo, por 10 ratos tomar 200 mL x 10 ratos x 2 = 4 mls de ovos) e colocá-los em um tubo de 14 ml tampa snap.
- Inverter o tubo de 14 ml tampa encaixe para misturar. Trazer até 200 mL de ovos em uma seringa ml em uma agulha de tamanho apropriado de alimentação (para os ratos com peso de 25 gramas que usamos calibre 18 1 1 / 2 "agulhas). Em um scruff a mão do mouse e usando o outro lado administrar ovos por sonda oral .
- Esperar 21 dias.
3. Pesca experimental
- No dia 21 sacrifício os ratos usando CO 2.
- Coleta de sangue de ratos por punção cardíaca, em seringa não heparinizado, e armazenar a 4 ° C. No dia seguinte isolar soro e congelar a -20 ° C. Soro pode ser usado para a detecção de Trichuris específicos IgGs e IgE por ELISA.
- Expor o lado ventral do mouse e molhar o abdômen com álcool 70%.
- Forceps usando agarrar a pele abdominal e fazer uma pequena incisão com uma tesoura. Cortar a pele e membrana subjacente para expor o conteúdo abdominal.
- Identificar o intestino delgado ceco e cólon. Agarre o ceco com uma pinça e retire da cavidade abdominal. Com outro par de fórceps empurrar intestino delgado para a direita expondo os linfonodos mesentéricos (MLNs). Remover o MLNs tomando cuidado para não cortar os intestinos e coloque em uma falcon 15 ml contendo 2 ml de mídia. Se desejado estes podem ser processados e restimulated in vitro (4x10 6 / ml em 1 ml em 24 placas bem com um αCD3/CD28 mcg / ml ou com 50μg/ml 4h Trichuris Ag) por 72 horas para análise de citocinas por ELISA e f intracelularcitometria de baixo.
- Cortar o ceco e cólon.
- Utilizando uma pinça, empurrar para fora pelotas fecais do cólon distal e coloque em um tubo de 2 ml Axygen. Congelar a -20 ° C. Fezes podem ser analisadas por western blot para expressão de resistina-like molécula de β-(RELM β).
- Retire a ponta do ceco (~ 0,5 cm). Para remover fezes segurar a ponta ceco com uma pinça e lavar com PBS usando uma seringa de 3 ml e agulha calibre 22 em uma placa de Petri. Lugar em paraformaldeído a 4% fresco em um Falcon de 5 ml tubo tampa snap. Armazenar a 4 ° C. Estes podem ser incluídos em parafina, seccionado e montado em lâminas para análise histológica.
- Retire um pedaço de cólon proximal (~ 1 cm) de RNA. Coloque amostra em dois tubos com 500 ml Axygen RNAlater mL. Armazenar a 4 ° C. Essas amostras podem ser analisados para a expressão de mRNA por qPCR.
- Coloque o restante do ceco em uma placa de Petri etiquetadas e congeladas a -20 ° C.
4. Enumeração de Trichuris Muris worms no ceco
- Retire do freezer ceco e coloque em um prato de petri contendo ~ ml de água 5.
- Com uma tesoura, corte aberto ceco para expor o lúmen.
- Segure o ceco com uma pinça e agite vigorosamente o ceco para remover a maioria das fezes.
- Ceco transferência para outra placa de petri contendo água e usando uma pinça curva suave delicadamente raspar o IECs o tecido subjacente.
- Ceco transferência para uma nova placa de petri contendo água e raspar vigorosamente tecido remanescente com uma pinça, rasgando o tecido em pedaços pequenos.
- Use um microscópio de dissecação para contar todas os vermes em todas as 3 da placas de Petri. Como você encontrar um verme removê-la do prato para garantir o worm mesmo não é contado duas vezes. Se worms estão danificados (isto é quebrado pela metade) contagem só termina grossas ou finas para obter uma contagem precisa.
5. Resultados representante
O modelo de infecção Trichuris Muris permite aos pesquisadores quantificar carga parasitária e resposta imune sistêmica, bem como para analisar histologicamente a resposta inflamatória dentro do ceco distal. Quando o lúmen do ceco colhida é exposto, worms Trichuris podem ser enumerados usando um microscópio de dissecação (Figura 1A-B). Parâmetros de imunidade para Trichuris também incluem isotipo de anticorpos mudar para IgG1 (associado com a imunidade do tipo Th2) em animais resistentes e IgG2a (associado com tipo de imunidade Th1) em animais suscetíveis (Figura 1C). Expressão da taça de células específicas de proteínas resistina-like molécula de β-(RELM β-) está associada com a depuração de Trichuris e é detectável por análise de Western blot (Figura 2). A porção distal do ceco pode ser manchada com Periodic Acid-Schiff (PAS) para avaliar as respostas de células caliciformes e da extensão da inflamação intestinal em resposta à infecção (Figura 3).
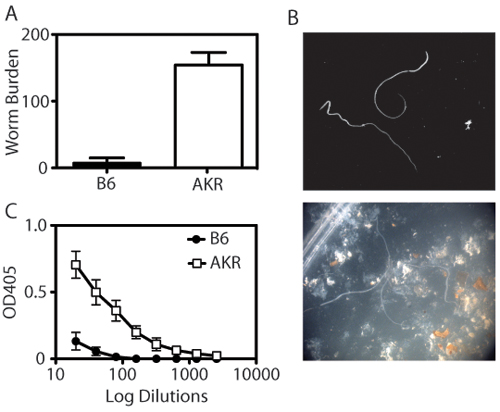
Figura 1. Quantificação de imunidade para Trichuris Muris. (A) Resistente (B6) ratos expulsar Muris Trichuris ao dia 21 pós-infecção. Pelo contrário, suscetíveis (AKR / J) camundongos cronicamente infectados com Trichuris, resultando no estabelecimento do parasita. Cada barra representa a média ± SEM de 4-8 animais por grupo. (B) Worms são contados através de um microscópio de dissecação. Painel superior mostra worms em isolamento, o painel inferior mostra worms na presença de IECs e fezes. (C) títulos Trichuris IgG2a específicos são determinados por ELISA de soro diluído (1:2 diluição, a partir de diluição de 1:20 e terminando às 1:2560) em placas revestidas com antígeno de excreção e Trichuris (O / N Ag, 5 mg / ml). Suscetíveis AKR / J ratos têm níveis mais elevados de Trichuris nomeadamente específicos IgG2a soro do que resistente B6 camundongos.

Figura 2. Apuramento de Trichuris Muris está associada a expressão da taça de células específicas de proteínas RELM-β 7. RELM-β de produção podem ser detectados a partir de pelotas fecais de Trichuris infectadas resistentes (B6), mas não suscetíveis (AKR / J) ratos por análise de western blot. Cada pista é representante de um único animal, (N) = Naive, (Tm) = 21 dias Trichuris camundongos infectados.
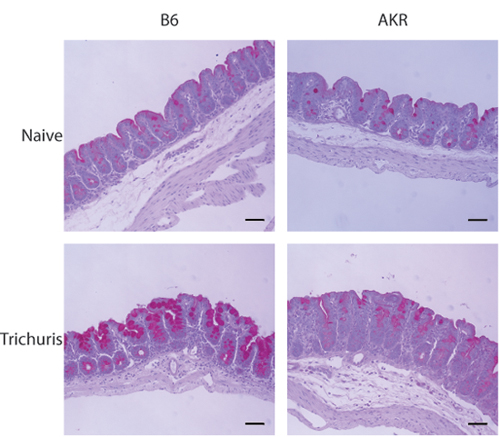
Figura 3. Exame histológico da infecção distal Trichuris ceco seguinte. Seções 5-7 mM do ceco distal corados com PAS. Hiperplasia de células caliciformes e produção de muco são evidentes em resistente (B6), mas não suscetíveis (AKR / J) ratos após a infecção Trichuris.
Discussão
Este protocolo detalhes um alto padrão dose aguda Trichuris Muris infecção que pode ser modificado conforme exigido pelo investigador. Por exemplo, ratos podem ser sacrificados e os tecidos colhidas em dias diferentes. Para determinar que os ratos com sucesso estabelecida carga parasitária total que pode ser sacrificada no dia 14, altura em que todos os camundongos deve levar uma carga de aproximadamente 200 worms. Ratos também podem ser infectados por 32 dias, onde qualquer worm detectado terá atingido m...
Divulgações
Agradecimentos
Este trabalho foi financiado pelos Institutos Canadenses de Pesquisa em Saúde (MSH-95368, 89773 e MOP-MOP-106623 para CZ) e da Fundação Canadense para a Inovação. SCM é o destinatário de uma Associação CIHR / canadense de Gastroenterologia pós-doutorado. CZ é um investigador CIHR Novo.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
|---|---|---|---|
| Animais Agulhas Alimentação (18 x 1 ½ ") | Popper | 7912 | |
| Pinça curva suave | Roboz | RS-5047 | |
| DMEM | Gibco | 11965 | |
| NOD.Cg-Prkdc scid Il2r gtm1Wjl / SzJ (NSG) | Jackson Laboratories | 005557 | Estes são os ratos que usamos, no entanto, qualquer camundongos imunodeficientes ou linhagem suscetível deve funcionar. |
| RNAlater | Qiagen | 76104 | |
| 2 tubos de ml | Axygen | MCT-200-C | |
| Tubos de 15 ml | Falcão | 352096 | |
| 6 placas bem | Falcão | 353046 | |
| Paraformaldeído | Electron Microscopy Ciência | 15710 | |
| α-RELMβ anticorpos | PeproTech Inc | 0694270Rb |
Referências
- Cliffe, L. J., Grencis, R. K. The Trichuris muris system: a paradigm of resistance and susceptibility to intestinal nematode infection. Adv. Parasitol. 57, 255-307 (2004).
- Else, K. J., Finkelman, F. D., Maliszewski, C. R., Grencis, R. K. Cytokine-mediated regulation of chronic intestinal helminth infection. J. Exp. Med. 179, 347-351 (1994).
- Bancroft, A. J., Grencis, R. K. Th1 and Th2 cells and immunity to intestinal helminths. Chem. Immunol. 71, 192-208 (1998).
- Bancroft, A. J., McKenzie, A. N., Grencis, R. K. A critical role for IL-13 in resistance to intestinal nematode infection. J. Immunol. 160, 3453-3461 (1998).
- Helmby, H., Takeda, K., Akira, S., Grencis, R. K. Interleukin (IL)-18 promotes the development of chronic gastrointestinal helminth infection by downregulating IL-13. J. Exp. Med. 194, 355-364 (2001).
- Owyang, A. M. Interleukin 25 regulates type 2 cytokine-dependent immunity and limits chronic inflammation in the gastrointestinal tract. J. Exp. Med. 203, 843-849 (2006).
- Artis, D. RELMβ/FIZZ2 is a goblet cell-specific immune-effector molecule in the gastrointestinal tract. Proc. Natl. Acad. Sci. U. S. A. 101, 13596-13600 (2004).
- Datta, R. Identification of novel genes in intestinal tissue that are regulated after infection with an intestinal nematode parasite. Infect. Immun. 73, 4025-4033 (2005).
- Cliffe, L. J. Accelerated intestinal epithelial cell turnover: a new mechanism of parasite expulsion. Science. 308, 1463-1465 (2005).
- Artis, D. New weapons in the war on worms: identification of putative mechanisms of immune-mediated expulsion of gastrointestinal nematodes. Int. J. Parasitol. 36, 723-733 (2006).
- Finkelman, F. D. Cytokine regulation of host defense against parasitic gastrointestinal nematodes: lessons from studies with rodent models. Annu. Rev. Immunol. 15, 505-533 (1997).
- Grencis, R. K. Enteric helminth infection: immunopathology and resistance during intestinal nematode infection. Chem. Immunol. 66, 41-61 (1997).
- Khan, W. I. Modulation of intestinal muscle contraction by interleukin-9 (IL-9) or IL-9 neutralization: correlation with worm expulsion in murine nematode infections. Infect. Immun. 71, 2430-2438 (2003).
- Khan, W. I., Blennerhasset, P., Ma, C., Matthaei, K. I., Collins, S. M. Stat6 dependent goblet cell hyperplasia during intestinal nematode infection. Parasite Immunol. 23, 39-42 (2001).
- Akiho, H., Blennerhassett, P., Deng, Y., Collins, S. M. Role of IL-4, IL-13, and STAT6 in inflammation-induced hypercontractility of murine smooth muscle cells. Am. J. Physiol. Gastrointest. Liver Physiol. 282, 226-2232 (2002).
- Kopper, J. J., Mansfield, L. S. Development of improved methods for delivery of Trichuris muris to the laboratory mouse. Parasitol. Res. 107, 1103-1113 (2010).
- Bancroft, A. J., Else, K. J., Grencis, R. K. Low-level infection with Trichuris muris significantly affects the polarization of the CD4 response. Eur. J. Immunol. 24, 3113-3118 (1994).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados