Method Article
Geração e Rotulagem de murino derivadas da medula óssea Células Dendríticas com Nanocristais Qdot de Estudos de rastreamento
Neste Artigo
Resumo
Dendríticas células antígenos captação e migrar para órgãos imunes a antígenos presentes processados às células T. Qdot nanocristais rotulagem fornece um sinal duradouro e estável fluorescente. Este permite o rastreamento de células dendríticas a diferentes órgãos, por microscopia fluorescente.
Resumo
As células dendríticas (DCs) são células antígeno apresentando profissionais (APCs) encontrados em tecidos periféricos e em órgãos imunológicos, como timo, medula óssea, baço, linfonodos e placas de Peyer 1-3. DCs presentes na amostra de tecidos periféricos do organismo para a presença de antígenos, que eles ocupam, processar e apresentar em sua superfície, no contexto de moléculas de histocompatibilidade (MHC). Então, o antígeno-carregado DCs migrar para órgãos imunológicos onde apresentam o antígeno processado aos linfócitos T desencadear respostas imunes específicas. Uma forma de avaliar a capacidade migratória de DCs é classificá-los com corantes fluorescentes 4.
Com isto, demonstrar o uso de Qdot nanocristais fluorescentes para rotular derivadas da medula óssea de camundongos DC. A vantagem desta é que a rotulagem Qdot nanocristais possuem estável e de longo fluorescência duradoura que os tornam ideais para a detecção de células marcadas em tecidos recuperados. Para conseguir isso, as primeiras células será recuperado a partir marrows óssea de camundongos e cultivados por 8 dias na presença do fator macrófago-colônia de granulócitos estimulante, a fim de induzir a diferenciação DC. Estas células serão então marcadas com Qdots fluorescentes por curto incubação in vitro. Células coradas podem ser visualizados com um microscópio fluorescente. As células podem ser injetadas em animais experimentais, neste ponto, ou pode ser em células maduras sobre incubação in vitro com estímulos inflamatórios. Em nossas mãos, a maturação DC não determinam a perda do sinal fluorescente nem coloração Qdot afetam as propriedades biológicas dos DCs. Após a injeção, essas células podem ser identificadas em órgãos imune por microscopia fluorescente após dissecção típicos e os processos de fixação.
Protocolo
1. Dissecção dos fêmures e tíbias de rato e cultura de células da medula óssea
- Sacrifício 2 camundongos por asfixia CO 2 e dissecar cuidadosamente tíbias e fêmures sem cortar as extremidades dos ossos.
- Limpa os ossos de todos os tecidos anexado usando lenço de papel. Tenha cuidado para não quebrar os ossos.
- Esterilizar os ossos por imersão em etanol 70% por 10 min em uma placa de Petri 35 mm. A partir deste momento, o trabalho dentro de uma capa de biossegurança para evitar a contaminação das culturas de células.
- Recuperar os ossos a partir do etanol e deixe-os secar por 5 min em uma placa de Petri dentro do armário de biossegurança.
- Cortar os fêmures no meio, e da tíbia por sua ponta mais fina. Infundir o interior do osso com 1 ml de meio RPMI (sem soro, mas com antibióticos), utilizando uma seringa estéril sobre uma placa de Petri estéril.
- A suspensão de células são coletadas e lavadas em meio RPMI 2X por 10 min de centrifugação em um tubo de centrífuga de 15 ml a 1.100 RPM em uma centrífuga refrigerada (4 ° C) com um rotor de caçamba móvel.
- Após a última lavagem, ressuspender as células em 2 ml de tampão de lise ACK e incubar por 5 min à temperatura ambiente, a fim de eliminar as células vermelhas do sangue.
- Adicionar 13 ml de RPMI com 10% de FBS, ressuspender e lavar 2X neste meio com as mesmas configurações, conforme descrito em 1.6.
- Contagem de células, ajustar a 2 x 10 5 células / ml com RPMI 10% FBS, e adicionar rm-GM-CSF (20 concentração ng / ml final) 5.
- Adicionar 10 ml dessa suspensão para uma qualidade microbiológica estéril, 10 cm placa de Petri, e cultura em uma incubadora de CO 2 (37 ° C CO, 5% 2).
- Três dias depois, adicionar outra de 10 ml de RPMI 10% FBS com 20 ng / l de rmGM-CSF a cada um dos pratos preparados.
- Três dias depois, 10 ml de suspensão de células são recuperados a partir de cada placa de Petri, centrifugados como em 1.6, ressuspendido em igual volume de RPMI com 10% FBS rmGM-CSF e voltou para a placa de Petri. As células são cultivadas por 2 dias adicionais no 2 CO incubadora.
2. Coleta e rotulagem das DCs
- Depois de 8 dias em cultura de células frouxamente aderente são recuperados pela lavagem das placas de Petri com meio fresco. Este protocolo torna em torno de 2-4 x10 8 DCs em nossas mãos. As células podem ser analisados para DC fenótipo por citometria de fluxo.
- Células coletadas são então rotulados com o Qtracker Labeling Kit 655 celular seguindo estritamente as instruções do fabricante.
- Temos excelentes resultados rotulagem derivadas da medula óssea de camundongos DCs com Qdots em uma concentração 10 nM. Para conseguir isso, alíquotas de Qtracker Celular componentes Kit Labeling A e B são misturados em volumes iguais, incubadas por 5 min à temperatura ambiente, e imediatamente diluído 1 / 100 em meio fresco com vórtex por 30 s.
- Para manchar 5 x 10 6 DCs, mistura de 5 mL de cada componentes do kit A e B em um tubo eppendorf e incubar por 5 min à temperatura ambiente. Em seguida, adicionar 1 ml de RPMI incubar FBS 10%, e vortex por 30 segundos.
- Adicionar 0,5 ml de suspensão de células contendo 5 6 x10 DCs, e incubar a 37 ° C por 60 min.
- Então, lave as células em RPMI 2X 10% FBS (1.100 RPM). As células podem ser ressuspendido em RPMI para cultura, nem em PBS para injeção em camundongos experimental.
3. Avaliação do DC rotulados
- Rotulagem célula pode ser avaliada por meio de microscopia de fluorescência. Para conseguir isso, uma gota de suspensão de células é adicionado a uma lâmina de microscópio, coberto com uma lamela de vidro, e avaliada com um microscópio fluorescente tendo em conta que estes têm Qdots de emissão e excitação espectros de 565NM e 405-525nm, respectivamente (Fig. 3 )
- Neste ponto, as células rotuladas podem ser usadas para injetar animais, ou de maturação pode ser induzida pela incubação destas células por 48 h (37 ° C, 5 CO 2) na presença de LPS (100 ng / ml) e TNF-( 20 ng / ml). Fluorescentes de rotulagem não é afetado por DC maturação (Fig. 4).
4. Resultados representativos:
Com isto, descrito como preparar derivadas da medula óssea de camundongos DCs e como rotulou-os com Qdots fluorescente. Fig. 1 resume o procedimento para obter as células, enquanto a fig. 2 mostra o procedimento para classificá-los com Qdots. Como mostrado na figura. 3, quase todas as células são rotulados por este procedimento, e este não é afetada pela DC maturação com fatores inflamatórios (Fig. 4). Fig. 5 mostra que Qdot manchada de DCs (Fig.5a) comportam-se semelhante a células não-manchada quando tratados com um cocktail inflamatórias. Ambas as preparações de células de forma semelhante upregulate expressão de moléculas co-estimulatórias (Fig. 5b) e produzir quantidades semelhantes de IL-6 (Fig. 5c) e óxido nítrico (Fig. 5d) sobre os estímulos de maturação. Isto concorda com a PREVIous dados publicados, indicando que a coloração Qdot não afeta a capacidade de DC para se transformar em células maduras capazes de induzir respostas imunes [6]. Estas células podem ser usadas para injetar animais experimentais. Como mostrado na figura. 6, dois dias após a injeção intravenosa de DCs rotulados em camundongos, que foram capazes de detectar Qdot manchada de células do baço. Este também é de acordo com dados publicados previamente mostrando o uso de nanocristais Qdot para avaliar a migração de DC in vivo [6], não-invasivo de imagens e citometria de fluxo.
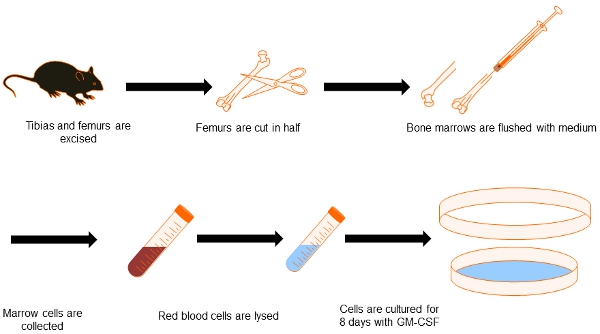
Figura Fluxograma 1. DC de geração a partir de medula óssea. Com isto, descrevem o processo para obter derivadas da medula óssea DC. Ambas as tíbias e fêmures são dissecados e limpa do tecido circundante. Dicas óssea são preservadas e do interior dos ossos são lavados com meio. Depois de eliminar os glóbulos vermelhos, células da medula óssea são cultivados por 8 dias na presença de GM-CSF para diferenciá-los em DCs.
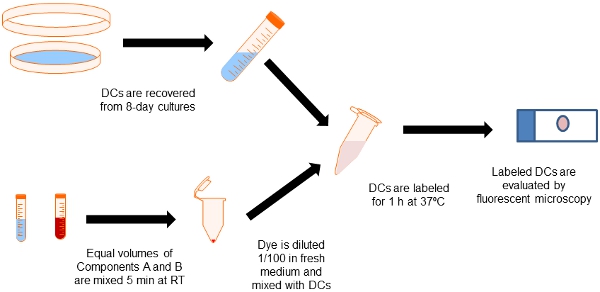
Figura Fluxograma 2. Do procedimento de rotulagem. Alíquotas iguais de Qtracker Celular componentes Kit Labeling A e B são misturados em um tubo eppendorf. As células dendríticas são recolhidos a partir de 8 dias culturas de medula óssea com a GM-CSF e misturado com o corante de rotulagem para os 60 minutos a 37C. Em seguida, as células são lavadas na mídia para eliminar as partículas rotulagem excesso.

Figura 3. Microfotografia fluorescente de DCs imediatamente após rotulagem. Uma gota de células marcadas foi depositado em uma lâmina de vidro e coberto por uma lamínula. Então, as amostras foram avaliadas em um microscópio de fluorescência e as imagens foram adquiridas através de uma câmera digital 5,0 Micropublisher Cor CCD (Qimaging, Surrey, BC Canada).
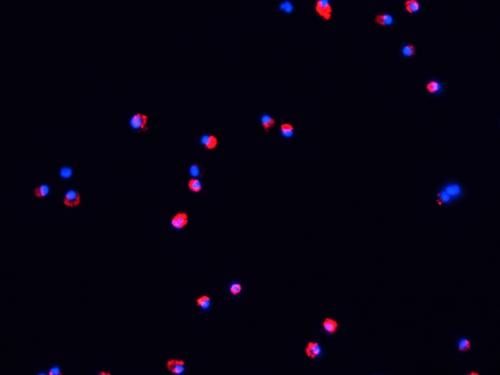
Figura 4. Microfotografia fluorescente de DCs após 48 h de maturação in vitro. DCs rotulados foram cultivadas por 48 h com LPS (100 ng / ml) e TNF-α (20 ng / ml) em lâminas de vidro em uma incubadora de CO 2 (37 ° C CO, 5% 2). Então, as amostras foram lavadas com PBS (5 min, 2X), fixado com acetona (15 min, 4 ° C) e contrastado com DAPI. As células foram avaliadas em um microscópio de fluorescência como acima.
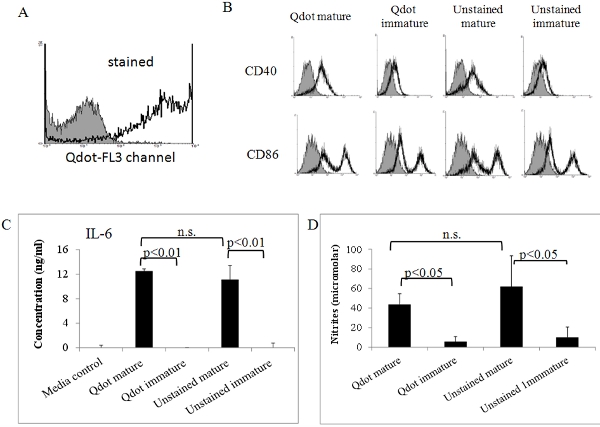
Figura 5. A atividade biológica de Qdot manchada DCs maduras. DCs rotulados maturados in vitro como acima foram analisados por citometria de fluxo (A) e (B). (A) Qdot manchada de células dão um sinal forte no canal FL3 (PerCP). Sombreada histograma: controle imaculada. (B) DCs Qdot manchadas e sem manchas foram adicionalmente corados com anticorpos específicos contra maturação marcadores CD86 e CD40; e controles isotipo. As células foram então analisados em um citômetro de fluxo FACSort (Becton Dickinson, San Jose, CA). Além disso, IL-6 (C) e óxido nítrico (NO) foram determinados em sobrenadantes de madura Qdot manchada de DCs e controles. Níveis de IL-6 e óxido nítrico foi determinada por meio de ELISA análise e ensaio de Griess como temos descrito anteriormente 7, 8. Todos os dados mostraram nesta figura é representativa de dois ou três experimentos independentes mostrando resultados semelhantes. Os dados foram analisados por ANOVA, utilizando o software GraphPad.
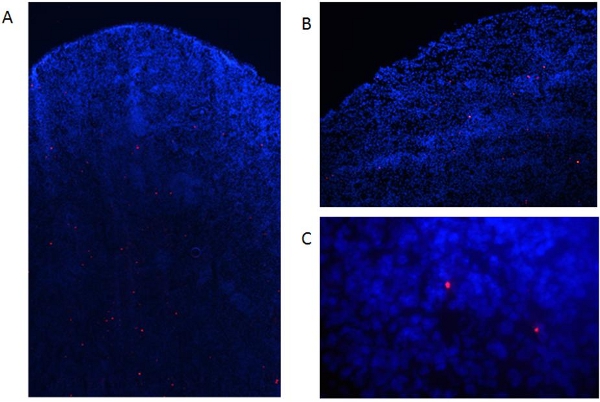
Figura 6. Detecção de DCs rotuladas de tecidos dissecados. Rotulados DCs maduras (1x10 6 células) foram injetadas em ratos por via intravenosa C57BL / 6. (A) Dois dias depois, os ratos foram sacrificados e os baços coletados, snap congelados, embutidos em outubro e 8 seções mM preparada com a criostato. Em seguida, amostras foram fixadas com acetona (15 min, 4 ° C) e contrastado com DAPI. As células foram avaliadas em um microscópio de fluorescência como acima Fig. 6a:. Ampliação de 40x, Fig. 6b: aumento de 100X, fig. Ampliação, 6C 400X.
Discussão
Murino mielóide) DCs têm sido amplamente utilizados, a fim de determinar a eficácia e melhoria da DC baseado em vacinas; investigar DC: interações de células T ou desenvolvimento DC, e determinar seu papel em várias doenças 9-11. Com isto mostramos como gerar DCs a partir de precursores recuperado de medulas ósseas de tíbias e fêmures. Nós recuperar os ossos sem cortar as pontas, permitindo-nos para esterilizá-los por submersão em etanol 70%, reduzindo assim a probabilidade de contaminação. Para diferenciar CDs a partir de células de medula óssea só usamos GM-CSF como 5 descritos anteriormente. Apesar de alguns protocolos também usar IL-4, tem sido relatado que essa citocina não é necessário quando se trabalha com altos níveis de GM-CSF 12. Na verdade, nós já demonstraram que essas DCs são capazes de induzir respostas imunes 13. Além disso, o cuidado tem que ser tomadas para recuperar as células aderentes apenas vagamente de 8 dias-culturas, lavando os pratos de Petri com meio desde células anexados mostram um fenótipo mais monócitos-like. Aqui nós mostramos a rotulagem de DCs com partículas Qdot fluorescente. Esta rotulagem tem algumas vantagens relativamente a outros métodos. Primeiro, as partículas Qdots são facilmente incorporados nas células. Segundo, o sinal fluorescente é muito alto e não é alterada pela maturação DC. Terceiro, a fluorescência não é perdido quando as células ou tecidos são fixados com solventes, como acetona, ao contrário do que acontece se GFP é utilizada para tag DCs 14, dando mais flexibilidade no momento de escolher protocolos de coloração. Finalmente, o sinal de alta fluorescentes dada por essas partículas permite a visualização das células, apesar de tecidos auto-fluorescência. Como descrito anteriormente 6, coloração Qdot não afetou a capacidade de maturação dessas células. Com isto mostramos que Qdot manchada de DCs se comportam de maneira semelhante como não-manchada DCs, upregulating moléculas co-estimulatórias e produção de IL-6 e óxido nítrico em resposta a estímulos inflamatórios. Embora DCs são células especializadas no desencadear respostas imunes, eles foram mostrados para participar em condições patológicas, como câncer e aterosclerose 4, 15, 16. Eles foram também alegou a participar de processo angiogênico 17, 18, chegou a sugerir como estruturalmente participantes no desenvolvimento de novos vasos 19, 20. Assim, os métodos que permitem o rastreamento de DC in vivo, e determinar a sua localização geográfica em diferentes tecidos 4, 21, 22 são muito valiosos.
Divulgações
Agradecimentos
Este trabalho apoiado em parte pelo NIH Grant sob CA137499 R15-01 (FB) e um fundo de arranque da Universidade de Ohio (FB).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| Camundongos C57BL / 6 | Jackson laboratórios | Fêmeas, 6-8 semanas de idade | |
| RPMI | Invitrogen | 11875-119 | |
| Soro fetal bovino, qualificado | Invitrogen | 10437-028 | |
| Antibiótico antimicótico | Invitrogen | 15240-096 | |
| PBS | Invitrogen | 10010-049 | |
| Tampão de Lise ACK | Lonza Walkersville, Inc | 10-548E | |
| Recombinante murino GM-CSF | PeproTech Inc | 315-03 | |
| Qtracker 655 Kit Labeling celular | Invitrogen | Q25021MP | |
| Lipopolissacarídeo | Invivogen | tlrl-eblps | |
| Recombinante murino TNF alpha | Peprotech | 315-01A | |
| CD86 anticorpo | BD Biosciences | 553691 | |
| CD40 anticorpo | BD Biosciences | 553791 | |
| Sistema reagente de Griess | Promega | G2930 | |
| IL-6 anticorpo de captura | eBioscience | 13-7061-81 | |
| Anticorpo de detecção de IL-6 | eBioscience | 13-7062-81 |
Referências
- Banchereau, J., Briere, F., Caux, C., Davoust, J., Lebecque, S., Liu, Y. J., Pulendran, B., Palucka, K. Immunobiology of dendritic cells. Annu Rev Immunol. 18, 767-811 (2000).
- Bonasio, R., von Andrian, U. H. Generation, migration and function of circulating dendritic cells. Curr Opin Immunol. 18, 503-511 (2006).
- Lanzavecchia, A., Sallusto, F. The instructive role of dendritic cells on T cell responses: lineages, plasticity and kinetics. Curr Opin Immunol. 13, 291-298 (2001).
- Conejo-Garcia, J. R., Benencia, F., Courreges, M. C., Kang, E., Mohamed-Hadley, A., Buckanovich, R. J., Holtz, D. O., Jenkins, A., Na, H., Zhang, L. Tumor-infiltrating dendritic cell precursors recruited by a beta-defensin contribute to vasculogenesis under the influence of Vegf-A. Nat Med. 10, 950-958 (2004).
- Lutz, M. B., Kukutsch, N., Ogilvie, A. L., Rossner, S., Koch, F., Romani, N., Schuler, G. An advanced culture method for generating large quantities of highly pure dendritic cells from mouse bone marrow. J Immunol Methods. 223, 77-92 (1999).
- Noh, Y. W., Lim, Y. T., Chung, B. H. Noninvasive imaging of dendritic cell migration into lymph nodes using near-infrared fluorescent semiconductor nanocrystals. Faseb J. 22, 3908-3918 (2008).
- Benencia, F., Courreges, M. C., Conejo-Garcia, J. R., Mohamed-Hadley, A., Zhang, L., Buckanovich, R. J., Carroll, R., Fraser, N., Coukos, G., Franco, L. G. HSV oncolytic therapy upregulates interferon-inducible chemokines and recruits immune effector cells in ovarian cancer. Mol Ther. 12, 789-802 (2005).
- Gilboa, E., Vieweg, J. Cancer immunotherapy with mRNA-transfected dendritic cells. Immunol Rev. 199, 251-263 (2004).
- Grolleau-Julius, A., Abernathy, L., Harning, E., Yung, R. L. Mechanisms of murine dendritic cell antitumor dysfunction in aging. Cancer Immunol Immunother. 58, 1935-1939 (2009).
- Yrlid, U., Svensson, M., Johansson, C., Wick, M. J. Salmonella infection of bone marrow-derived macrophages and dendritic cells: influence on antigen presentation and initiating an immune response. FEMS Immunol Med Microbiol. 27, 313-320 (2000).
- Lutz, M. B., Schnare, M., Menges, M., Rossner, S., Rollinghoff, M., Schuler, G., Gessner, A. Differential functions of IL-4 receptor types I and II for dendritic cell maturation and IL-12 production and their dependency on GM-CSF. J Immunol. 169, 3574-3580 (2002).
- Benencia, F., Courreges, M. C., Coukos, G. Whole tumor antigen vaccination using dendritic cells: comparison of RNA electroporation and pulsing with UV-irradiated tumor cells. J Transl Med. 6, 21-21 (2008).
- Probst, H. C., Tschannen, K., Odermatt, B., Schwendener, R., Zinkernagel, R. M., Van Den Broek, M. Histological analysis of CD11c-DTR/GFP mice after in vivo depletion of dendritic cells. Clin Exp Immunol. 141, 398-404 (2005).
- Fainaru, O., Adini, A., Benny, O., Adini, I., Short, S., Bazinet, L., Nakai, K., Pravda, E., Hornstein, M. D., D'Amato, R. J., Folkman, J. Dendritic cells support angiogenesis and promote lesion growth in a murine model of endometriosis. Faseb J. 22, 522-529 (2008).
- Bobryshev, Y. V., Lord, R. S., Rainer, S., Jamal, O. S., Munro, V. F. Vascular dendritic cells and atherosclerosis. Pathol Res Pract. 192, 462-467 (1996).
- Nakai, K., Fainaru, O., Bazinet, L., Pakneshan, P., Benny, O., Pravda, E., Folkman, J., D'Amato, R. J. Dendritic cells augment choroidal neovascularization. Invest Ophthalmol Vis Sci. 49, 3666-3670 (2008).
- Huarte, E., Cubillos-Ruiz, J. R., Nesbeth, Y. C., Scarlett, U. K., Martinez, D. G., Buckanovich, R. J., Benencia, F., Stan, R. V., Keler, T., Sarobe, P. Depletion of dendritic cells delays ovarian cancer progression by boosting antitumor immunity. Cancer Res. 68, 7684-7691 (2008).
- Fernandez Pujol, B., Lucibello, F. C., Zuzarte, M., Lutjens, P., Muller, R., Havemann, K. Dendritic cells derived from peripheral monocytes express endothelial markers and in the presence of angiogenic growth factors differentiate into endothelial-like cells. Eur J Cell Biol. 80, 99-110 (2001).
- Gottfried, E., Kreutz, M., Haffner, S., Holler, E., Iacobelli, M., Andreesen, R., Eissner, G. Differentiation of human tumour-associated dendritic cells into endothelial-like cells: an alternative pathway of tumour angiogenesis. Scand J Immunol. 65, 329-335 (2007).
- Bobryshev, Y. V., Lord, R. S. Mapping of vascular dendritic cells in atherosclerotic arteries suggests their involvement in local immune-inflammatory reactions. Cardiovasc Res. 37, 799-810 (1998).
- Bobryshev, Y. V., Lord, R. S. Co-accumulation of dendritic cells and natural killer T cells within rupture-prone regions in human atherosclerotic plaques. J Histochem Cytochem. 53, 781-785 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados