É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Detecção de Óxido Nítrico e ânion radical superóxido por espectroscopia de ressonância paramagnética eletrônica a partir de células usando armadilhas para spins
Neste Artigo
Resumo
Electron paramagnético espectroscopia de ressonância (EPR) foi utilizado para detectar o óxido nítrico a partir de células endoteliais de aorta bovina e anião radical superóxido por neutrófilos humanos, utilizando ferro (II)-N-metil-D-glucamina ditiocarbamato, Fe (DMG) 2 E 5,5-dimetil-1-pyroroline-N-óxido, DMPO, respectivamente.
Resumo
Azoto reactivo / espécies de oxigénio (ROS / RNS) a baixas concentrações desempenhar um papel importante na regulação da função celular, de sinalização, e da resposta imune, mas em concentrações não regulados são prejudiciais para a viabilidade da célula 1, 2. Embora os sistemas vivos evoluíram com mecanismos de defesa antioxidantes endógenos e dietético para regular ROS geração, ROS são produzidos continuamente como natural, através da sub-produtos do metabolismo normal de oxigénio e pode causar danos oxidativos a biomoléculas, resultando em perda da função da proteína, a clivagem de ADN, ou lípido peroxidação 3, e, finalmente, ao estresse oxidativo levando a lesão ou morte celular 4.
Anião radical superóxido (O2 • -) é o principal precursor de algumas das espécies mais altamente oxidantes conhecidos de existir em sistemas biológicos, tais como o peroxinitrito e radical hidroxilo. A geração de O 2 • - sinaliza o primeiro sinal de explosão oxidativa e, portanto, idetecção st e / ou a apreensão em sistemas biológicos é importante. Nesta demonstração, O 2 • - foi gerada a partir de neutrófilos (PMN). Através da estimulação com quimiotáctica de forbol-12-miristato-13-acetato (PMA), PMN gera O 2 • - através da activação de nicotinamida adenina dinucleótido fosfato oxidase (NADPH) 5.
O óxido nítrico sintase (NO) que vem em três isoformas, como induzível-,-neuronal e endoteliais-SOE, ou iNOS, nNOS ou eNOS, respectivamente, catalisa a conversão de L-arginina a L-citrulina, utilizando NADPH para produzir NO 6 . Aqui, nós gerado NO a partir de células endoteliais. Sob condições de stress oxidativo, eNOS por exemplo, pode mudar de produzir NO para O 2 • - por um processo chamado de desacoplamento, o que se acredita ser causada pela oxidação do heme 7 ou o co-factor, tetrahidrobiopterina (BH 4) 8.
Há apenas poucosmétodos fiáveis para a detecção de radicais livres em sistemas biológicos, mas estão limitados por especificidade e sensibilidade. Aprisionamento de rotação é vulgarmente utilizado para a identificação de radicais livres e envolve a reacção de adição de um radical de uma armadilha de spin formando um aducto de spin persistente que pode ser detectado por espectroscopia de ressonância paramagnética electrónica (EPR). Os aductos vários radicais apresentam espectro característico que pode ser usado para identificar os radicais sendo geradas e pode fornecer uma grande quantidade de informação sobre a natureza e da cinética da produção de radical 9.
As nitronas cíclicas, 5,5-dimetil-pirrolina-N-óxido, DMPO 10, o DEPMPO fosforilo-substituído 11, eo éster-substituído, Empo 12 e BMPO 13, têm sido largamente utilizados como armadilhas de spin - o spin último armadilhas exibindo mais uma meia-vida de O 2 • - aduto. Ferro (II)-N-metil-D-glucamina ditiocarbamato, Fe (DMG) 2 </> Sub é vulgarmente usado para prender NO devido à elevada taxa de formação de aduto ea estabilidade elevada do adueto de rotação 14.
Protocolo
1. Cultura de Células endoteliais de aorta bovina (BAEC)
- Técnicas adequadas de assepsia foram seguidos.
- Num meio de água do banho quente, sem antibióticos, a 37 ° C.
Nota: O meio consiste em fenol meio Dulbecco modificado por Eagle livre (DMEM) com 4,5 g / L D-glucose, 4 mM de L-glutamina, 1% de não-aminoácidos essenciais, suplementado com 10% de soro fetal bovino (FBS) e 2,5 mg / L o factor de crescimento endotelial.
- Remover as células T75 balão contendo a partir da incubadora e limpar a superfície do balão com etanol 70% antes de colocá-lo dentro do capuz.
- Remover o meio antigo usando um aspirador e lavar duas vezes com 5 ml de fosfato de Dulbecco tampão salina (DPBS).
- Adicionar 2 ml de tripsina e esperar por 4-5 min para as células a separar enquanto periodicamente inspeccionar sob o microscópio.
- Adicionar 3 ml do meio de misturar e repetidamente, utilizando uma pipeta de t separadoele células e criam uma suspensão mesmo.
- Transferir 5 ml de meio com tripsina para um tubo de 15 ml e centrifugar a 121 g durante 5 min.
- Remover o sobrenadante utilizando um aspirador. Adicionar 5 ml de DPBS e misture bem. Centrifugar a 121g durante 5 min.
- Aspirar o sobrenadante e re-suspender o sedimento de células por adição de 6 ml de meio.
- Em uma placa de 6 poços, adicionar 1 ml da suspensão de células a cada poço, em seguida, adicionar 1 ml de meio. Misturar a suspensão utilizando uma pipeta.
- Rotular o placa e incubar durante a noite a 37 ° C e 5% de CO 2.
2A. Detecção de NO com Cell BAEC
- Técnicas adequadas de assepsia foram seguidos.
- Remova a placa de 6 poços da incubadora e aspirar o meio a partir do primeiro poço. Lave as células duas vezes com DPBS 1 ml.
- Adicionar 210 uL de 1,9 mM de sulfato de ferro hepta-hidratado (II) (FeSO 4 .7 H2O, preparar recentemente por dissolução de 0,8 mg em1 ml com DPBS CaCl2 e MgCl2) e uL 210 de amónio de N-metil-D-glucamina ditiocarbamato (DGM, preparar recentemente por dissolução de 2,7 mg em 500 ul com DPBS CaCl2 e MgCl 2) utilizando um rácio de 1:7 . (Nota:. Este rácio onde MGD excesso é usado tem sido convencionalmente empregue para a preparação de Fe 2 +-MGD complexa devido ao facto de que o rendimento do Fe 3 +-MGD é maximizada na presença de excesso de MGD A adição de ascorbato em solução para estabilizar o Fe 2 +-MGD não é necessário uma vez que a NO-3 Fe +-MGD formado é endogenamente reduzido para o EPR detectável NO-Fe 2 +-MGD por ascorbato, hidroquinona, ou cisteína com uma eficiência de conversão de até a 99,9% .. O estado diamagnético baixo spin de Fe 2 + permite a detecção de NO utilizando células plana ou tubo capilar, sem a necessidade de um dispositivo de baixa temperatura) 15.
- Swirl a suspensão resultante bem e acrescente 4,6 μl de ionóforo de cálcio (CAI) (preparado a partir de uma solução stock de 1,9 mM por dissolução de 1 mg em 1 ml de DMSO).
- Solução Agitar o novo e incubar a 37 ° C durante 36 min, a fim de permitir ainda mais redução de NO-Fe 3 +-MGD para o EPR detectável NO-Fe 2 +-MGD.
- Recolher o sobrenadante (425 ul) em um tubo de Eppendorf e transferência para uma célula de EPR plana (ou para um tubo de 50 uL capilar).
- Parâmetros de aquisição EPR são: freqüência de microondas: 9,8 GHz; centro do campo: 3427 G; modulação de amplitude: 6,0 G; largura de varredura: 100 G; ganho do receptor: 1 x 10 5; potência de microondas: 10 mW; número total de verificações: 121; tempo de varredura: 10 s; tempo e constante: 20 ms (Nota: Uma vez que os parâmetros variam de um instrumento e condições experimentais para outro, portanto, apenas o campo de centro, a freqüência ea modulação de amplitude são os parâmetros mais importantes a considerar.).
- Gravar os espectros à temperatura ambiente e os espectros de 2-D foram integclassificado para reduzir o ruído de fundo ea linha de base corrigido usando Bruker WinEPR software de processamento de dados ou software de processamento de dados. Para a quantificação de formação de aduto, parcelas padrão de concentração versus intensidade de sinal (ou área) pode ser construída usando um SNAP dador NO.
2B. eNOS Experiment Desacoplamento
- Remova a placa de 6 poços da incubadora e aspirar o meio a partir do segundo poço e lavar duas vezes com DPBS 1 ml.
- Um doador de peroxinitrito, 5-amino-3-(4-morfolinil) -1,2,3-oxadiazolium cloreto de (SIN-1) foi utilizado para desacoplar eNOS 16. Adicionar 100 uL de 0,5 mm de SIN-1 (M r 206,6 g / mol, a partir de 10 mM de solução stock preparada por dissolução de 1 mg de SIN-1 em 500 ul de PBS sem iões Ca / Mg) e diluído para 2 ml com DPBS e 10% de FBS.
- Incubar durante 2 horas a 37 ° C e 5% de CO 2.
- Retirar a placa da incubadora e lavar duas vezes com DPBS.
- Adicionar 210 uL de2,8 mM de FeSO 4 .7 H2O e 210 uL de 19,6 mM MGD recém-preparado de acordo com o procedimento acima mencionado.
- Solução redemoinho e adicionar 4,6 ul de 1,9 mM CAI.
- Solução Agitar o novo e incubar a 37 ° C durante 36 min.
- Recolher o sobrenadante (425 ul) em um tubo de Eppendorf e transferência para uma célula de EPR plana.
- Parâmetros de aquisição EPR são: freqüência de microondas: 9,8 GHz; centro do campo: 3427 G; modulação de amplitude: 6 G; largura de varredura: 100 G; ganho do receptor: 1 x 10 5; potência de microondas: 10 mW; número total de verificações: 121; tempo de varrimento: 10 s; e constante de tempo: de 20 ms.
- Gravar os espectros e os espectros de 2-D foram integradas para reduzir o ruído de fundo e de linha de base corrigido como mencionado acima.
3. Detecção de O 2 • - a partir de neutrófilos polimorfonucleares (PMNs)
- Os neutrófilos foram isolados a partir de amostra de sangue humano, como descrito anteriormente 17.
- Fazer uma solução stock de 1 M DMPO * em PBS contendo 0,1 mM de dietilenotriamina-pentacético ácido (DTPA). DMPO tem um ponto de fusão de 25-29 ° C por isso é mais conveniente para pipetar DMPO líquido (densidade ~ 1,02 g / ml a 25 ° C) para um frasco de vidro (Nota: não utilizar frascos de plástico para a pesagem de desde DMPO puro reage com plástico). Congelado DMPO pode ser derretido, executando água morna para o frasco (Nota: não correr água quente como DMPO pode se decompor).
- É importante a utilização de elevada pureza DMPO (> 99%) desde algumas das armadilhas de spin comercialmente disponíveis contêm impurezas paramagnéticas, e portanto, é imperativo para executar espectro EPR de apenas a solução DMPO por si só (10 mM, neste caso). É crítico que nenhum sinal de fundo é evidente (ver Figura 3A).
- Preparar solução de reserva (1 mg / ml) de forbol-12-miristato-13-acetato (PMA) em DMSO. Fazer alíquotas por diluição da solução a 10 ug / ml em PBS.
- Em um 1.5 ml tubo Eppendorf, preparar uma solução com um volume total de 0,6 ml, seguindo a sequência da adição: ~ 10 6 células por ml de PMN, D-glucose (1 mg / ml) e albumina (1 mg / ml), 10 mM DMPO e 0,2 ug / ml de PMA. (Nota: PMA é o activador de radicais e deve ser adicionado por último).
- Transferir a solução para uma célula de EPR plana.
- Parâmetros de EPR condições de aquisição são: freqüência de microondas: 9,8 GHz; centro do campo: 3486 G; modulação de amplitude: 0,5 G; largura de varredura: 100 G; ganho do receptor: 5 x 10 5; número total de exames: 10; tempo de varredura: 30 s ; potência de microondas: 20 mW; e constante de tempo: ms 81. Para a quantificação de formação de aduto, parcelas padrão de concentração versus intensidade de sinal (ou área) pode ser construída usando os nitróxidos estáveis, tais como TEMPO ou 3-carboxílico-PROXYL.
* Nota importante sobre a utilização de DMPO: Ao utilizar uma célula plana, pode-se aumentar a densidade de células, e assim aumentar o sinalintensidade do aducto de rotação, mas a meia-vida de O 2 • - aducto de DMPO é curto (t 1/2 ~ 1 min), que se decompõe para DMPO-OH. DMPO podem ser substituídos usando as mesmas concentrações de Empo, BMPO ou DEPMPO que estão disponíveis comercialmente para a estabilidade aumentada aducto com t 1/2 ~ 8 e 14 min, respectivamente.
4. Os resultados representativos
Girar aprisionamento de NO radical foi realizada utilizando Fe 2 +-MGD 2A. Figura e 2B mostram nenhum sinal EPR de Fe 2 +-MGD ou mistura de Fe 2 +-MGD com a CAI, indicando que nenhum sinal de fundo NO origina a partir destes reagentes. BAEC após estimulação com a CAI, que liberta NO reage com o Fe 2 +-MGD para formar o aducto de rotação, NO-Fe 2 +-MGD, e mostra um sinal tripleto característica com valor hiperfina separação (hfsc) constante de uma N = 12,66 G e fator g de g = 2,040. (Figura 2C). O hfvalor sc foi determinada utilizando o programa de simulação WINSIM que pode ser baixado do site NIEHS Banco de Dados Software EPR. O hfsc experimental é consistente com o valor da literatura de um N = 12,70 G e G = 2,041 18 para o NO Fe-2 +-MGD aduto. Do mesmo modo, o efeito de SIN-1 em BAEC baixou a produção de NO, devido à eNOS desacoplamento como mostrado na Figura 2D.
DMPO armadilha de spin foi usado para O 2 • - detecção. DMPO por si só não deu um sinal conforme mostrado nas Figuras 3A e confirmação de que a armadilha de rotação é livre de impurezas paramagnéticas. A Figura 3B é o espectro de DMPO e PMNs apenas, e da mesma forma, não há sinal detectável, sugerindo que o DMPO não causar activação do NADPH oxidase enzima. A Figura 3C mostra o sinal observado EPR após estimulação de PMN por PMA. Os valores hfsc para este sinal foram determinados como sendo um N = 14,71 G, um ebeta-H = 11,40 G e uma γ-H = 1,25 G, e são consistentes com os valores na literatura de um N = 14,3 G, uma β-H = 11,7 G e uma γ-H = 1,3 G 19 para DMPO-ó 2 aducto H.

Figura 1. Fluxograma para a detecção de radicais a partir de neutrófilos e BAEC utilizando armadilhas de spin de EPR. (A) PMNs foram misturados com DMPO e PMA, ea mistura resultante transferida para uma célula de EPR plana para aquisição de dados. (B) BAEC foram cultivadas numa placa, e lavou-se com DPBS. A rotação armadilha Fe (MGD) 2 foi adicionado juntamente com CAI. A solução foi misturada cuidadosamente e incubados. A mistura foi transferida para uma célula de EPR plana para a EPR aquisição de dados.
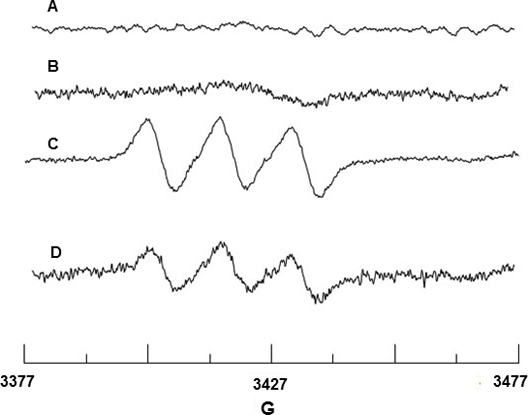
Figura 2. Detecção EPR de NO a partir de BAEC. (A) Espectro de Fe 2 +-MGD apenas (B) Espectro de Fe 2 +-MGD + CAI só. (C) Espectro de Triplet resultante a partir do NO aprisionamento por Fe 2 +-MGD usando CAI-estimulado células. (D) Espectro mostrando diminuição da produção de NO devido a 0,5 mM SIN-1 o tratamento de células.
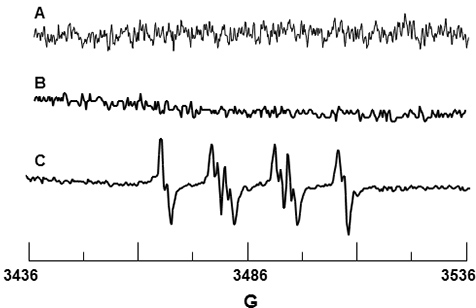
Figura 3. Detecção EPR de H 2 DMPO-O a partir de neutrófilos activados. (A) Espectro de 10 mM DMPO só. (B) Espectro de PMN sozinho na presença de 10 DMPO mM. (C) Espectro de PMN activado por PMA, na presença de 10 DMPO mM.
Access restricted. Please log in or start a trial to view this content.
Discussão
EPR aprisionamento de rotação tem sido empregada em uma ampla variedade de aplicações biomédicas para quantificar e identificar os radicais livres. Aprisionamento de rotação é altamente sensível, capaz de detectar os radicais em concentrações que variam de nM a iM, tornando-o adequado para aplicação em sistemas biológicos. A formação do aduto paramagnético, NO-Fe 2 +-MGD, é a base de NO a detecção através de EPR. Fe 2 +-MGD reage com NO rapidamente 18 a uma ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pelo NIH National Heart, Lung, and Blood Institute concessão RO1 HL81248.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
| Fenol meio DMEM livre Alta glicose 1X | GIBCO | 31053 | |
| 0,25% de tripsina-EDTA | GIBCO | 25200 | |
| L-Glutamina | Fisher Scientific | BP379-100 | |
| MEM aminoácidos não essenciais | GIBCO | 11140 | |
| Soro fetal de bovino | Atlanta Biologicals | S11550 | |
| Factor de crescimento endotelial | Millipore | 02-102 | |
| CAI | Enzo Ciências da Vida | A-23187 | Dissolve-se em DMSO |
| SIN-1 | Enzo Ciências da Vida | BML-CN245-0020 | |
| DMPO | Dojindo Laboratories | D048-10 | |
| FeSO 4 .7 H 2 O | Sigma Aldrich | 215.422-250G | Dissolve-se em PBS com Ca e Mg |
| MGD | Enzo Ciências da Vida | ALX-400-014-M050 | Dissolve-se em PBS com Ca 2 + e Mg 2 + |
| Células BAEC | Cell Systems | 2B2-C75 | |
| DMSO | Fisher Scientific | BP231-100 | |
| DPBS | Sigma Aldrich | D8537 | |
| DPBS com CaCl2 e MgCl 2 | Sigma Aldrich | D8662 | |
| Forbol miristato-acetato (PMA) | Sigma Aldrich | 79346-1mg |
Referências
- Winterbourn, C. C. Reconciling the chemistry and biology of reactive oxygen species. Nat. Chem. Biol. 4, 278-286 (2008).
- Winterbourn, C. C., Hampton, M. B. Thiol chemistry and specificity in redox signaling. Free Radic. Biol. Med. 45, 549-561 (2008).
- Oxygen, Gene Expression, and Cellular Function. Clerch, L. B., Massaro, D. J. , (1997).
- Gutteridge, J. M. C., Halliwell, B. Antioxidants: Molecules, medicines, and myths. Biochem. Biophys. Res. Commun. 393, 561-564 (2010).
- Sumimoto, H. Structure, regulation and evolution of Nox-family NADPH oxidases that produce reactive oxygen species. FEBS J. 275, 3249-3277 (2008).
- Ignarro, L. J. Editor Nitric Oxide: Biology and Pathobiology. , Academic Press. San Diego, CA. (2009).
- Moreau, M. Differential effects of alkyl- and arylguanidines on the stability and reactivity of inducible NOS heme-dioxygen complexes. Biochemistry. 45, 3988-3999 (2006).
- Vasquez-Vivar, J. Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors. Proc. Natl. Acad. Sci. U. S. A. 95, 9220-9225 (1998).
- Villamena, F. A., Zweier, J. L. Detection of reactive oxygen and nitrogen species by EPR spin trapping. Antioxid. Redox Signal. 6, 619-629 (2004).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping of superoxide and hydroxyl radical: practical aspects. Arch. Biochem. Biophys. 200, 1-16 (1980).
- Frejaville, C. 5-Diethoxyphosphoryl-5-methyl-1-pyrroline N-oxide (DEPMPO): a new phosphorylated nitrone for the efficient in vitro and in vivo spin trapping of oxygen-centered radicals. J. Chem. Soc., Chem. Commun. , 1793-1794 (1994).
- Olive, G., Mercier, A., Le Moigne, F., Rockenbauer, A., Tordo, P. 2-Ethoxycarbonyl-2-methyl-3,4-dihydro-2H-pyrrole-1-oxide: Evaluation of the spin trapping properties. Free Radical. Biol. Med. 28, 403-408 (2000).
- Villamena, F. A., Zweier, J. L. Superoxide radical trapping and spin adduct decay of 5-tert-butoxycarbonyl-5-methyl-1-pyrroline N-oxide (BocMPO): kinetics and theoretical analysis. J. Chem. Soc., Perkin Trans. 2, 1340-1344 (2002).
- Tsuchiya, K. Nitric oxide-forming reactions of the water-soluble nitric oxide spin-trapping agent, MGD. Free Radical Biol. Med. 27, 347-355 (1999).
- Vanin, A. F., Poltorakov, A. P., Mikoyan, V. D., Kubrina, L. N., van Faassen, E. Why iron-dithiocarbamates ensure detection of nitric oxide in cells and tissues. Nitric Oxide. 15, 295-311 (2006).
- RojasWahl, R. U. Decomposition mechanism of 3-N-morpholinosydnonimine (SIN-1): A density functional study on intrinsic structures and reactivities. J. Mol. Model. 10, 121-129 (2004).
- Klempner, M. S., Gallin, J. I. Separation and functional characterization of human neutrophil subpopulations. Blood. 51, 659-669 (1978).
- Pou, S. Spin trapping of nitric oxide by ferro-chelates: kinetic and in vivo pharmacokinetic studies. Biochim. Biophys. Acta. 1427, 216-226 (1999).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping. Kinetics of the reaction of superoxide and hydroxyl radicals with nitrones. J. Am. Chem. Soc. 102, 4994-4999 (1980).
- Britigan, B. E., Rosen, G. M. Spin-trapping and human neutrophils. Limits of detection of hydroxyl radical. J. Biol. Chem. 264, 12299-12302 (1989).
- Frejaville, C. 5-(Diethoxyphosphoryl)-5-methyl-1-pyrroline N-oxide: A new efficient phosphorylated nitrone for the in vitro and in vivo spin trapping of oxygen-centered radicals. J. Med. Chem. 38, 258-265 (1995).
- Snyrychova, I. Improvement of the sensitivity of EPR spin trapping in biological systems by cyclodextrins: A model study with thylakoids and photosystem II particles. Free Radical Biol. Med. 48, 264-274 (2010).
- Han, Y. Lipophilic beta-cyclodextrin cyclic-nitrone conjugate: Synthesis and spin trapping studies. J. Org. Chem. 74, 5369-5380 (2009).
- Han, Y., Tuccio, B., Lauricella, R., Villamena, F. A. Improved spin trapping properties by beta-cyclodextrin-cyclic nitrone conjugate. J. Org. Chem. 73, 7108-7117 (2008).
- Hardy, M. Detection, characterization, and decay kinetics of ROS and thiyl adducts of mito-DEPMPO spin trap. Chem. Res. Toxicol. 20, 1053-1060 (2007).
- Kim, S. -U. Fast reactivity of a cyclic nitrone-calix[4]pyrrole conjugate with superoxide radical anion: Theoretical and experimental studies. J. Am. Chem. Soc. 132, 17157-17173 (2010).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados