É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Relação custo-benefício Método de Rastreamento Fonte microbiana, utilizando específicas Vírus Humano e Animal
Neste Artigo
Resumo
O estudo descreve um método de baixo custo para a identificação da fonte de contaminação fecal / urinária ou contaminação por nitratos na água usando qPCR para a quantificação específica de vírus de DNA humano / suínos / bovinos, adenovírus e polyomaviruses, propostos como ferramentas de MST.
Resumo
Contaminação microbiana do ambiente representa um risco significativo à saúde. Clássica bacteriana fecal indicadores têm mostrado ter limitações significativas, os vírus são mais resistentes aos processos de inativação muitos e padrão de indicadores de contaminação fecal não informar sobre a fonte de contaminação. O desenvolvimento da relação custo-eficácia dos métodos para a concentração de vírus a partir de água e ensaios moleculares facilita a aplicabilidade de vírus como indicadores de contaminação fecal e como fonte microbiana de rastreamento (MST) ferramentas. Adenovírus e vírus de DNA são polyomaviruses infectar espécies de vertebrados específicas, incluindo os seres humanos e são persistentemente excretados nas fezes e / ou urina em todas as áreas geográficas estudadas. Em estudos anteriores, sugerimos a quantificação do adenovírus humano (HAdV) e polyomaviruses JC (JCPyV) por PCR quantitativo (qPCR) como um índice de contaminação fecal humano. Recentemente, desenvolvemos ensaios qPCR para a quantificação específica de Poradenovírus cine (PAdV) e polyomaviruses bovina (BPyV) como animal de contaminação fecal marcadores com sensibilidades de cópias do genoma 1-10 por tubo de ensaio. Neste estudo, apresentamos o procedimento a ser seguido para identificar a fonte de contaminação em amostras de água utilizando essas ferramentas. Como exemplo de resultados representativos, análise de vírus em águas subterrâneas que apresentem níveis elevados de nitratos é mostrado.
Detecção de vírus em baixa ou moderada águas poluídas exige a concentração do vírus, pelo menos, vários litros de água em um volume muito menor, um procedimento que geralmente inclui duas etapas de concentração em série. Este procedimento um pouco pesado ea variabilidade observada em recuperações viral significativamente prejudicar o processamento simultâneo de um grande número de amostras de água.
A fim de eliminar o gargalo causado pelos procedimentos de duas etapas que temos aplicado um protocolo um passo desenvolvido em Studie anteriors e aplicável a uma diversidade de matrizes de água. O procedimento inclui: acidificação das amostras de dez litros de água, floculação por leite desnatado, sedimentação por gravidade dos materiais floculados, a coleta do precipitado e centrifugação, ressuspensão do precipitado em 10 ml de tampão fosfato. O concentrado viral é usado para a extração de ácidos nucléicos virais e os adenovírus específicas e polyomaviruses de interesse são quantificados por qPCR. Elevado número de amostras pode ser simultaneamente analisadas por este método de concentração de baixo custo.
O procedimento foi aplicado para a análise das águas balneares, água do mar e água do rio e, neste estudo, apresentamos os resultados da análise de amostras de águas subterrâneas. Este método de alto rendimento quantitativo é confiável, simples e rentável.
Protocolo
1. Concentração de partículas virais presentes em amostras de água
- Coleta e acondicionamento de amostras de água
- Coletar um mínimo de 2 repetições de 10 L por amostra em recipientes de plástico com fundo plano e uma amostra extra como um controle do processo. Esta última amostra será enriquecida com uma quantidade conhecida de partículas virais e usado como um controle.
Nota: É recomendado ter material separado especiais (garrafas, tubos, etc) para amostras fortificadas. - Verifique a calibragem dos conductimeter e recalibrar se necessário. Prepare um controle negativo usando água da torneira previamente ajustado para a condutividade adequada (ver abaixo de 1,6) em um recipiente plástico de 10 L extras.
- Para amostras fortificadas: Adicionar o volume padrão do vírus de controle (cerca de 10 5 cópias do genoma por 10 L de água) para a amostra. Mix agitando evitando respingos e aerossóis. Controles positivos poderia consistir em uma cepa incomum de adenovírus such como HAdV-35 ou um bacteriófago como MS2.
- Se a amostra apresenta elevada quantidade de material em suspensão (areia ou outros materiais), deixe-o sedimento por 15 minutos. Transferir a água para um novo recipiente.
- Ajustar o pH da amostra de água para 3,5 (± 0,1) pela adição de 1 N HCl. Este passo é importante para a concentração do vírus, por isso certifique-se o pH foi ajustado corretamente. Misture a água por agitação vigorosa ao adicionar o HCl. (Nota: Se o pH é inferior a 3,5 adicione 1 M NaOH).
- Ajustar a condutividade. Se a amostra tem uma condutividade de 1,500 mS / cm ou superior, este passo não é necessário. Se a condutividade é menor do que 1500 mS / cm a formação de material floculado (flocos) não é garantido para ajustar a condutividade a 1500 mS / cm pela adição de sais do mar artificial (Sigma). Misture vigorosamente por meio de agitação durante a adição dos sais do mar.
- Registre o pH das amostras antes e após o condicionamento, bem como ums o volume de HCl utilizado. A condutividade também devem ser registradas após o ajuste do pH. Sempre desinfectar os eletrodos pH metros e conductimeter com uma solução de HCl frescas, elimine o cloro com uma solução de 10% de sódio e, finalmente, tiosulphate enxágüe com água destilada.
- Coletar um mínimo de 2 repetições de 10 L por amostra em recipientes de plástico com fundo plano e uma amostra extra como um controle do processo. Esta última amostra será enriquecida com uma quantidade conhecida de partículas virais e usado como um controle.
- Preparação de pré-floculação de leite desnatado 1% (PSM)
- Verificar a calibração do medidor de pH e os conductimeter e recalibrar se necessário.
- Prepare pré-floculada solução de leite desnatado (1% PSM, w / v), dissolvendo 10 g de leite em pó desnatado (Difco) em 1 L de água do mar artificial (33,3 g dissolve de sais do mar artificial em 1 L de água da torneira sem cloro e autoclave) e cuidadosamente ajustar o pH para 3,5 com HCl 1N. Os flocos devem ser visíveis. Prepare a solução antes de ser utilizado ou armazenar a 4 ° C por 24 h. Para dechlorination use 1 ml de solução tiosulphate 10% por 100 ml de água.
- Floculação de partículas virais presentes em amostras de água
- Adicione 100 ml de PSM 1% para a amostra de água de 10 L.
- Mexa as amostras para 80-10 h para permitir que o vírus para absorver a flocos. Usar um timer para desligamento da agitação após 8-10 h.
- Pare a agitação e deixar o sedimento flocos pela ação da gravidade por 8-10 h.
- Coleta e re-dissolução dos flocos. Centrifugação
- Retire o sobrenadante usando uma bomba peristáltica e uma pipeta de plástico ligado a um tubo de plástico. Para amostras fortificadas o sobrenadante deve ser recolhida em um frasco e desinfectados de acordo com procedimentos internos. Em todos os casos TOME CUIDADO para não recolher o sedimento.
- Recolher os sedimentos com o flocos (aproximadamente 500 ml) em um frasco de centrífuga.
- Equilibrar as panelas pela adição de pH 3,5 PSM.
- Centrifugar as panelas em uma centrífuga de alta velocidade a 8.000 xg por 30 min a 4 ° C. Assim que a centrífuga pára, remova cuidadosamente os vasos centrífuga da centrífuga.
- Muito gcantes deitar fora e desprezar o sobrenadante. Siga as medidas apropriadas para o material infeccioso.
- Adicionar 7 ml de tampão fosfato de dissolver o sedimento em cada frasco de centrífuga.
- Uma vez que os flocos foram dissolvidas, medir e adicionar tampão fosfato para chegar a um volume total de 10 ml.
- Homogeneizar o concentrado viral em vórtice e distribuir os 10 ml em microtubos limpos que devem ser congeladas a -80 ° C até ser necessário, em uma análise mais aprofundada.
2. Extração de ácido nucléico
- Realizar uma extração de ácido nucléico com o Viral RNA Mini Kit QIAamp seguir as instruções do fabricante. Este kit permite o uso de uma plataforma automatizada (como Qiacube, Qiagen).
3. PCR quantitativo de adenovírus humano (HAdV), polyomaviruses JC (JCPyV), adenovírus suína (PAdV) e polyomaviruses bovina (BPyV)
- Quantificação de cópias do genoma nas amostras
- Prepararo mix qPCR em uma área limpa em separado usando TaqMan Ambiental PCR Master Mix 2x (Applied Biosystems). A reação ocorre em uma placa de reação de 96 poços ópticos cobertos com capas adesivas óptica. Concentrações do Mix Master, primers e sondas estão descritos na Tabela 1.
- Uma vez que a mistura foi preparada, 15μl alíquota em cada poço, incluindo os controles (ver 3.2). O volume total de uma reação após a adição de destino será 25μl (mix + 15μl de amostra 10μl ou standard).
- Adicionar o ácido nucléico extrações das amostras (10μl) em uma área separada. Executar direta e uma diluição de dez vezes em água purificada de cada amostra em duplicata. Cobrir os poços contendo as amostras com parte de uma cobertura adesiva, manter a outra parte da cobertura para a etapa seguinte.
- Adicionar diluições das suspensões DNA padrão (10μl) de 10 GC/10μl 0-10 6 por triplicado e usando uma micropipeta utilizados exclusivamente para o standard DNA. É aconselhável acrescentar os padrões numa área equipada com radiação UV para a destruição de plasmídeo de DNA e para limpar a micropipeta após cada utilização. Cobrir os poços contendo os padrões com a tampa adesiva pré-cortadas.
Nota: Para preparar suspensões padrão a ser utilizado na quantificação de cópias do genoma, a região do DNA alvo deve ser clonado em um plasmídeo e linearizado. No seguinte endereço você vai encontrar um procedimento detalhado de como criar curvas padrão com modelos de plasmídeo de DNA para ser usado em qPCR:
http://www.appliedbiosystems.com/support/tutorials/pdf/quant_pcr.pdf - Executar a qPCR em um sistema adequado selecionando os parâmetros adequados (considerando o uso de cobertura adesiva eo volume total em cada poço, etc). Ativação seguintes do Ouro AmpliTaq por 10 min a 95 ° C, 40 ciclos de amplificação são feitas da seguinte forma: 15 s em 95 ° Ce 1 min a 60 ° C para HAdV, JCPyV e BPyV, e 15 s, 95 ° C, 20s a 55 ° C e 20 a 60 ° C para PAdV.
- Uma vez que as reações sejam concluídas, armazenar dados e resultados, conforme descrito no manual do usuário do equipamento utilizado. A quantidade de DNA vai ser definida como a mediana dos dados obtidos após a correção do fator de diluição, quando necessário.
- Controles
- Use os controles positivos e negativos. O ensaio deve incluir mais de um controle não-modelo (NTC) para provar mistura não produz fluorescência. Aconselha-se a executar o controle de processo positivo, a fim de avaliar a inibição enzimática potencial devido aos inibidores presentes nas amostras estudadas.
- Resultados de ensaios de qPCR registro de duas diferentes diluições do DNA padrão e do controle do processo. Utilizar os resultados para preparar gráficos de controle para controle de qualidade (QC) programas relacionados com a sensibilidade e eficiência dos ensaios.
- Confirmação daresultados
- Os resultados positivos podem ser ainda confirmada utilizando sequenciamento nested-PCR e de nucleotídeos dos amplicons, produzindo dados adicionais sobre as sequências de nucleotídeos das estirpes detectadas 1,5,6,7,9,12.
Seguindo o procedimento descrito, os vírus humanos e animais têm sido detectadas e quantificadas as águas balneares, água do mar e água do rio 2,3. Como um exemplo representativo, amostras de água subterrânea de áreas com altos níveis de nitratos foram avaliados para definir as fontes de contaminação. Amostras de dez litros de água foram coletadas a partir de quatro diferentes poços em áreas rurais de uma região do nordeste da Espanha. Cinco repetições foram coletadas em cada uma réplica bem estar semeada com adenovírus humano 2 utilizadas como controle do processo. As amostras foram processadas de acordo com o protocolo representado na Figura 1. Os quatro repetições analisados em um dos quatro locais estudados apresentaram resultados positivos para PAdV (valor médio 7,74x10 2 GC / L), que estaria relacionada à presença de suspensões de porcos nos arredores do local de amostragem e apoiaria a contaminação fecal de suíno como fonte de nitratos nas águas subterrâneas (Tabela 2).
4. Resultados representativos:
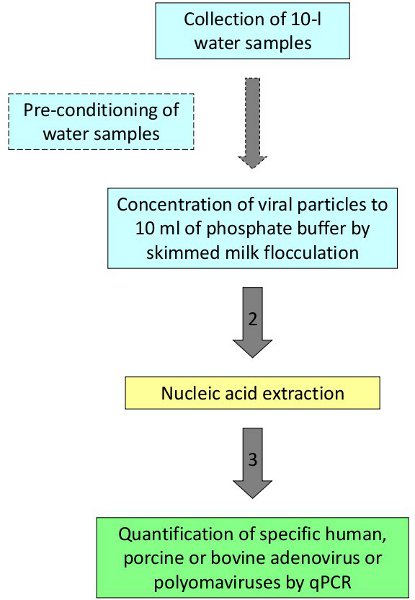
Figura 1. Procedimento para a detecção e quantificação de vírus na água.
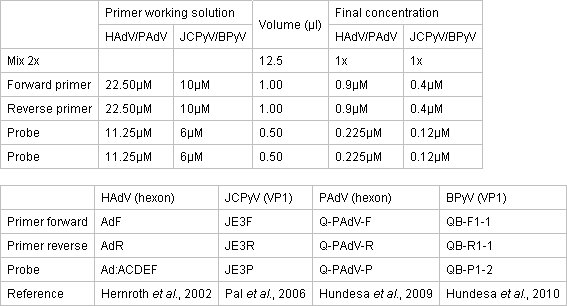
Tabela 1. Concentração de primers e sondas para ensaios de qPCR.

Tabela 2. Detecção e quantificação de animais e humanos adenovírus e polyomaviruses em amostras de água do solo.
n número de repetições analisadas
Porcentagem% de positivos replica
(-) Não detectado
Discussão
O procedimento descrito iria cumprir as condições para um método de ajuste para a rotina dos laboratórios de saúde pública e ambiental: reprodutível, confiável, simples e rentável. O protocolo é simples, no entanto ele deve ser seguido com atenção. Baixa condutividade nas amostras sem adicionar a concentração de sais solicitado artificial de água do mar reduziria drasticamente a recuperação de vírus como seria o caso se o tempo de agitação de floculação é significativamente reduzido (menos d...
Divulgações
Dois pedidos de patente foram apresentadas em 2009 para proteger a propriedade intelectual de protocolos para a quantificação de PAdV e BPyV.
Agradecimentos
Este trabalho foi parcialmente financiado pelo Governo espanhol "Ministerio de Educación y Ciencia" (projeto AGL2008-05275-C01/ALI), pela União Europeia Quadro de Investigação sete projectos financiados VIROBATHE (Contrato n º 513648), VIROCLIME (Contrato n º 243923 ) e pela Agência Catalã da Água, a Agência Catalã de l'Aigua (ACA), Departamento de Controle i Millora dels Ecosistemes Aquático. Durante o estudo desenvolvido Marta Rusiñol era um companheiro do Governo catalão "AGAUR" (FI-DGR).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Centrífuga de alta velocidade (8.000 xg) | Berckman Coulter | Avanti J-20XP | |
| medidor de pH termômetro, e conductimeter | Afora | LPPC3003 | |
| Tubos de plástico 100-200 cm de comprimento | Deltalab | 350059 | |
| Estéril graduado pipetas descartáveis | Labclinics | PN10E1 | |
| Estéril de tubos de plástico de 1,5 e 10-15 mL (Eppendorf, Falcons, etc) | Afora | KA298/00 | |
| Potes de centrifugação (500 mL) | Fisher Scientific | SE5753512 | |
| Agitadores magnéticos e ímãs (um poramostra) | Fisher Scientific | 10510 | |
| Vidro ou plástico recipientes, com fundos planos para permitir o uso de agitadores magnéticos | Deltalab | 191642 | |
| A bomba peristáltica para a remoção do sobrenadante (ou uma bomba de vácuo jacto de água) | Watson-Marlow | 323E / D | |
| Temporizador para switch-off a agitação após 8-10 horas | Deltalab | 900400 | |
| Ácido clorídrico (0,1 N e 1N) | Panreac | 141020.1611 | |
| Hidróxido de sódio (1N) | Panreac | 131687.1211 | |
| Sais do mar artificial de água do mar | Sigma | S9883 | |
| Leite desnatado (SM) | Difco | 232100 | |
| Tampão fosfato pH 7, 5 | 1:2 v / v de estéril Na 2 HPO 4 0,2 M e NaH 2 PO 4 0,2 M em pH 7,5 | ||
| Tiossulfato | Panreac | 121879.1209 | Fazer uma solução de 10% em água |
| QIAamp Viral RNA Mini Kit | Qiagen | 52904 | |
| De 96 poços da placa de reacção óptica (500 unidades) | Applied Biosystems | 43426659 | |
| Óptica cobre adesiva (100 unidades) | Applied Biosystems | 4311971 | |
| TaqMan Ambiental PCR Master Mix 2x | Applied Biosystems | 4396838 |
Referências
- Bofill-Mas, S., Clemente-Casares, P., Major, E. O., Curfman, B., Girones, R. Analysis of the excreted JC virus strains and their potential oral transmission. J. Neurovirol. 9 (4), 498-507 (2003).
- Bofill-Mas, S., Albinana-Gimenez, N., Clemente-Casares, P., Hundesa, A., Rodriguez-Manzano, J., Allard, A., Calvo, M., Girones, R. Quantification and stability of human adenoviruses and polyomavirus JCPyV in wastewater matrices. Appl. Environ. Microbiol. 72 (12), 7894-7896 (2006).
- Calgua, B., Mengewein, A., Grunert, A., Bofill-Mas, S., Clemente-Casares, P., Hundesa, A., Wyn-Jones, A. P., López-Pila, J. M., Girones, R. Development and application of a one-step low cost procedure to concentrate viruses from seawater samples. J. Virol. Methods. 153 (2), 79-83 (2008).
- Hernroth, B. E., Conden-Hansson, A. C., Rehnstam-Holm, A. S., Girones, R., Allard, A. K. Environmental factors influencing human viral pathogens and their potential indicator organisms in the blue mussel, Mytilus edulis: the first Scandinavian report. Appl. Environ. Microbiol. 68, 4523-4533 (2002).
- Hundesa, A., Bofill-Mas, S., de Motes, M. a. l. u. q. u. e. r., Rodriguez-Manzano, C., Bach, J., Casas, A., M, ., Girones, R. Development of a quantitative PCR assay for the quantitation of bovine polyomavirus as a microbial source-tracking tool. J. Virol. Methods. 163 (2), 385-389 (2010).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Albinana-Gimenez, C., Rodriguez-Manzano, N., Bofill-Mas, J., Suñen, S., E, ., Girones, R. Development of a qPCR assay for the quantification of porcine adenoviruses as an MST tool for swine fecal contamination in the environment. J. Virol. Methods. 158 (1-2), 130-135 (2009).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Bofill-Mas, C., Albinana-Gimenez, S., N, ., Girones, R. Identification of human and animal adenoviruses and polyomaviruses for determination of sources of fecal contamination in the environment. Appl. Environ. Microbiol. 72 (12), 7886-7893 (2006).
- Layton, B. A., Walters, S. P., Lam, L. H., Boehm, A. B. Enterococcus species distribution among human and animal hosts using multiplex PCR. J. Appl. Microbiol. 109, 539-547 (2010).
- de Motes, M. a. l. u. q. u. e. r., Clemente-Casares, C., Hundesa, P., Martín, M., Girones, R. Detection of bovine and porcine adenoviruses for tracing the source of fecal contamination. Appl. Environ. Microbiol. 70 (3), 1448-1454 (2004).
- Pal, A., Sirota, L., Maudru, T., Peden, K., Lewis, A. M. Real-time PCR assays for the detection of virus-specific DNA in simples with mixed populations of polyomaviruses. J. Virol. Methods. 135 (1), 32-42 (2006).
- Stapleton, C. M., Kay, D., Wyer, D. a. v. i. e. s., Watkins, C., Kay, J., McDonald, C., Porter, A. T., J, ., Gawler, A. Evaluating the operational utility of a Bacteroidales quantitative PCR-based MST approach in determining the source of faecal indicator organisms at a UK bathing water. Water Res. 43, 4888-4899 (2010).
- Wang, J., Horner, G. W., Keef, O., S, J. Detection and molecular characterization of bovine polyomavirus in bovine sera in New Zealand. N. Z. Vet. J. 53, 26-30 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados