Method Article
Transdução de células humanas com Polymer-complexado Lentivirus Ecotropic para reforço de Biossegurança
Neste Artigo
Resumo
Lentivírus são um valioso instrumento de pesquisa para explorar a função do gene, no entanto, os pesquisadores podem querer evitar a produção de codificação lentivírus pantropic conhecida ou suspeita de oncogenes. Como alternativa, apresentamos um protocolo mais seguro para o uso de lentivírus ecotropic em células humanas modificadas para expressar o receptor mSlc7a1 ecotropic.
Resumo
Caule e tumor estudos de biologia celular muitas vezes exigem transdução viral das células humanas com oncogenes conhecidos ou suspeitos, levantando questões importantes de segurança para o pessoal de laboratório. Lentivírus Pantropic, como o comumente usado VSV-G pseudotype, são uma ferramenta valiosa para estudar a função do gene porque pode converter muitos tipos de células, incluindo células não-divisão. No entanto, os pesquisadores podem querer evitar a produção de vírus e centrifugação pantropic codificação oncogenes devido ao maior nível de biossegurança requisitos manuseio e segurança. Vários oncogenes potentes, incluindo c-Myc e SV40 antígeno T grande, são conhecidos por aumentar a produção de células-tronco pluripotentes induzidas (IPSC). Todos os outros conhecidos iPSC-induzir mudanças genéticas (OCT4, SOX2, KLF4, NANOG, LIN28, p53 e perda da função) também têm ligações ao câncer, tornando-os relativos à segurança relativamente alta também.
Embora estes vírus relacionados ao câncer são úteis no estudo de reprogramação celular e pluripotência, eles devem ser usados com segurança. Para tratar dessas questões de biossegurança, demonstramos um método para a transdução de células humanas com lentivírus ecotropic, com ênfase adicional sobre o custo reduzido e fácil manuseamento. Nós produzimos lentivírus ecotropic com título suficientemente elevado para transduzir superior a 90% do receptor-expressando células humanas expostas ao vírus, validando a eficácia desta abordagem.
Lentivírus é frequentemente concentrada por ultracentrifugação, no entanto, este processo leva várias horas e pode produzir aerossóis infecciosos para humanos pesquisadores biomédicos. Como alternativa, as partículas virais podem ser mais segura sedimentada em células por complexação com sulfato de condroitina e polibrene (CS / PB). Esta técnica aumenta a título funcional viral até 3 vezes nas células que expressam o receptor de forma estável retrovirus murino, com o tempo e custo insignificante acrescentou. Transdução de fibroblastos dérmicos humanos (HDFS) é maximamente melhorada usando CS / PB concentrações aproximadamente 4 vezes menor que o valor ideal relatado anteriormente para linhas celulares de cancro, sugerindo que a concentração de polímero deve ser ajustada para o tipo de célula-alvo de interesse. Nós, portanto, descrever o uso de brometo de tetrazólio-metiltiazolildifenil (MTT) para ensaio de toxicidade do polímero em um novo tipo de célula. Observamos viabilidade equivalente a HDFS após a transdução viral usando complexação de polímeros ou a dose padrão de polibrene (PB, 6 mg / ml), indicando toxicidade aguda mínima.
Neste protocolo, descrevemos o uso de lentivírus ecotropic para superexpressão de oncogenes em células humanas, reduzindo os riscos de biossegurança e aumentar a taxa de transdução. Nós também demonstrar o uso de complexação de polímeros para aumentar a transdução, evitando aerossol de formação de centrifugação das partículas virais.
Protocolo
1. Lentivirus production, harvest, and freezing
- Consult your institutional safety official before beginning this protocol, and follow their recommended safety guidelines.
- Day 1. Start with healthy, rapidly growing 293T cells to produce virus. Plate the cells at 5 x 106 cells per 10 cm plate. Use antibiotic-free 293T medium (high-glucose DMEM with 10% FBS and 4 mM L-glutamine) for virus production.
- Day 2. In the late afternoon, transfect 293T cells as follows (numbers given are for one 10 cm plate). Let all reagents warm up to room temperature. Pipette 375 μl OptiMEM into a microcentrifuge tube, then add 25 μl Fugene HD. Do not allow undiluted Fugene to contact the surface of the tube.
- In a microcentrifuge tube, mix:
- 5 μg transfer plasmid (Slc7a1, target vector, or fluorescent control vector)
- 3.75 μg packaging plasmid (pCMV-dR8.91 or psPax2)
- 1.25 μg envelope plasmid (pMD2.G for pantropic, pHCMV-EcoEnv for ecotropic)
- serum-free OptiMEM to 100 μl
- Combine the two tubes and incubate the mixture 20-30 minutes at room temperature.
- Change the medium on the 293T cells to 10 ml fresh antibiotic-free 293T medium. Add the Fugene/plasmid mix drop-wise to the plate and incubate overnight at 37°C, 5% CO2.
- Day 3. Change medium on the 293T cells to 10 ml fresh antibiotic-free 293T medium. Be gentle, because 293T cells adhere only loosely and can slough off by media pipetted too forcefully onto the monolayer. Incubate for two days in a humidified incubator for virus production.
- Day 5. Harvest virus and filter with a 0.45 mm low protein binding filter. Use immediately or dispense into single-use aliquots and freeze at -80°C. Frozen pantropic and ecotropic virus should be re-titered after it has been stored for six months and one month, respectively.
- Titer the virus as follows, using cells that are relatively amenable to transduction. Transduce cells with fluorescent control virus overnight using serial dilutions (e.g. 1:10, 1:100, 1:1000) in fresh medium with 6 μg/ml PB. Change to fresh medium the next day. Allow the cells two days after transduction to begin expressing the fluorescent protein, then determine the fraction of transduced cells by FACS. Calculate the titer in transforming units (TU) per ml, based on dilutions that yield < 15% transduction to minimize multiple transduction events.

2. Transduction of human target cells with murine retrovirus receptor Slc7a1
- Select a multiplicity of infection (MOI) = 2 to ensure that most cells will be transduced. For target cells that are resistant to transduction such as HDFs, a higher MOI will be required; we dilute the viral supernatant only 1:2 to achieve transduction of a majority of the cells.
- Transduce target cells overnight with viral supernatant diluted in fresh culture medium with 6 μg/ml PB, which increases transduction by enhancing electrostatic interaction between the virus and target cell.1 Ideally one should use a minimal volume of virus, such as 1 ml for a 35 mm plate, because diffusion is a limiting factor in transduction efficiency.
- Culture cells for at least 48 hours after removing virus before transducing them with ecotropic virus, in order to ensure sufficient expression of the Slc7a1 receptor.
- (Optional) It is possible to use blasticidin to select for stably transduced cells expressing Slc7a1, if desired. A blasticidin kill curve should be generated in advance to determine the lowest effective concentration, generally between 2 – 10 μg/ml, that kills all untransduced target cells in 7 days. About 2 days after removing the Slc7a1 virus, switch the transduced cells to medium containing blasticidin. Culture the cells in blasticidin-containing medium for 7 days, at which point all remaining cells will stably express the retrovirus receptor at which point they can be transduced with ecotropic virus as well as banked for future use as a stable Slc7a1-expressing line.
3. Polymer complex titration to determine toxicity
- Day 1. Plate cells at 5000 cells/well in a 96-well plate, allowing at least triplicate wells for each experimental group. Include untransduced cells in complete medium to provide a baseline value for healthy cells, as well as samples consisting of cells in serum-free medium to induce growth arrest as a control. In parallel, plate cells in an appropriate format (such as a 24-well plate) for microscopic or FACS-based analysis of transduction efficiency in each experimental condition.
- Day 2. Transduce cells in plates set up for both the MTT and FACS analyses with virus encoding GFP, at an MOI of 0.5 to transduce ~40% of target cells. Test varied concentrations of CS/PB (e.g. 50, 100, 200, 400, 600, and 800 mg/ml of each component), as well as 6 μg/ml PB, to determine optimal amounts. Generate polymer complexes as described in Part 4, below.
- Day 3. Remove virus-containing medium and replace with fresh medium. Return the plates to a humidified incubator.
- Day 5. Analyze FACS plate to determine the transduction efficiency with each polymer concentration.
- Day 6. Remove the medium from all wells of the MTT plate and replace with 100 μl MTT solution (1 mg/ml MTT in complete medium). Culture for three hours in a humidified incubator to allow MTT to be reduced in the mitochondria of metabolically active cells.
- Remove MTT solution and replace with 200 ml MTT solvent (0.1 N HCl, 0.1% Igepal CA-630 in isopropanol).
- Incubate for two hours at room temperature or until all of the purple MTT formazan precipitate is dissolved. Read the absorbance on a microplate reader at 570 nm, subtracting the background reading at 690 nm.
- Select the optimal polymer concentration that produces maximum enhancement of transduction, as determined by FACS, with minimal effect on metabolic activity, as determined by MTT. For HDFs, we selected 100 μg/ml CS/PB based on the data shown in the Representative Results, below.
4. Ecotropic transduction with polymer complexation
- Prepare sterile-filtered stock solutions of PB and chondroitin sulfate at 20 mg/ml in water. Aliquot and store at -20°C.
- Pipette viral supernatant into a microcentrifuge tube and dilute to the desired final concentration (e.g. MOI of 2) with fresh culture medium. Add equal volumes of PB and chondroitin sulfate (concentrations determined in step 3 above) in succession, flicking the tube to mix after each addition. The viral mixture will immediately become cloudy as precipitates form. Incubate the viral mixture at room temperature for 5 minutes to allow complex formation.
- Remove media from the receptor-expressing target cells, replace with the viral mix, and incubate overnight at 37°C, 5% CO2. After removing the viral mix, wash the surface of the cells twice with PBS to aid in removing viral complexes. Complete removal is not necessary; we have observed no adverse effects on cell health from residual polymer complexes.
5. Verifying specificity of ecotropic transduction
- When producing ecotropic virus for the first time, it is prudent from a safety perspective to verify that the virus is unable to transduce unmodified human cells. Transduce human cells with ecotropic lentivirus at relatively high concentration (only a 1 to 2-fold dilution of viral supernatant in fresh medium) overnight with 6 μg/ml PB or optimized CS/PB concentration.
- Remove virus-containing medium and replace with fresh medium. After incubating cells for 2 days, validate transgene expression by FACS using fluorescent vectors and/or by RT-PCR with transgene-specific primers.
6. Representative results:
Fig. 1A shows the lentivirus production process, and Fig. 1B shows transduction of human cells with ecotropic lentivirus, including pre-transduction with murine retrovirus receptor Slc7a1. For titering virus, we use a human rhabdomyosarcoma cell line stably transduced with Slc7a1 (Slc-hRMS). When using fluorescent control vectors to monitor transduction efficiency, we routinely achieve > 90% transduction efficiency of Slc-hRMS with ecotropic virus, as shown in Fig. 2A and 2B. Transduction rates of HDFs are generally lower because the cells have not been blasticidin-selected for receptor expression (Fig. 2C). Titers of ecotropic lentivirus are generally 10-20% of VSV-pseudotyped virus when measured on Slc-hRMS (Fig. 2D).
One freeze-thaw cycle reduces titer of ecotropic virus by 16 - 3%, equal to titer loss during a single freeze-thaw cycle of VSV-pseudotyped virus (p > 0.05). Contrary to previous reports,2 we observe no positive effect on virus titer from flash freezing in dry ice. Rather, we achieve higher post-thaw titers of either pseudotype by simply placing tubes of virus into a -80°C freezer (data not shown).
The MTT viability assay allows sensitive detection of growth arrest in target cells. Transduction with virus plus concentrations of CS/PB up to 800 μg/ml has no effect on HDF metabolism (Fig. 3A). Exposure to CS/PB without virus also has no toxic effect on cells (data not shown). FACS analysis of HDFs transduced with virus plus various concentrations of CS/PB shows enhancement of transduction compared to PB alone (Fig. 3B). The maximum enhancement occurs at 100 μg/ml CS/PB (Fig. 3C), several-fold lower than previously reported values.3 Thus, it is important to optimize conditions for any given target cell type.
Complexation with CS/PB enhances the observed titer roughly 3-fold in Slc-hRMS (Fig. 4A, p < 0.01). In practice, this yields a greater effect on transduction efficiency at low virus concentrations than at higher concentrations (Fig. 4B), which is most likely due to multiply transduced cells and receptor saturation at higher virus concentrations.
Transduction with ecotropic virus is specific for cells expressing murine retrovirus receptor. When transducing unmodified human cells with ecotropic virus, we have not observed fluorescence greater than the untransduced background whether using PB or CS/PB, as shown in Fig. 5A. Microscopically, HDFs show no transduction in the absence of receptor (Fig. 5B) while pre-transduction with receptor results in fluorescent cells (Fig. 5C).
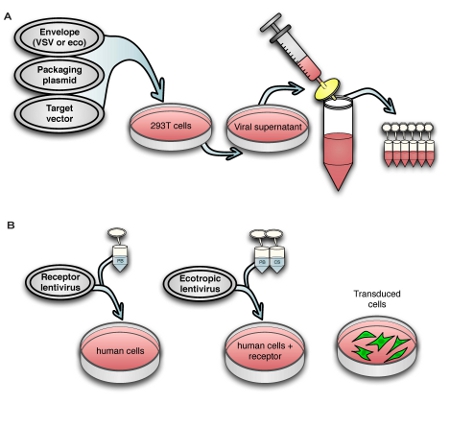
Figure 1. Schematic view of (A) the virus production process and (B) transduction of human cells with murine retrovirus receptor followed by ecotropic lentivirus.
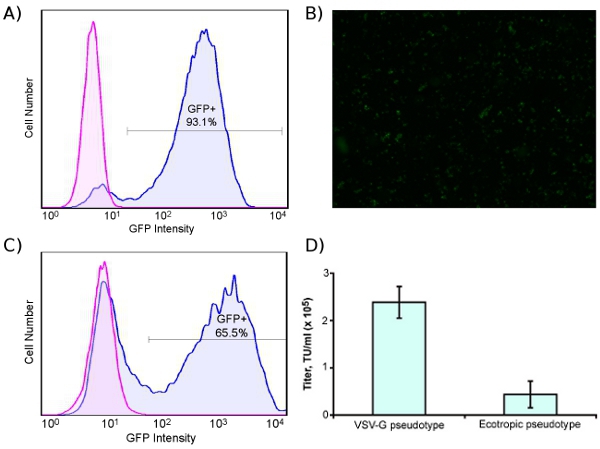
Figure 2. High-efficiency transduction of human cells with ecotropic lentivirus encoding GFP. Cells were pre-transduced with murine retrovirus receptor Slc7a1. (A) Human rhabdomyosarcoma cell line blasticidin-selected for Slc7a1 (Slc-hRMS), transduced (blue) or untransduced (pink) with GFP. (B) Fluorescent micrograph of ecotropic-transduced Slc-hRMS (4X). (C) HDFs transduced (blue) and untransduced (pink) with ecotropic GFP lentivirus; cells were transduced with Slc7a1 two days prior to ecotropic transduction. (D) Titer of VSV-G pseudotyped and ecotropic lentivirus, measured on Slc-hRMS.
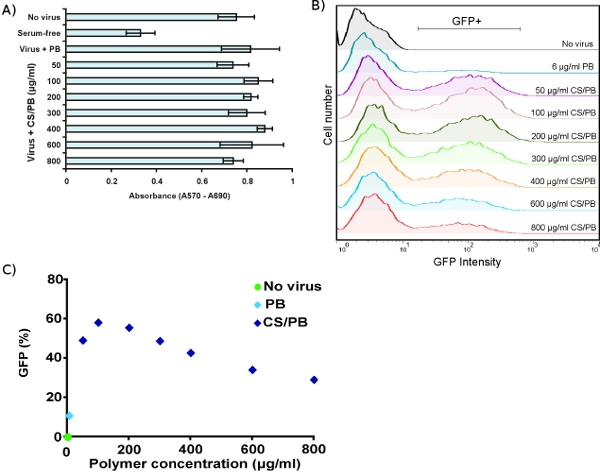
Figure 3. Optimizing chondroitin sulfate/polybrene (CS/PB) concentrations in human dermal fibroblasts. (A) Viability of HDFs measured by MTT assay after transduction in the presence of PB only or with varied concentrations of CS/PB. (B) Enhancement of transduction efficiency in HDFs by different concentrations of CS/PB, measured by FACS. (C) Quantification of transduction enhancement, showing that maximum transduction occurs at 100 μg/ml CS/PB.
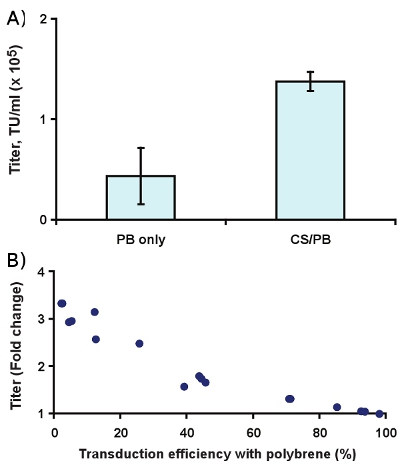
Figure 4. Effect of 400 μg/ml CS/PB on transduction of Slc-hRMS with ecotropic lentivirus. (A) Titer enhancement, and (B) fold change in transduction rate compared to 6 μg/ml polybrene alone.
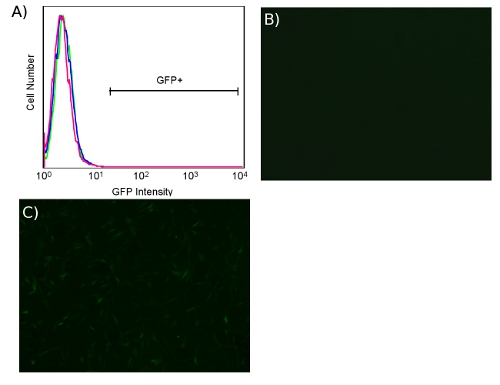
Figure 5. Lack of ecotropic transduction of HDFs in the absence of murine retrovirus receptor Slc7a1. (A) FACS plot of BJ human fibroblasts, untransduced (pink) or transduced (blue) with ecotropic GFP lentivirus in both cases in the absence of receptor Slc7a1. BJ human fibroblasts transduced with ecotropic GFP lentivirus, without (B) and with (C) pre-transduction with receptor Slc7a1 (4X).
Discussão
Recombinante gammaretrovirus ecotropic baseado em Moloney vírus da leucemia murina (MLV) e seu receptor mSlc7a1 são bem estudadas e amplamente disponível, tendo sido utilizada por mais de 20 anos para entregar transgenes em células de camundongos. Gammaretrovirus Ecotropic também tem sido usado mais recentemente para entregar oncogenes às células humanas;. No contexto da reprogramação celular, o uso de mSlc7a1 para evitar a geração de vírus amphotropic abrigar oncogenes humanos está bem estabelecida 4,5 No entanto, lentivírus oferece vantagens significativas sobre gammaretrovirus na transdução de populações de células refratário, 6, incluindo células primárias que muitas vezes são alvos desejáveis para a reprogramação, porque o complexo de pré-integração lentiviral permite transdução de não-divisão das células. 7
Lentivírus têm sido produzidos com dezenas de pseudotipos diferentes, incluindo MLV, em um esforço para alterar o tropismo do vírus, toxicidade e outras propriedades. 8 lentivírus ecotropic MLV-pseudotyped tem sido usado para a transdução de células mouse, 9, mas raramente tem sido utilizado em células humanas . 10 Por isso, propomos o uso de MLV-pseudotyped lentivírus ecotropic como um veículo de custo, seguro e eficaz, e altamente eficiente para entregar oncogenes conhecidos ou suspeitos, incluindo celulares fatores de reprogramação, para as células humanas.
É fundamental notar que este protocolo não eliminar totalmente a necessidade de produzir e utilizar lentivírus pantropic, mas sim, este protocolo separa o oncogene (s) de que o vírus pantropic, isolando pesquisadores do potencial de auto-inoculação com câncer relacionados com o vírus. O mSlc7a1 proteína e sua hSlc7a1 homólogo humano são expressos ubiquitously transportadores de aminoácidos sem tumorigenicidade conhecidos ou capacidade de conferir uma vantagem seletiva em células de crescimento destinatário, 11 mSlc7a1 realização de um risco relativamente baixo para incorporação vírus amphotropic. Esta etapa adicional pode ser particularmente útil em laboratórios de vírus falta dedicado ou a cultura de tecidos do nível de biossegurança exigido.
Em algumas situações pode ser possível eliminar completamente o uso de vírus pantropic por transfecting o Slc7a1 plasmídeo diretamente em células-alvo, no entanto, muitas células que seriam alvos úteis desta técnica também são refratários a transfecção. Como alternativa, a capacidade de isolar Slc7a1-transduzidas células pela seleção blasticidin significa que VSV-G lentivírus pseudotyped pode ser usado uma vez para gerar um estoque de células que expressam receptores, após o qual o vírus ecotropic pode ser usada rotineiramente para transduzir essas células para muitos experimentos. Pesquisadores devem sempre seguir as suas orientações de segurança institucional para trabalhar com qualquer lentivírus, independentemente do seu tropismo.
Os títulos de vírus ecotropic alcançado com este protocolo são moderadamente inferiores VSV-pseudotyped vírus, geralmente 10-20% do título de vírus pantropic, de acordo com estudos anteriores. 9 Estes títulos foram medidos em células humanas de maneira estável transduzidas com Slc7a1, de modo a diminuir título observado para o vírus ecotropic pode ser em parte devido a expressão variada do gene do receptor em células-alvo. No entanto, os títulos virais obtidas em nosso protocolo são mais do que suficiente para a maioria das aplicações e levar a transdução de a maioria das células, em alguns casos> 90% das células.
Centrifugação técnicas baseadas são comumente usados para concentrar as partículas virais. No entanto, requer várias horas de centrifugação, gera aerossóis infecciosos, e pode resultar em perda significativa de partículas virais. 12 Como alternativa, a complexação com CS / PB pode ser usado para melhorar a transdução sem alterar tropismo viral. 3 Este método é rápido (5 minutos ) e barato (US $ 0,03 por 10 ml de vírus), enquanto cerca de triplicar o título observados. Nenhum equipamento especial ou reagentes de propriedade são necessários, e observou-se toxicidade aguda após a exposição mínima de HDFS para CS / PB, de acordo com trabalhos anteriores em outras linhagens celulares. 13 Uma desvantagem potencial deste protocolo é que alguns complexos microscopicamente visível polímero aderir as células durante vários dias em cultura. Não podemos descartar a possibilidade de que estes complexos, embora não abertamente tóxicos para as células, pode ter efeitos mais sutis sobre os processos celulares.
Aqui nós descrevemos uma metodologia para a segurança e eficiência transdução de células humanas com fatores oncogênicos. Esta abordagem deve ser de grande utilidade para pesquisadores que estudam oncogenes e biologia de células-tronco, incluindo as células iPS.
Divulgações
Agradecimentos
Financiamento para este projeto foi fornecido pelo Instituto da Califórnia de Medicina Regenerativa.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
|---|---|---|---|
| pLenti6/UbC/mSlc7a1 | Addgene | 17224 | Receptor MLV murino |
| pMD2.G | Addgene | 12259 | VSV-G envelope |
| pCMV-dR8.91 | D. Trono laboratório 14 | Embalagem plasmídeo (psPax2 plasmídeo equivalente está disponível a partir Addgene, Cat. Número 12260) | |
| pHCMV-EcoEnv | Addgene | 15802 | Envelope Ecotropic |
| FUGW | Addgene | 14883 | GFP controle plasmídeo |
| OptiMEM | Invitrogen | 31985 | |
| Fugene HD | Roche | 04 709 705 001 | |
| Hexadimetrina brometo (polibrene) | Sigma-Aldrich | H9268 | |
| Condroitina sal sulfato de sódio de cartilagem de tubarão | Sigma-Aldrich | C4384 | |
| Blasticidin S | Pescador | BP 2647100 | |
| Metiltiazolildifenil-brometo de tetrazolium (MTT) | Sigma-Aldrich | M2128 | |
| Igepal CA-630 | Sigma-Aldrich | I3021 |
Referências
- Davis, H. E., Rosinski, M., Morgan, J. R., Yarmush, M. L. Charged polymers modulate retrovirus transduction via membrane charge neutralization and virus aggregation. Biophys J. 86, 1234-1242 (2004).
- Marino, M. P., Luce, M. J., Reiser, J. Small- to large-scale production of lentivirus vectors. Methods Mol Biol. 229, 43-55 (2003).
- Landazuri, N., LeDoux, J. M. Complexation of retroviruses with charged polymers enhances gene transfer by increasing the rate that viruses are delivered to cells. J Gene Med. 6, 1304-1319 (2004).
- Ohnuki, M., Takahashi, K., Yamanaka, S. Generation and characterization of human induced pluripotent stem cells. Curr Protoc Stem Cell Biol. 4, 4A.2-4A.2 (2009).
- Hotta, A. EOS lentiviral vector selection system for human induced pluripotent stem cells. Nat Protoc. 4, 1828-1844 (2009).
- Reiser, J. Transduction of nondividing cells using pseudotyped defective high-titer HIV type 1 particles. Proc Natl Acad Sci U S A. 93, 15266-15271 (1996).
- Cullen, B. R. Journey to the center of the cell. Cell. 105, 697-700 (2001).
- Cronin, J., Zhang, X. Y., Reiser, J. Altering the tropism of lentiviral vectors through pseudotyping. Curr Gene Ther. 5, 387-398 (2005).
- Schambach, A. Lentiviral vectors pseudotyped with murine ecotropic envelope: increased biosafety and convenience in preclinical research. Exp Hematol. 34, 588-592 (2006).
- Koch, P., Siemen, H., Biegler, A., Itskovitz-Eldor, J., Brustle, O. Transduction of human embryonic stem cells by ecotropic retroviral vectors. Nucleic Acids Res. 34, e120-e120 (2006).
- Yoshimoto, T., Yoshimoto, E., Meruelo, D. Molecular cloning and characterization of a novel human gene homologous to the murine ecotropic retroviral receptor. Virology. 185, 10-17 (1991).
- Cepko, C. Large-scale preparation and concentration of retrovirus stocks. Curr Protoc Mol Biol. Chapter 9, Unit 9.12-Unit 9.12 (2001).
- Doux, J. M. L. e., Landazuri, N., Yarmush, M. L., Morgan, J. R. Complexation of retrovirus with cationic and anionic polymers increases the efficiency of gene transfer. Hum Gene Ther. 12, 1611-1621 (2001).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J Virol. 72, 9873-9880 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados